纳米银类医疗器械产品国内外不良事件分析
王瑜歆 辽宁省检验检测认证中心,辽宁省认证审评院 (辽宁 沈阳 110003)
内容提要: 通过收集美国MAUDE数据库以及中国知网(CNKI)数据库文献中与纳米银类医疗器械产品有关的不良事件信息,对收集到的不良事件文献进行汇总分析,得出纳米银类产品文献中报道的主要不良事件特点,为该类产品的研发生产、临床使用提供技术参考。
医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用[1]。纳米银(Nano-Ag)作为一种新型的人工抗菌材料,具有粒径微小、表面积大、活性大、熔点低的特点,其抗菌活性远大于传统的Ag+抑菌剂[2]。该材料在医疗器械行业领域主要用于伤口敷料、导尿管涂层、电极等产品。2008年以前我国共有75个纳米银类医疗器械产品,主要为贴敷类产品、凝胶类产品,主要使用部位有乳腺、胃、鼻腔、阴道等。目前我国只有7个纳米银类医疗器械产品,均为医用敷料,主要用于伤口愈合。其原因为鉴于纳米材料的特殊性,国家药品监督局对纳米银凝胶产品从2006年开始实施更加严格的监管,因此淘汰了一大批产品。
医疗器械不良事件是指已上市的医疗器械,在正常使用情况下发生的,导致或者可能导致人体伤害的各种有害事件[3]。通过对医疗器械不良事件的分析和评价,可以减少或者避免同类医疗器械不良事件的重复发生,降低患者、医务人员和其他人员使用医疗器械而造成伤害的风险。本文通过对国内外纳米银类产品的不良事件进行收集和分析,进一步探讨纳米银类产品的安全性,降低风险,减少不良事件重复发生,指导临床合理、安全用械。
1.资料与方法
1.1 一般资料
为收集国内外纳米银类产品不良事件,选择两个数据来源,外文资料选用FDA Manufacturer and User Facility Device Experience(MAUDE)数据库,中文资料选择中国知网期刊(CNKI)数据[4]。具体检索方法及结果如下。
检索FDA官网,查询纳米银类产品代码FRO,自2007年1月1日~2020年6月22日,经剔除非纳米银类产品及无效报告,共收集纳米银类产品有效不良事件报告共29份。
检索中国知网数据,剔除重复的、数据不详的文献,共收集纳米银类医疗器械产品临床使用文献53篇,共涉及4831例患者,其中出现不良事件的文献12篇。
下文采用FDA-Ag表示外文纳米银类产品不良事件数据,CNKI-Ag表示中文纳米银类产品不良事件数据,两部分数据各自形成不良事件汇总表,不良事件汇总表中包括网页地址、报告编号、生产厂家、品牌型号、报告日期、产品代码、事件日期、事件类型、事件具体描述等信息。
1.2 方法
为了进行统计分析,首先针对不同类型的报告进行不同的标注,标注采用人工加程序辅助的形式进行。对于伤害类事件标注了伤害人群、伤害类型、伤害时间;对于死亡类事件标注了死亡时间、是否与设备相关、死亡人员;针对故障类事件标注了故障部件、主要表现。为后续统计分析提供信息。本研究采用描述性统计分析方法。
2.结果
2.1 历年报告情况
按照报告日期年份排序,FDA-Ag、CNKI-Ag历年报告数据详见表1。
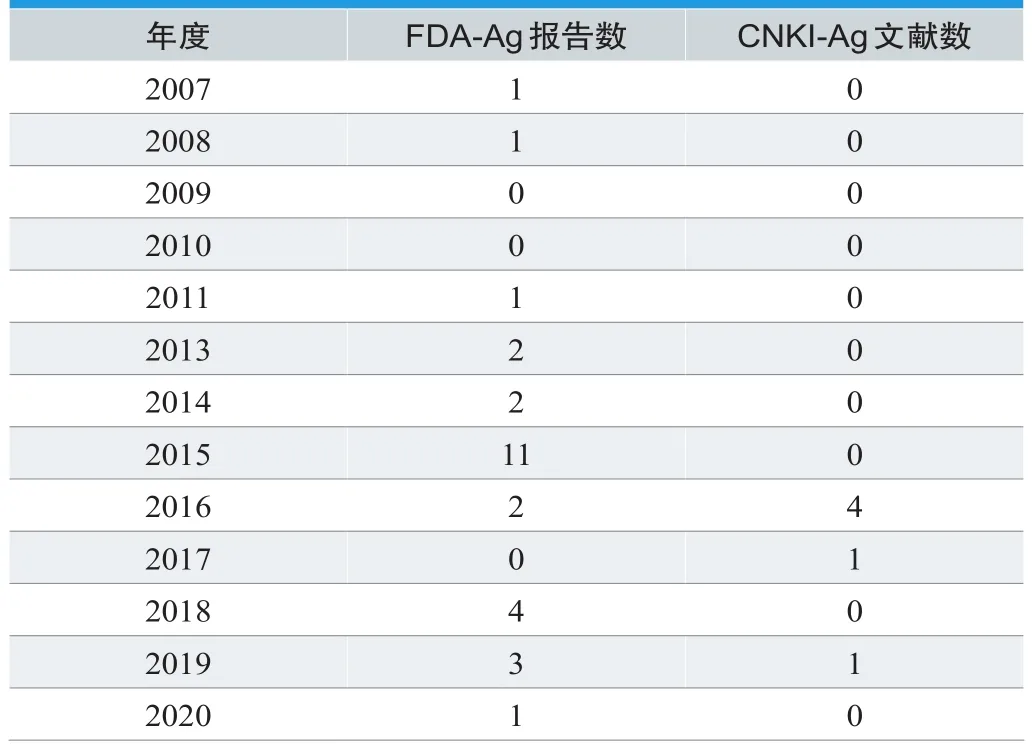
表1. 报告年度分布情况(n)
结果表明,2015年FDA-Ag报告数最多,占总报告数的39.30%,查阅报告发现,虽然报告时间为2015年,但是事件发生时间包含2013年和2014年。因此,推测出现这一突变的原因可能是美国食品药品监督管理部门在2015年加大了管理力度,并对之前没有上报的不良事件进行上报。2016年报告数量最多为4份,可能与国家药品监督管理局于2012年发布《国家食品药品监督管理局办公室关于纳米银类产品重新注册有关事宜的通知》有关,各纳米银生产企业以及使用单位开始关注该产品的相关风险。
2.2 死亡、伤害及故障类不良事件的报告情况
2007年~2020年,FDA-AG与CNKI-Ag均无死亡类不良事件报告,FDA-Ag伤害类不良事件报告25例,占总报告数量的86.2%,故障类不良事件报告4例,占总报告数量的13.79%。CNKI-Ag均为伤害类不良事件报告。
2.3 FDA-Ag不良事件报告的制造商情况
CNKI-Ag中无纳米银类产品生产企业信息,因此统计FDA-Ag不良事件制造商(见表2),结果表明,Smith& Nephew,Inc的不良事件报告最多为19例,占报告数的65.52%,报告数量主要与产品的市场占有率及不良事件报告上报率等因素有关,不能直接体现生产企业对产品的质量控制和风险控制等情况。
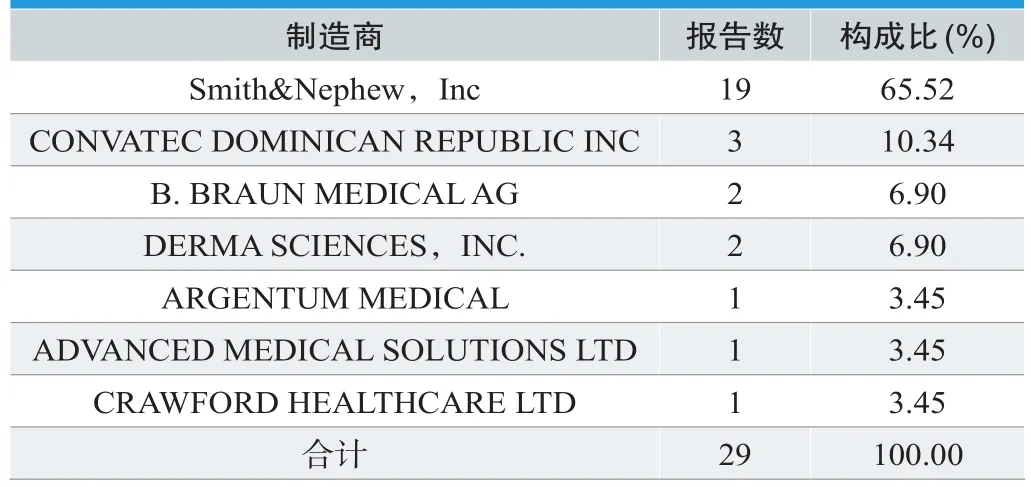
表2. 制造商分析统计
2.4 不良事件表现
FDA-Ag故障表现为包装破损、无内容物、包装异常、包装与产品粘连。伤害表现最多为过敏反应,分别为局部用械反应(10例)表现为局部红肿、皮疹、坏死等;全身过敏样反应(8例)表现为发热、水疱、呼吸困难等。除此之外还有伤口与器械粘连(2例)、浅表组织蜂窝炎(1例)、口腔异味(1例)、银过敏(1例)、银斑(1例)、血银升高(1例)。分析表明,全身过敏样反应不能排除烧伤合并用药以及患者自身情况的影响。
CNKI-Ag中有不良反应报道的6篇文献中包含了18例医疗器械不良事件,其中皮疹及创面感染7例,出现黑色素沉淀6例,金属银过敏2例,下腹坠胀1例,局部刺激症1例,腹痛1例,见表3。
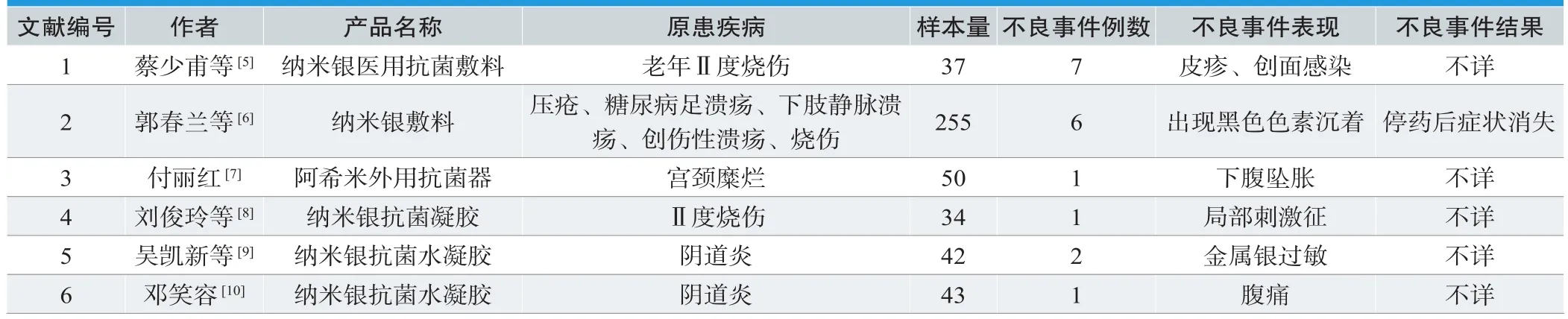
表3. 不良事件文献统计分析
3.讨论
本文数据收集范围较为局限,仅仅为FDA数据库和中国知网数据库,因此分析结果只针对该部分收集到的数据进行分析,并不能说明产品的整体水平,对生产企业分布情况的分析主要与产品的市场占有率及不良事件报告上报率等因素有关,不能直接体现生产企业对产品的质量控制和风险控制等情况。纳米银类产品不良事件表现可以从两方面来总结,首先是故障类表现,主要为包装破损、无内容物、包装异常、包装与产品粘连,其次为伤害类表现,主要有局部用械反应以及全身性的损害,其中局部用械反应主要表现为用械部位红肿、皮疹、坏死、创面感染、色素沉着等,而全身性损害主要为FDA-Ag表现,由于医疗器械不良事件报告有“可疑即报”原则,因此只要与医疗器械有关的报告就进行上报,这部分报告不能排除合并用药以及患者自身情况的影响。建议在临床使用过程中注意避免上述损害,并且在产品设计中着重考虑这两方面的风险,以提高产品品质,保障用械安全。

