抗结核药物靶点的结构研究进展
陈晓博,李俊†
①上海科技大学 免疫化学研究所,上海 201210;②上海科技大学 生命科学与技术学院,上海 201210
1 结核病
结核病(tuberculosis)是一种主要由结核分枝杆菌(Mycobacterium tuberculosis)引起的严重传染病。全球大约1/4人口感染结核分枝杆菌,其中大部分处于潜伏期,约1/10感染者最终发展成为结核病。据世界卫生组织报告[1],仅2019年,结核病新发病例约1 000万例,死亡病例约120万例。其致死率已经超过艾滋病,位列传染病的第一位。结核病是困扰人类数千年的传染病,被列为全球十大死因之一,同时也是单一传染病中的头号杀手。当前用于治疗结核病的药物大部分是20世纪40—70年代发现的,已经使用了半个多世纪。常见的抗结核治疗药物[2]如表1所示。结核病的治疗通常需要四种以上的一线药物联用,疗程在半年以上才能治愈。当一线药物疗效不明显时辅以二、三线药物。近年来,由于传统药物的长期使用和不规范治疗,临床上产生的耐药问题越来越严重。多药耐药(multi-drug resistance,MDR)[3]、广泛耐药(extensively drug-resistance,XDR)[4]和全耐药(total drug-resistance,TDR)[5]结核菌株的出现,使得现有药物和治疗方案难以奏效,甚至面临无药可医的危险境地。一旦这些耐药菌株广泛传播,后果不堪设想。因此,研发新型抗结核药物成为全人类迫在眉睫的任务。

表1 常见的抗结核治疗药物
2 结核分枝杆菌的细胞壁合成与能量代谢
结核病的防治和新药研发首先需要发现和阐明其致病菌关键生理活动的分子机制。其中,结核分枝杆菌的细胞壁合成过程和能量代谢过程被认为是理想突破口,许多抗结核药物和在研药物均作用于这些重要生理途径。比如,一线药物异烟肼(isoniazid)和乙胺丁醇(ethambutol)、临床在研药物SQ109均是通过抑制细胞壁合成发挥抗结核作用的,上市新药呗达喹啉(bedaquilin)和临床在研药物Q203则通过抑制能量代谢途径的呼吸链达到杀死结核菌的效果。
结核杆菌的细胞壁具有独特的结构和组成,是病原体抵抗环境压力,免受抗生素杀伤和逃避宿主免疫反应的天然屏障[6]。其结构和组成与革兰氏阳性/阴性细菌以及真菌都存在显著差异[7-8],结核分枝杆菌细胞壁组分肽聚糖(peptidoglycan,PG)、阿拉伯半乳聚糖(arabinogalactan,AG)、分枝菌酸(mycolic acid,MA)、脂阿拉伯甘露聚糖(lipoarabinomannan,LAM)等均是结构复杂的分子,其合成、运输、组装、调控等需要一系列酶和转运膜蛋白参与完成[9]。破坏细胞壁的完整性不仅有助于杀菌药物的进入,还会严重地影响病原体的生存,故细胞壁合成通路中的关键蛋白被公认为是很好的药物靶标[10]。
在近年的研究中,针对结核分枝杆菌能量代谢系统,特别是氧化磷酸化途径的靶标研究已成为研究者关注的热点。虽然病原菌的有氧呼吸与真核生物类似,都依赖于一系列蛋白质复合体,包括复合物I(NADH:醌氧化还原酶)、复合物II(琥珀酸:醌氧化还原酶)、复合物III(醌:细胞色素c氧化还原酶)、复合物IV(细胞色素c氧化酶)和复合物V(ATP合成酶),但是其结构和组装形式与真核线粒体和革兰氏阳性/阴性细菌均存在显著差异,其独特的特点使相关复合物成为理想的药物靶点。
3 细胞壁分枝菌酸转运蛋白MmpL3的结构研究
MmpL3是一个负责转运细胞壁分枝菌酸前体的膜蛋白。当分枝菌酸在细胞内合成后被海藻糖修饰形成海藻糖单霉菌酸酯(trehalose monomycolate,TMM),MmpL3可以将TMM从胞内侧跨膜转运至周质腔。TMM进一步被加工运输后整合至细胞壁外膜(分枝菌酸层)[11]。MmpL3属于RND超家族[12-13],是结核杆菌生长的必需基因。同时,MmpL3也是当前研究的热门药物靶点之一。到目前为止,大约有8类不同分子构型的具有抗菌活性的MmpL3抑制剂被发现,其中乙二胺类的SQ109已处于2b-3期临床试验阶段。该小分子对耐药菌株有很好的杀菌效果,具有极低的耐药突变率,有望成为新的抗结核治疗药物[14]。
针对分枝杆菌MmpL3的结构研究显示[15],其晶体结构包括两部分:跨膜结构域(TMN和TMC)和细胞间质结构域(PN和PC)(图1a)。跨膜结构域主要由12个跨膜α螺旋组成。细胞间质结构域共包括7个α螺旋和6个β片层。MmpL3具有一个假二次对称轴,形成尺寸大约为93 Å×55 Å×25 Å的分子机器。PN和PC相互嵌合形成一个三端开口(GF、GB、GT)的空腔(cavity)。在每个开口的入口处都存在大量的亲水性氨基酸,而空腔的内部主要由疏水氨基酸组成。在跨膜螺旋TMH4和TMH10的中部,存在4个亲水的氨基酸Asp256、Tyr257、Asp645和Tyr646。它们之间通过形成氢键的方式组成“天冬氨酸-酪氨酸”残基对(Asp256-Tyr646和Asp645-Tyr257)(图1b),这两对亲水氨基酸对对跨膜螺旋TMH4和TMH10之间的稳定有重要的作用。在其他RND家族成员中,同样存在类似的亲水氨基酸。这些跨膜区的亲水氨基酸残基已被证明参与质子的内流,为底物转运过程提供能量,因此对蛋白的功能至关重要[16-18]。在细胞间质的空腔中,存在两个6-DDTre分子,它们与底物TMM分子具有一定的相似性,即都具有相同的海藻糖头部和疏水的烃链尾巴,区别在于6-DDTre仅含有一条12个碳的脂肪酸链尾巴。综合以上信息,可以推测出一个MmpL3转运TMM的可能的机制模型:MmpL3以某种方式把位于细胞膜的TMM从细胞膜上拽出,经GF的开口进入PN和PC形成的空腔中,再经GT开口释放,从而完成底物TMM的向外转运。转运的过程需要依靠质子内流产生的动力驱动,而位于跨膜区的“天冬氨酸-酪氨酸”残基对介导了质子内流这一过程。以上模型仍需进一步实验验证[15]。

图1 MmpL3结构与抗结核小分子作用方式:(a)MmpL3整体结构和结构域分布;(b)TMH4和TMH10存在亲水的“天冬氨酸-酪氨酸”残基对;(c)SQ109的结合方式;(d)SQ109、AU1235、ICA38和Rimonabant结合方式比较
MmpL3与小分子抑制剂的复合物结构进一步揭示了抗结核药物的精确作用机制[15]。MmpL3-SQ109复合物结构显示,SQ109分子呈蝌蚪样形状结合于MmpL3跨膜区中心。与apo结构相比,MmpL3的跨膜区TMN和TMC相互远离张开,在内部形成一个口袋,SQ109则结合于口袋之中。其相互作用由跨膜区4圈围绕的氨基酸参与,主要为疏水相互作用(图1c)。值得注意的是,“天冬氨酸-酪氨酸”残基对的相互作用被破坏,SQ109乙二胺骨架上的两个氮原子均与Asp645形成氢键。MmpL3-AU1235复合物和MmpL3-ICA38复合物结构显示,这两个抑制剂同样都结合于跨膜区中心的口袋中,而且通过结构的叠合发现,尽管小分子间的结构有所差异,它们在MmpL3中的结合位置和方式与SQ109十分相似(图1d)。利莫那班(Rimonabant)是作用于大麻素受体CB1的拮抗剂,曾用作治疗肥胖的减肥药[19]。研究发现,利莫那班也是一个靶向MmpL3的抗结核小分子。MmpL3-Rimonabant复合物结构显示,该小分子虽然也结合在MmpL3的跨膜区,但是由于分子骨架与SQ109截然不同,其结合方式与SQ109也存在显著差异(图1d)。总体上来说,Rimonabant占据了更多的口袋区域。进一步分析表明,4个抗结核小分子均作用于MmpL3的质子内流通道上,破坏了关键的“天冬氨酸-酪氨酸”残基对的相互作用,从而切断了MmpL3转运底物的能量来源,最终阻断了细胞壁分枝菌酸层的合成,达到抑制结核杆菌的功效[15]。MmpL3的结构信息及其靶向分子的精确作用方式可以为新型抗结核药物的设计提供重要思路。
4 细胞壁阿拉伯糖基转移酶EmbAEmbB和EmbC-EmbC的结构研究
EmbA、EmbB和EmbC均是参与细胞壁阿拉伯聚糖合成的阿拉伯糖基转移酶(arabinosyltransferase),属于糖基转移酶超家族GT-C中的GT-53家族。其中,EmbA和EmbB参与阿拉伯半乳聚糖AG的合成[20],而EmbC参与脂阿拉伯甘露聚糖LAM的合成[21]。三者之间具有大约40%的序列同源性和相似的拓扑结构。Emb蛋白均是利用DPA(decaprenyl-phosphate-arabinose)作为阿拉伯糖供体,将阿拉伯单糖转移至特定的阿拉伯聚糖受体上,完成阿拉伯聚糖的延伸或者分枝。研究表明,结核杆菌中的Emb蛋白均是无法敲除的关键蛋白[22]。另外,一线药物乙胺丁醇的临床耐药突变大多发生在Emb蛋白上,尤其集中在EmbB蛋白[23-26]。Emb蛋白的活性测试表明,乙胺丁醇可以抑制其活性,因而是这些蛋白的直接作用靶点[27]。
结构研究表明[27],EmbA和EmbB形成异源二聚体,EmbC形成同源二聚体(图2a)。两者的二聚化形式相似,均是通过跨膜区的相互作用稳定二聚体结构。在每个Emb蛋白的胞内侧均结合了一个酰基载脂蛋白AcpM。Emb蛋白具有相似的结构,均含有一个15次跨膜结构域,一个N端胞外结构域(PN)和一个C端胞外结构域(PC)(图2b)。PN结构域采用Jelly-roll的折叠形式,这种形式一般与多糖的结合有关[28]。PC结构域进一步分为两个亚结构域,其中一个也是采用Jellyroll的折叠形式。Emb蛋白的活性口袋位于跨膜区和胞外区的连接处,有两个开口可以进入,分别是供体通道和受体通道(图2c)。口袋内部存在高度保守的DDx基序,基序上的天冬氨酸残基负责催化反应。在解析的EmbA-EmbB和EmbCEmbC复合物结构中,底物DPA和阿拉伯二糖分子均结合于活性口袋中。在EmbA的结构中,DPA中的阿拉伯糖基团从供体通道伸入活性口袋,结合于催化残基一侧,癸烯基尾巴则结合于口袋外部的跨膜区。在EmbB和EmbC结构中,阿拉伯二糖分子的两个阿拉伯糖基团分别结合于催化残基的两侧,因此,阿拉伯二糖分子被认为是模拟了反应产物的结合方式,其中一个阿拉伯基代表原受体末端的糖基,而另一个则代表被转移后新生成的糖基。底物的结合信息最终帮助推导出了Emb蛋白的反应机制[27]。
在EmbB和EmbC的结构中,均发现了乙胺丁醇的存在[27]。该药物分子均结合于EmbB和EmbC的活性口袋中。乙胺丁醇分子中的二胺基团位于催化残基附近(图2d),在结合过程中发挥了重要作用。其他基团同时与活性口袋附近的氨基酸残基相互作用,包括极性相互作用和范德华作用等,进一步稳定了药物分子的结合。结构叠合分析显示,乙胺丁醇的结合位置几乎与阿拉伯二糖重合(图2e)。由此可以推出,乙胺丁醇竞争性地阻碍了阿拉伯糖供体和受体的结合,从而抑制Emb蛋白的糖基转移功能,进一步阻断了细胞壁的合成,抑制了结核杆菌的生长。将关于Emb蛋白的临床耐药突变数据展示在Emb蛋白的结构中可以发现,大部分突变位点集中于活性口袋附近,这一结果与乙胺丁醇的结合位点一致。结构信息进一步对部分位点的突变提供了合理的解释,如Met306、Gly406、Gln497等[24-26,29],从而在分子水平上阐明了乙胺丁醇耐药性的成因[27]。
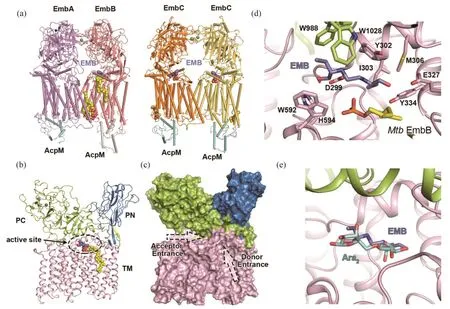
图2 EmbA-EmbB复合物与EmbC-EmbC复合物结构及乙胺丁醇作用方式: (a)EmbA-EmbB异源二体结构和EmbC-EmbC同源二体结构,AcpM结合于每个Emb蛋白的胞内侧;(b)单个Emb蛋白的整体结构和结构域分布;(c)通向活性位点的供体通道和受体通道;(d)乙胺丁醇的结合位点;(e)乙胺丁醇结合位置与阿拉伯二糖重合
5 能量代谢呼吸链超级复合体CIII2CIV2SOD2的结构研究
分枝杆菌的呼吸链同样需要复合物I、II、III、IV、V参与,但是其组成和组装形式与真核生物或其他原核生物存在差异。比如,分枝杆菌中不存在游离的细胞色素c[30]。在真核生物中,细胞色素c介导了复合物III和复合物IV之间的电子传递。在细菌中,有些细胞色素c是以锚定在细胞膜的形式来连接III-IV间的电子传递的,而另一些则是将细胞色素c以结构域的形式融合到复合物IV上。分枝杆菌等放线菌将细胞色素c结构域融合于复合物III上,并且与复合物IV组装在一起形成超级复合体[31-32]。研究表明,结核分枝杆菌呼吸链复合体III是一个具有重要临床意义的药物靶点,它能够与目前处在临床II期的药物分子Telacebec(Q203)[33]相互作用进而抑制其电子传递功能,阻断有氧呼吸途径。
分枝杆菌的呼吸链超级复合体III-IV的精细三维结构通过冷冻电镜单颗粒重构法得到解析[34]。结合质谱、光谱、磁共振等方法对天然提取的超级复合体样品进行分析鉴定,共发现24个蛋白亚基、44个脂质分子、24个电子传递配体分子,总分子量达870 kDa。复合体中,两个III形成二体,两个IV分别结合于两侧,形成IV-III-III-IV的线性排列,具有二次轴对称性。III-IV的结合界面通过组装因子PRSAF1、LpqE和SOD连接稳固。另外,许多磷脂分子分布于III-III、III-IV的界面上,进一步稳定了整个复合体(图3a)。研究人员在结构中首次发现了超氧化物岐化酶SOD二体的存在,其通过脂修饰的N末端锚定在复合物III二体的胞外侧。已知SOD的功能为清除氧自由基,因此可以推测,SOD的存在是为了尽快清除复合物III-IV电子传递过程中发生电子泄漏而产生的自由基。在复合物III中,血红素heme bH、heme bL、铁硫簇[2Fe-2S]、血红素heme cD1、heme cD2的位置可以被确定;在复合物IV中,CuA、CuB、血红素heme a/a3的位置也得到确定。这些可以发生氧化还原的配体以一定距离串联分布于超级复合体之中(图3b),可以允许电子通过量子遂穿效应进行传递,从低电势流向高电势。因此,复合体的结构信息可以帮助揭示电子如何进行传递,从复合物III醌结合位点QP最终流向复合物IV的heme a3:CuB反应中心,与氧气反应生成水。电子传递的同时,质子从胞内侧被转运至周质腔中形成跨膜电势差[34]。
进一步的结构分析发现[34],电子供体甲基萘醌(menaquinol,MK)结合于QP和QN口袋中(图3c和3d)。由于复合物III的醌结合口袋QP和QN的氨基酸组成与真核线粒体的复合物III存在显著不同,该位点被认为是抑制剂设计的理想位点。事实上,QP口袋中的313位Thr氨基酸的突变可以引起Q203的耐药[33],因而Q203很可能是靶向QP位点的。进一步药物作用机制的阐明需要复合物与Q203的结构解析才能实现。当前的超级复合物结构为我们提供了电子传递分子机器的丰富信息,在揭示其功能机制的同时,也使得我们有可能通过靶向呼吸链电子传递过程找到抗结核的有效手段。

图3 呼吸链复合物CIII2CIV2SOD2结构:(a)CIII2CIV2SOD2结构组装形式和组成成分;(b)复合物中的氧化还原配体及空间分布;(c)底物醌在QP位点的结合方式;(d)底物醌在QN位点的结合方式
6 总结与展望
近年来,随着科学技术的进步和研究水平的提高,结核杆菌膜蛋白及其复合物样品的获取和结构研究成为可能,最终促成了多个长期以来从未被攻克的膜蛋白类的抗结核药靶结构的解析。这一系列工作帮助我们清晰地观察到关键蛋白质的精细三维构造,从而在分子水平上对其生理功能进行了精确的阐释。更为重要的是,多个药物和候选化合物的靶向作用机制得到了详细的阐明,相关的结合位点及其结合方式为新型抗结核小分子的开发提供了非常有价值的信息。相信不久的将来,对于这些靶点的新药开发一定会取得重要突破。随着抗结核药靶研究的深入,会有更多重要靶点的结构被解析,从而加快整个抗结核药物研发的进程。

