基于二硫键桥连构建均一性抗体药物偶联物
黄容,陈红莉,姜标†
①上海科技大学 免疫化学研究所,上海 201210;②上海科技大学 物质科学与技术学院,上海 201210
1 抗体药物偶联物
抗体药物偶联物(antibody-drug conjugates,ADCs)是生物制药领域中发展最为迅速的一类生物大分子药物,由肿瘤抗原特异性单抗、有效的细胞毒性分子(有效载荷)以及结合它们的连接子三个部分组成(图1)[1-2]。ADCs的诞生是基于一种理想的前药设计理念,希望将药物分子和抗体二者的优点结合起来,利用抗体的特异专一性,有效输送高活性药物分子到特定靶标,到达目标细胞时再将药物分子释放出来,限制与非目标细胞的作用,从而降低毒性,实现药效。近年来随着抗体技术、小分子毒素及偶联技术的进步和突破,全球掀起了研发ADCs药物的热潮,美国FDA已先后批准了10款ADCs药物上市(Mylotarg、Adcetris、Kadcyla、Besponsa、Padcev、Polivy、Enhertu、Trodelvy、Blenrep和Zynlonta)(图2),目前还有80多个ADCs药物处于临床研究阶段[3-8]。

图1 ADC药物的结构
2 抗体药物偶联物的偶联方法
目前上市的ADCs都是通过对抗体氨基酸残基直接进行化学修饰偶联上细胞毒素而获得的,主要分为两类:一类是使用N-羟基琥珀酰亚胺(NHS)酯的活化羧基与抗体的赖氨酸残基进行偶联,上市药物Mylotarg、Kadcyla和Besponsa就是通过该方法制备得到的(图2);另一类是通过使用巯基特异性试剂(如马来酰亚胺)与半胱氨酸反应来合成的,上市药Adcetris、Padcev、Polivy、Enhertu、Trodelvy、Blenrep和Zynlonta都是通过这种偶联方法合成的(图2)。基于赖氨酸偶联所得的ADCs,通过肽图已确定偶联发生在重链和轻链上约40个不同的赖氨酸残基上,从而可以产生超过100万个不同的异构体。因此该方法制得的ADCs均一性差。而基于抗体半胱氨酸的偶联,复杂程度相较而言有所降低。抗体本身并不含有半胱氨酸残基,但它含有4对易于接近的链间硫-硫键,还原后可得到8个巯基。因此,当8个巯基全部偶联上药物分子时,所得ADCs均一性较好。而当药物-抗体比例(drug-antibody ratio,DAR)控制在4左右或更低时,仍旧为多个不同修饰位点的混合物。不同载药量、不同连接位置的混合物将会极大地影响药物的质量控制、药代性质和治疗窗口[9]。因此,通过定位偶联(确定的反应位点和偶联数目)获得均一性产物,在新一代ADCs的发展中尤为重要[10-12]。
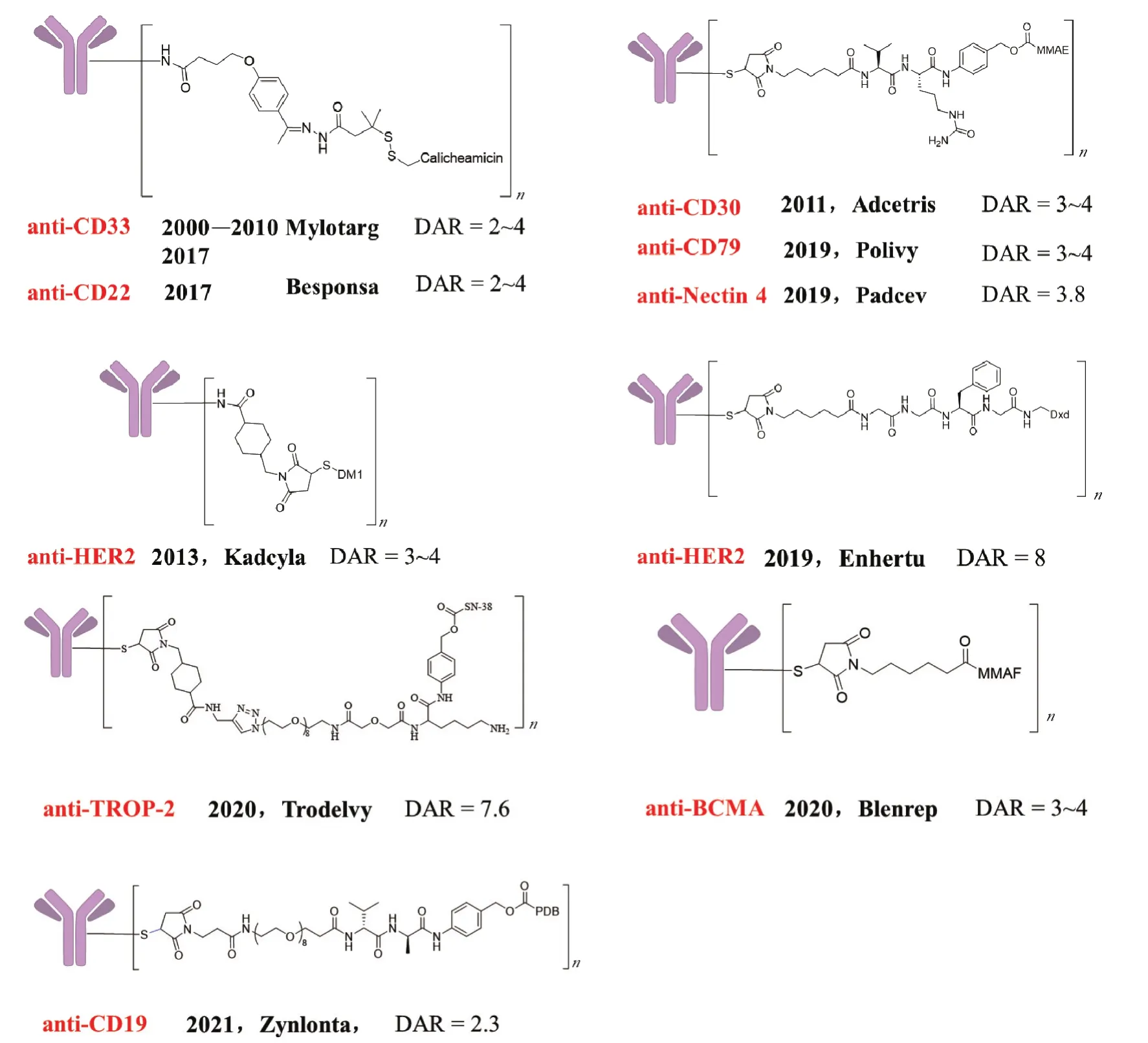
图2 FDA批准上市的ADCs药物
近年来,随着科学家们的不断努力,多种偶联技术被报道用于定位合成ADCs,以获得DAR值均一性好、药代动力学和安全性更佳的ADCs。随着生物正交化学和蛋白质工程领域的发展,科学家们已经开发了多种用于定点修饰抗体的方法,包括定点突变半胱氨酸残基用于偶联的THIOMAB技术[13]、引入非天然氨基酸的ncAAs技术[14-15]、引入硒半胱氨酸的selenomabs技术[16-18]、通过亲和肽或小分子诱导的抗体选择性修饰的AJICAP技术[19-21]等等。基于酶催化的抗体选择性修饰也是一种常用的得到均一性ADCs的手段,如transglutaminases(mTG)介导的偶联技术[22-23]、sortase介导的抗体结合(SMAC)技术[24-25]、遗传编码一段肽标签用于进一步的酶促修饰的SMARTag技术等等[26-28]。另外,基于抗体糖基化的选择性修饰也陆续被报道[29-30]。
3 二硫键桥连技术
相较而言,基于天然抗体的化学偶联方法在成本和方便性方面更具竞争力。近几年,利用抗体中的4对链间硫-硫键,先还原再桥连而发展的“ThioBridge”技术逐渐显示其优越性,包括:可以实现直接对天然抗体定位修饰、抗体适用性广、DAR值可控、所得ADCs均一性高等[31-32]。该方法首先对抗体中的4对链间二硫键,用还原性化合物如三(2-羧乙基)膦 (TCEP) 进行还原,然后利用与半胱氨酸选择性反应的试剂对抗体二硫键进行重新桥连的同时引入细胞毒性药物。该方法不仅能够保持原有二硫键的稳定作用,并且可以控制每对二硫键只偶联一个连接分子,从而实现定位偶联。目前,研究较多的二硫键桥连试剂主要有双砜(bissulfones)化合物、新一代马来酰亚胺(NGMs)化合物和哒嗪二酮(PDs)类化合物等。近年来也涌现出许多其他的化合物,包括使用芳炔二丙腈(ADPN)、二乙烯基嘧啶(DVP)、二溴甲基杂环(C-Lock)、二氯丙酮或铂(II)配合物、N-苯基双乙烯基磺酰胺化合物和双(乙烯基磺酰基)哌嗪(BVP)化合物等,用于抗体中二硫键的重新桥连。
3.1 双砜化合物
1990年Bioconjugate Chemistry首次报道了将双砜化合物用于蛋白质中二硫键的重新桥连,随后随着ADCs研究的兴起与发展,该方法进一步应用到ADCs的合成中[33-34]。从反应机理来说,反应是先通过原位消除一个磺酰基生成一个α,β-不饱和羰基,进而与半胱氨酸残基发生迈克尔(Michael)加成反应生成硫醚键。重复这个消除-加成过程使两个半胱氨酸残基通过一个三碳桥进行共价桥连。2014年,Badescu等人[35]首次将这一策略应用于ADCs的合成,他们报道了将一种双砜试剂通过PEG24的链和一个可裂解的Val-Cit-PABC结构连接到MMAE上,用于曲妥珠单抗二硫键的重新桥连(图3)。用疏水作用色谱法(HIC)分析所得的ADCs,结果发现约有78%的产物就是预期的DAR值为4的偶联物。其余的组分由于连接子反应不足或反应过度,得到了10%的DAR值为3的偶联物和11%的DAR值为5的偶联物。ADCs在人血清白蛋白(HSA)的存在下,5天内表现出极高的稳定性,且在小鼠异种移植肿瘤模型中,以20 mg/kg的剂量给药5次后,ADCs展现出比曲妥珠单抗更好的抗肿瘤活性。在Bryant等人[36]的后续研究中,对类似的抗HER2的曲妥珠单抗偶联物(该ADCs含有较短的PEG6链)进行了药效评估,并与已上市的HER2靶向ADC药物T-DM1进行对比。在JIMT-1小鼠异种移植肿瘤模型中,两个ADCs在5 mg/kg的剂量时展现了相似的活性,但是在10 mg/kg的剂量时双砜桥连的ADC明显比T-DM1更有效。
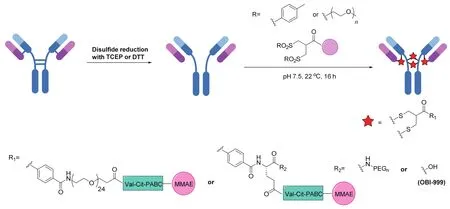
图3 使用双砜化合物重新桥连抗体的链间二硫键产生均一的ADCs
有假设认为可裂解的Val-Cit二肽结构在血液循环中的提前降解会降低双砜桥连的ADC的疗效。众所周知,连接子结构(包括聚乙二醇片段)和偶联位点会影响Val-Cit结构在小鼠血浆中的稳定性[37-38]。因此,Pabst等人[39]研究了PEG链对含有Val-Cit-PABC可裂解机制的双砜偶联ADCs的药效和稳定性的影响,发现在小鼠体内,带有PEG支链或没有PEG链的双砜桥连ADCs明显比带有线性PEG链的双砜桥连ADCs更稳定。此外,与已上市的抗CD30的ADC Adcetris相比,带有支链的ADC具有更好的稳定性,且在CD30阳性的小鼠异种移植肿瘤模型中单剂量(1 mg/kg)治疗后肿瘤完全消退,体内疗效很好(图3)。
Abzena公司向多家制药公司授权其双砜连接剂技术,商标名ThioBridge。多个使用此技术的药物已经处在临床前和临床试验的研究中。例如,OBI-999是由OBI制药公司开发的ADC,是将MMAE有效载荷通过双砜连接剂偶联至人源抗Globo H抗体上而合成的(图3)[40]。基于其临床前数据,FDA授予该ADC治疗胃癌和胰腺癌的孤儿药资格。OBI目前正在招募局部晚期或转移性实体肿瘤患者,包括胃癌、胰腺癌、食道癌和结直肠癌,进行I/II期临床研究。另一个基于双砜连接剂的ADC——HTI-1511,是由Halozyme公司开发,由靶向EGFR的抗体与有效负载MMAE偶联而得。该ADC在患者来源的小鼠异种移植肿瘤模型中显示出有效的肿瘤生长抑制或退化,包括KRAS/BRAF突变的模型,该突变通常与EGFR靶向治疗的耐药性和不良预后有关[40]。此外,HTI-1511已被证明在灵长类动物模型中具有良好的耐受性。
Pabst等人[39]最近发表了使用双砜试剂重新桥连二硫键的详细步骤,将有助于该试剂更广泛地应用。通用的反应条件是非常温和的,将还原的抗体与5~6当量的双砜试剂在pH为7.5的缓冲液中在22 ℃下共同孵育16 h。约有75%~85%的抗体反应形成DAR值为4的偶联物,通过HIC进一步纯化后,可得到完全均一的DAR值为4的ADCs。OBI-999的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)数据表明,ADC是两种异构体的混合物,一种是所有的链间二硫键以原本的配对方式全部重新桥连的偶联物,而另一种是“半抗体”偶联物,即抗体重链铰链区半胱氨酸之间形成了非原生的链内二硫键桥连,而失去了原有的抗体重链之间的共价连接。目前尚不清楚这种异质性是否会影响ADC的性能。
3.2 新一代马来酰亚胺(next-generation maleimides,NGMs)化合物
新一代马来酰亚胺(NGMs)是一类用两个卤化物或硫代苯酚离去基团修饰的马来酰亚胺试剂。将这种NGMs试剂用于二硫键重新桥连最早是由Smith等人[41]在2010年提出的,当时他们发现这些试剂可以通过连续的加成-消除反应有效地实现二硫键的重新桥连,在两个半胱氨酸残基之间插入一个双碳桥。2014年,Schumacher等人[42]首次将这种方法应用在制备ADCs中。有报道称,将还原的曲妥珠单抗与5当量的二溴马来酰亚胺(dibromomaleimide,DBM)或二硫代苯酚马来酰亚胺(dithiophenylmaleimide,DSPh)共孵育,在1 h之内就可以将还原的二硫键全部重新桥连。这说明与传统的马来酰亚胺偶联一样,该反应具有很快的反应动力学。研究者指出,所产生的偶联物是不均一的,同时存在天然重新桥连的“全抗体”偶联物和非天然重新桥连的“半抗体”偶联物。研究发现可以通过同时添加还原剂和连接剂,减少半抗体的形成,这表明减少还原半胱氨酸残基的停留时间可以降低它们的错配概率。该改进策略已被用于曲妥珠单抗与含有炔基支架的二硫代苯酚马来酰亚胺试剂的偶联反应中,随后通过点击化学反应连接上细胞毒素阿霉素分子,得到具有较好均一性的DAR值为4的ADCs(图4)。
和传统的马来酰亚胺一样,NGMs在有游离硫醇存在时是不稳定的,除非将其水解成马来酸的形式[43]。Nunes等人[44]证明,含有NGMs的抗体偶联物在pH为8.4的缓冲液中72 h后会完全水解,且得到的水解偶联物在人血浆中7天内仍完全稳定。该水解策略被用于合成DAR值为4的ADC,将曲妥珠单抗与含有不可裂解的PEG12链和MMAE有效荷载的二硫代苯酚马来酰亚胺连接子偶联(图4)。该ADC的体内活性比未经修饰的曲妥珠单抗更好,以20 mg/kg的剂量给药三次可使小鼠的肿瘤完全消退[45]。

图4 使用新一代马来酰亚胺化合物重新桥连抗体的链间二硫键产生均一的ADCs
在此基础上,研究人员比较了使用NGM构建的ADC和通过马来酰亚胺修饰半胱氨酸残基得到的平均DAR值为4的不均一的ADCs的体内稳定性和有效性[46]。使用一种不可裂解的二溴马来酰亚胺连接子将MMAF与曲妥珠单抗或抗CD98的抗体IGNX偶联,得到均一的DAR值为4的ADCs。在这两个实例中,与它们对应的不均一的ADCs相比,NGM构建的ADCs在小鼠体内的循环半衰期显著增加而且可使肿瘤持续消退。尽管这些结果是有前景的,但NGMs试剂的主要缺点是其需要72 h的水解来保证稳定性。Morais等人[47]研究发现可通过增加马来酰亚胺结构周围的电子缺失和空间体积来加速水解过程。具体来说,在马来酰亚胺环相邻位置引入甘氨酸衍生结构可将水解时间从72 h减少到1 h(图4)。
虽然大多数报道的NGMs构建的ADCs使用的是不可裂解的连接子,但是,也有报道它们与组织蛋白酶可裂解连接子的联合使用。Bryden等人[48]发现可以将Val-Ala和Val-Cit二肽结构引入到NGMs连接子中,但是Val-Ala结构的疏水性会显著降低反应性,而使用Val-Cit-NGM连接子大约也只有50%的抗体能够转化成预期的DAR值为4的ADC。后来通过引入PEG链来解决疏水性的问题,可以分别得到具有这两个二肽结构的ADCs。近年来,科学家们还研究了不同取代模式对NGMs稳定性和均一性的影响。例如,Forte等人[49]报道二碘马来酰亚胺化合物比二溴马来酰亚胺化合物稳定。此外,Feuillatre等人[50]报道和二溴马来酰亚胺和二硫代苯酚马来酰亚胺试剂相比,使用杂化硫溴马来酰亚胺(TBMs)试剂可以得到具有更狭窄的DAR分布的更均一的ADCs。NGMs已被多次证明能够产生具有高度均一性的ADCs。环水解的优化显著提高了这种方法的应用性,可合成具有较高血浆稳定性的ADCs。NGMs连接子除了与MMAE和阿霉素等多种传统有效载荷兼容外,最近研究证明它可以与PROTAC有效载荷偶联生成新一代的ADCs,展示了其广泛的适用性[51]。
3.3 哒嗪二酮(pyridazinediones,PDs)类化合物
Chudasama等人[52]最初将哒嗪二酮(PDs)类化合物作为一种巯基可裂解的连接子用于多肽偶联和前药开发。与NGMs类似,PDs具有两个离去基团,通过连续的加成-消除反应与半胱氨酸残基发生反应,在两个残基之间插入一个双碳桥。虽然形成的连接可以被其他的游离硫基切断,但通常需要较高浓度的硫基,且许多研究已经证明了PD衍生偶联物在人血浆中具有很好的稳定性。2017年,Robinson等人[45]使用PD连接子将含有组织蛋白酶可裂解或不可裂解的MMAE有效载荷偶联到抗HER2的抗体上,合成了DAR值为4的ADCs。质谱和HIC分析显示,其中90%的偶联物的DAR值为4,仅有3%的DAR值为3的偶联物和7%的DAR值为5的偶联物。这两种ADCs对抗原阳性细胞系都有很强的杀伤力,可裂解ADC的活性比不可裂解ADC强100倍。两种ADCs在小鼠模型中均有效且耐受性良好。
因为PD试剂环上的两个氮都可作为正交反应的支架,所以可将其用于生成双功能偶联物。2015年,Maruani等人[53]利用这一特性,用一个含有末端炔烃和一个张力炔烃的二溴哒嗪二酮连接子修饰曲妥珠单抗。随后通过正交CuAAC或SPAAC反应与阿霉素有效载荷和荧光分子进行偶联,产生了含有四个细胞毒性有效载荷和四个荧光分子的DAR值为4的ADCs(图5)。尽管经过双重修饰,但ADC仍保持对靶标抗原的高亲和力,并在体外对抗原阳性细胞株仍具有高度选择性。使用PD试剂在抗体上添加第二个功能性部分的特性也被用来增强所连有效载荷的亲水性[54]。通过PD试剂将DM1有效载荷和PEG6或PEG26链与还原的曲妥珠单抗反应,可产生较为均一的DAR值为4的ADCs(图5)。两种ADCs在体内均显示出与T-DM1类似的活性,并在小鼠异种移植模型中,以10 mg/kg剂量给药2次后,可使肿瘤完全消退。

图5 使用哒嗪二酮类化合物重新桥连抗体的链间二硫键产生均一的ADCs
虽然常规的PD连接子与每个二硫键反应可生成DAR值为4的ADCs,但Lee等人[55]利用PD连接子支架的第二个功能化载体连接两个试剂,从而创建一个化合物可以与四个半胱氨酸残基反应的连接子。这种方式适用于连接一个单一的炔烃支架,合成带有两个有效载荷的抗体药物偶联物。这个概念已被成功用于合成均一的DAR值为2的阿霉素ADCs。在另一个研究中,将树突状结构引入至二溴哒嗪二酮试剂中,将4个基于卟啉的光敏剂载荷附着在每个PD树突状分子上,可以合成DAR值为16的均一的曲妥珠单抗-ADC[56]。该ADC在抗原阳性细胞系中,在光照下表现出良好的细胞活性,而在黑暗中无任何活性,从而证明了PD连接子与光敏剂载荷的相容性。PD连接剂的进一步功能化偶联主要通过CuAAC或SPAAC反应来实现,但是也可以使用其他类型的点击化学。例如,Marquard等人[57]最近报道合成了一种含有反式环辛烯(TCO)功能化支架的二溴哒嗪二酮试剂。这种PD-TCO试剂可成功地与三个IgG1抗体(曲妥珠单抗、西妥昔单抗和利妥昔单抗)偶联,并进一步与含四嗪的荧光分子反应。所得的三个荧光偶联物均一性好,偶联效率高。值得注意的是,即使是利妥昔单抗,已知通过传统的NHS酯化学方法修饰后蛋白大约损失90%,而经PD-TCO修饰后有83%的偶联产率。这表明,对容易聚集的抗体进行偶联时,二硫键重新桥连比随机赖氨酸修饰具有更明显的优势。
就反应动力学和产物均一性而言,PDs和NGMs一样,都是最好的二硫键重新桥连试剂之一。此外,PDs试剂的“plug-and-play”特性允许其通过生物正交化学实现多种不同载荷的灵活功能化,这对合成双功能的ADCs来说是很有吸引力的。
3.4 其他二硫键桥连试剂
基于双砜、NGMs和PDs化合物的大量工作清楚地证明了使用二硫键重新桥连策略生成均一ADCs的可行性和实用性。近年来,化学家们开发了各种各样新的二硫键桥连试剂。C-Lock是由Concortis Biotherapeutics公司开发的专利技术,使用二溴甲基杂环类化合物,如二溴甲基喹喔啉作为二硫键重新桥连的试剂(图6A)。2013年,Sorrento Therapeutics公司使用C-Lock技术开发了抗体药物偶联物STI-6129,由一个duostatin有效载荷和一个靶向CD38的抗体偶联而成,用于治疗血液系统恶性肿瘤。STI-6129在临床前研究中表现出良好的活性,最近已进入I期临床试验,用于治疗复发或难治性系统性AL淀粉样变性。Zova Biotherapeutics公司也应用C-Lock技术开发了一款ADC药物ZV0508,由二溴甲基喹喔啉连接子将duostatin有效载荷与靶向5T4癌胎糖蛋白的抗体偶联而成[58]。HIC分析显示,在仅与5摩尔当量的连接子孵育后,约有90%的抗体转化为DAR值为4的ADC。但是,与用其他二硫键重新桥连技术开发的ADCs一样,经CE-SDS分析发现使用C-Lock技术开发的ADC也是全抗体和半抗体组成的混合物。然而,在临床前的体内研究中,与使用马来酰亚胺偶联产生的类似ADC相比,ZV0508表现出更加出色的耐受性和有效性。
同时,诺华公司报道了将1,3-二卤代丙酮试剂如1,3-二氯丙酮或1,3-二溴丙酮用于抗体的二硫键重新桥连。在所得的偶联物中,每一对半胱氨酸通过一个含有活性酮的三碳链连接。这种酮可以进一步与含羟胺修饰的有效载荷反应形成肟连接(图6B)。在一个应用中,这种方法被用于构建DAR值为3.8的抗HER2的ADC。在另一个应用中,引入的酮与含有两个羟胺基团的连接子-有效载荷反应连接,从而构建了含有MMAF的DAR值为1.8的抗HER2的ADC。质谱和SDSPAGE分析显示这两种ADCs高度均一,约90%的抗体转化为目标偶联物,且形成了较少的半抗体。
Invictus Oncology公司则开发了一种铂(II)试剂用于二硫键的重新桥连(图6C)[59]。先将拓扑异构酶抑制剂喜树碱连接到一种二价胺配体上,该配体随后与氯化铂(II)络合,从而得到了一种基于铂(II)的连接子-有效载荷偶联物。该连接子-有效载荷偶联物可与还原的曲妥珠单抗、利妥昔单抗或西妥昔单抗反应,得到DAR值为8的ADCs。与类似的马来酰亚胺偶联物相比,这些ADCs表现出更高的稳定性和均一性,但是也观察到大量半抗体的生成。随后验证了西妥昔单抗-ADC体内外的生物活性,结果发现,ADCs的活性仅略高于未修饰的西妥昔单抗,这可能是选择了不合适的有效载荷或释放机制导致的,而不是连接子的问题。
Koniev等人[60]在2018年开发了一种芳炔二丙腈(ADPN)试剂可用于二硫键的重新桥连并将其应用于ADCs中(图6D)。这项工作的灵感来自先前的研究发现——单芳炔丙腈键可与半胱氨酸残基形成非常稳定的键合[61]。为了将其转化为一种二硫键重新桥连的策略,对ADPN的三种区域异构体进行了比较。研究发现,间位ADPNs比邻位或对位ADPNs有更高的转化率,但得到的偶联物也是全抗体和半抗体的混合物。间位ADPN连接子随后被用于构建含有MMAE和β-半乳糖苷酶可裂解连接子的曲妥珠单抗-ADCs中。质谱分析显示约50%的抗体转化为理想的DAR值为4的偶联物,同时存在大量的DAR值为3和DAR值为5的偶联物。在体外药效评估中,ADC显示出与T-DM1相当的细胞毒性。

图6 其他用于抗体二硫键重新桥连的方法:(A)二溴甲基喹喔啉;(B)1,3-二氯丙酮;(C)铂(II)试剂;(D)芳炔二丙腈;(E)二乙烯基嘧啶
2019年,Walsh等人[62]报道了将二乙烯基嘧啶(DVP)试剂作为新型二硫键重新桥连试剂用于构建ADCs。与间位ADPNs类似,DVPs可以通过两个连续的迈克尔加成反应进行二硫键的重新桥连,在两个半胱氨酸残基之间插入一个灵活的七碳桥(图6E)。这种方法被用于合成了几个DAR值为4的曲妥珠单抗靶向的ADCs,这些ADCs由组织蛋白酶可裂解连接子、硫酸酯酶可裂解连接子或不可裂解的连接子和MMAE、hemiasterlin或阿霉素等有效载荷构成[62-64]。在这些偶联物中,均观察到大约90%的抗体转化为理想的DAR值为4的偶联物,但也都是全抗体和半抗体的混合物。这些偶联物在人血浆中显示出很好的稳定性,在体外也展现出很强的细胞毒性和选择性。最近,双功能DVP连接子的开发进一步扩大了该方法的应用范围[65]。该连接子可在曲妥珠单抗上同时偶联上MMAE细胞毒性药物和荧光分子,实现抗体的双重功能化,且不对抗体或载荷的活性产生任何影响。二乙烯基三嗪试剂也被证明在使用接近化学计量的试剂时就可以有效地进行二硫键的重新桥连,构建负载为4的抗体偶联物[66]。
我们实验室也发展了两种试剂可用于多肽和蛋白质的二硫键重新桥连并将其应用于ADCs的制备中。一类是苯环类双乙烯基磺酰胺连接子(图7A)[67-68],乙烯基磺酰胺可与半胱氨酸发生迈克尔加成反应,在优化的条件下,可实现多肽二硫键的重新桥连。随后选用不同的连接方式在苯环上引入炔基活性支架,设计合成了三个不同的连接子(两个通过给电子基团引入,一个通过吸电子基团引入)。实验发现,苯环上包含给电子基团的N-苯基双乙烯基磺酰胺连接子可以重新桥连抗体的二硫键以构建均一的DAR值为4的ADCs。ADCs在体外展现了很好的抗原选择性细胞毒性,在体内也显示出显著的抗肿瘤活性,并且具有较好的耐受性。另一类是双(乙烯基磺酰基)哌嗪(BVP)连接子(图7B)[69],可以选择性地重新桥连抗体Fab区域的二硫键,并构建DAR值为2的ADCs且不出现二硫键的错配。这一试剂首次实现了利用桥连试剂对抗体Fab区域二硫键进行选择性的修饰,从而避免了半抗的形成。使用BVP连接子将MMAE与曲妥珠单抗偶联可获得有效的ADCs。偶联物保留了与原抗一样的受体亲和力和内在化效率。同时,研究还证明了ADCs在体外细胞毒性中的高活性和抗原选择性,并且发现它们与T-DM1相比在某种程度上具有更宽的治疗窗口。我们还开发了康普瑞汀(CA4)作为新型有效载荷(图7B)[70],基于BVP连接子的二硫键重新桥连,将CA4衍生的药物-连接子偶联物与靶向EGFR的抗体西妥昔单抗偶联,生成较为均一的抗体药物偶联物。所得的抗体药物偶联物均保持与原抗相当的亲和力和内吞作用,且展现出很好的体外活性,在EGFR阳性异种移植肿瘤模型中显示出显著的抗肿瘤活性。
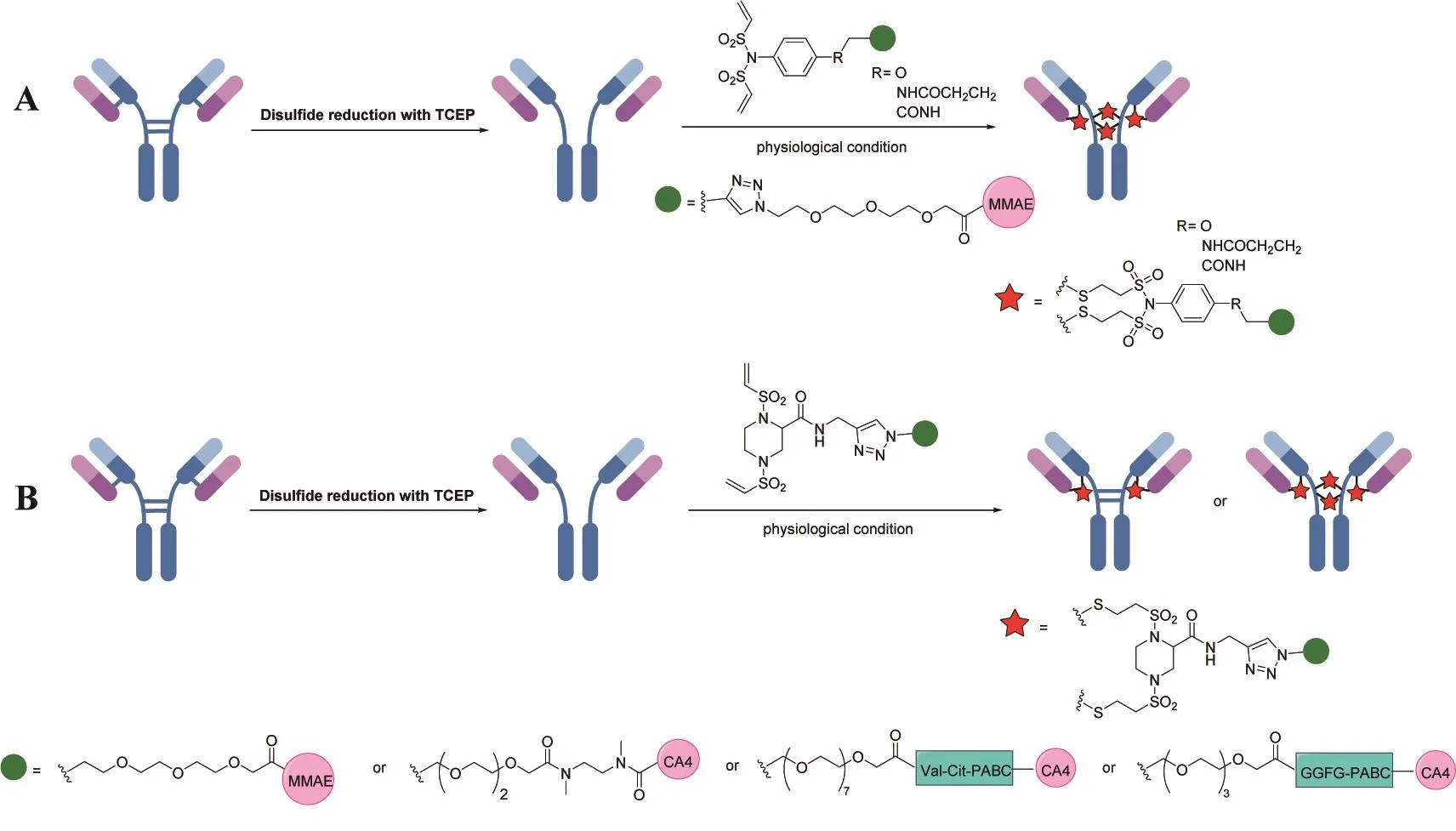
图7 苯环类双乙烯基环酰胺化合物(A)和双(乙烯基磺酰基)哌嗪(B)用于抗体二硫键重新桥连
4 总结和展望
抗体药物偶联物是近年来肿瘤靶向治疗研究领域内的热门方向。它汲取了传统抗癌化学小分子药物和生物抗体药物的优点,又最大程度上减弱了这两种单一药物的缺点,可以实现精准治疗。影响ADCs临床成功的因素有很多,包括抗体的选择、异质性和靶点抗原表达水平、有效载荷效力和作用机制、偶联策略以及可裂解和不可裂解连接子的选择等,因此开发疗效好、毒性低的ADCs仍面临较大的挑战。其中,连接子部分决定了ADCs中有效载荷的数量和位置,从而影响ADCs的药代动力学、药物释放速率、生物活性和治疗窗口,在ADCs设计中起着至关重要的作用。与现有的需要抗体改造的方法相比,基于天然抗体的化学位点特异性修饰有更快的可操作性和有效性。二硫键的重新桥连策略已被多次证明在构建均一性ADCs中有着显著的优势。目前诸多的二硫键桥连新方法尚未被用于临床研究中,所得的ADCs大多还处于临床前的研究中,研究者们正在努力将这些方法真正应用于临床研究中,使ADCs药物在肿瘤领域及其他领域进一步大放光彩。

