山药多糖的体外抗氧化活性
陈丽叶,常希光,冯晓光,杨肖飞,刘慧君,范俊峰,陈湘宁,
(1.北京农学院食品科学与工程学院,北京 102206;2.北京裕农优质农产品种植有限公司,北京 101400;3.北京林业大学生物科学与技术学院,北京 100083)
动脉粥样硬化是心血管疾病的主要成因,在老年人中发生的概率很大[1]。在早期阶段,天然低密度脂蛋白(low density lipoprotein,LDL)在动脉内皮内膜积聚并氧化,形成斑块[2-3]。因此,LDL是动脉粥样硬化性血管疾病的重要危险因素。此外,LDL糖化会形成糖化终产物,在人体内积累到一定程度时,会引发动脉粥样硬化[4-5]。LDL的氧化和糖化是相互依赖的,故可以通过抑制LDL氧化和糖化过程来预防动脉粥样硬化[6]。目前,临床上治疗动脉粥样硬化主要是通过降低血清LDL的水平。Allen等[7]研究发现,烟酸也是治疗动脉粥样硬化的广谱脂质调节药物。Su Gang等[8]研究证实烟酸可能会成为治疗动脉粥样硬化的新靶点,主要是通过实现核转录因子-κB(nuclear factor-κB,NF-κB)信号通路下调来改善动脉粥样硬化[9]。临床上广泛使用的抗氧化剂和二甲双胍有很多副作用。因此,需要更多的研究来发现天然的LDL氧化和糖化抑制剂,一些天然的化合物,如胆固酮、肌醇和乙基半胱氨酸,已经被报道有明显的抑制LDL的氧化或糖化的作用[10]。大量研究证明,从植物中提取的多糖具有免疫调节作用、降血糖、降血脂、抗疲劳、抗衰老等多种功效[11-12]。刘贝女等[13]从悬钩子木中提取了活性物质多糖并进行了柱色谱纯化,研究发现3 种不同成分的多糖均可以促进淋巴细胞的增值和分泌白细胞介素(interleukin,IL)、γ-干扰素和肿瘤坏死因子-α。Kostalova等[14]研究发现南瓜果实中提取的水溶性多糖具有抗氧化性。山药因其风味独特且富含多糖等多种生物活性而备受消费者青睐。山药多糖是山药的主要活性成分之一,广泛应用于药品、食品以及保健品中[15]。山药粗多糖可增强果蝇飞翔能力,其浓度与果蝇飞翔率呈正相关。较低质量分数(0.1%、0.5%)的山药粗多糖可缩短果蝇潜伏期时间;较高质量分数(1.0%、1.5%)的山药粗多糖可延长交配时间,而且随着山药粗多糖质量分数的增加,果蝇子代数增加,认为适量的山药粗多糖能使果蝇受精卵生存力提高,使更多的受精卵发育为成虫[16]。山药多糖可降低白脂肪组织中IL-1β、IL-10、瘦素水平,降低基质金属蛋白酶-3(matrix metalloproteinase-3,MMP-3)、NF-κB(P65)的表达,提示山药多糖可提高胰岛素敏感性,对高脂血症有保护作用[17]。Xue Yueheng等[18]采用超滤技术分离得到的山药多糖均具有清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基、羟自由基以及超氧阴离子自由基活性,从而发挥其抗氧化作用。Peng Cheng等[19]也探讨了山药多糖对前列腺癌细胞株和荷瘤小鼠增殖的影响及其机制,发现其通过诱导Caspase-3的过度表达而强烈抑制前列腺癌的生长,可能是一种有效的抗癌策略。在糖尿病小鼠的饮食中添加粗山药多糖被证明具有显著的降血糖作用,且主要通过增加胰岛素分泌来介导,从而修复受损的β细胞,消除过量的自由基[12]。然而,关于多糖能否抑制LDL的氧化和糖化进程的报道较少。
本研究采用超声波辅助法提取山药多糖并除杂,对山药多糖体外清除自由基能力和抑制LDL氧化的作用进行了研究。
1 材料与方法
1.1 材料与试剂
铁棍山药(Dioscorea opposita)购于北京农学院便民超市。该研究得到北京农学院伦理委员会的批准,新鲜猪血取自河北灵熙食品有限公司,并参照文献[20]的方法分离血浆。
无水乙醇、氯仿、正丁醇、苯酚、浓H2SO4(质量分数98%)、半乳糖醛酸标准品、间羟基联苯、葡萄糖(分析纯) 国药集团化学试剂有限公司;DPPH(分析纯) 美国Sigma公司;50 mmol/L Tris-HCl溶液、水杨酸、FeSO4、H2O2、肝素钠、CuSO4、乙二胺四乙酸二钠、三氯乙酸、2-硫代巴比妥酸、氨基胍(aminoguanidine,AG)、TAE缓冲液、琼脂糖(分析纯) 北京化工厂;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒 美国Thermo Fisher Scientific公司。
1.2 仪器与设备
10F-2A型数显电热恒温鼓风干燥箱 上海精宏实验设备有限公司;KQ-500DE型超声波清洗机 昆山市超声仪器有限公司;5417R型离心机 德国Eppendorf公司;RE52-98型真空旋转蒸发仪 上海亚荣生化仪器厂;HH-S型水浴锅 常州翔天实验仪器厂;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限公司;XS-06A型真空冷冻干燥机 杭州翔盛气体设备有限公司;DYY-III 2型稳压稳流电泳仪、DYYIII 3IA/31B型电泳槽 北京六一仪器厂;SX-300型凝胶成像系统 上海勤翔科学仪器有限公司;LC-10A高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)仪 日本岛津公司。
1.3 方法
1.3.1 原料处理
新鲜铁棍山药洗净,去皮,切片(1~2 cm厚),60 ℃烘干,粉碎,过60 目筛,制粉备用。
1.3.2 多糖的提取
参照文献[21]并稍作修改。山药粉20 g,按山药粉与蒸馏水质量比为1∶30,超声功率600 W,提取时间60 min,提取温度70 ℃,提取2 次,合并提取液,冷却,在10 000 r/min下离心10 min,收集上清液,用真空旋转蒸发仪(60 ℃)浓缩至原体积的1/5。
1.3.3 多糖的除杂
在浓缩液中加4 倍体积的无水乙醇沉淀,并于4 ℃下静置24 h,在10 000 r/min下离心15 min。按照Sevag法除蛋白3 次[22]、活性炭脱色、透析(可截留分子质量为8 000 Da的透析袋),最后置于-80 ℃冰箱中,待完全冻结后,在抽真空下低温冷冻干燥至质量不变,取出,放于4 ℃冰箱中备用。
1.3.4 多糖的组分测定
1.3.4.1 总糖质量分数的测定
总糖质量分数的测定采用苯酚-硫酸法[23]。用250 mg葡萄糖配制成质量浓度为1 mg/mL的葡萄糖标准母液。取0.1~0.5 mL的母液定容至10 mL制成不同质量浓度的葡萄糖标准溶液。将多糖溶液2 mL、质量分数6%苯酚1 mL、浓H2SO45 mL充分混匀,室温静置10 min,沸水浴15 min,用H2O作空白对照。在490 nm处测定上述溶液吸光度,以葡萄糖质量浓度为横坐标,对应的吸光度为纵坐标,绘制标准曲线,并求出回归方程。样品的测定方法同上,重复3 次,根据回归方程求得总糖质量分数。
1.3.4.2 蛋白质量分数的测定
用BCA蛋白定量试剂盒测定多糖的蛋白质量分数。
1.3.4.3 灰分质量分数的测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》测定多糖中的灰分质量分数。
1.3.4.4 糖醛酸质量分数的测定
参照文献[24]测定糖醛酸质量分数。从1 mg/mL的半乳糖醛酸标准溶液中分别移取0~0.6 mL溶液到10 mL容量瓶中并用蒸馏水定容,再分别取上述溶液1 mL与4.78 g/L的四硼酸钠/硫酸溶液5 mL充分混匀,沸水浴5 min,冷却,加1.5 mg/mL的间羟基联苯溶液100 μL。用H2O做空白,在波长524 nm处测吸光度。以标准糖醛酸质量浓度ρ/(mg/mL)为横坐标、吸光度A为纵坐标,绘制标准曲线,求出回归方程。样品中糖醛酸质量分数测定同前所述。
1.3.5 多糖分子质量的测定
参考文献[25],采用HPGPC技术,通过KS805-804-802色谱柱(7.8 mm×300 mm,8 μm)对多糖的分子质量进行测定。5 mg/mL多糖样品溶液12 000 r/min离心10 min,上清液用0.22 μm微孔滤膜过滤后将样品转移至1.8 mL进样瓶中备用。进样量:20 μL;用40 ℃双蒸馏水以0.8 mL/min的速度洗脱。以不同相对分子质量的葡聚糖(1 152、5 220、11 600、23 800、48 600、80 900、148 000、273 000、409 800、667 800 Da)为标准品,做标准曲线,计算样品的分子质量。
1.3.6 多糖的抗氧化活性测定
1.3.6.1 DPPH自由基清除率的测定
参照文献[26]的方法并稍作修改。在试管中加入0.1 mL不同质量浓度(0、0.4、0.8、1.2、1.6 mg/mL和2.0 mg/mL)的多糖样品溶液及3.9 mL DPPH-乙醇溶液(0.1 mmol/L),37 ℃避光培养30 min,以H2O做空白组,VC为阳性对照组,测定517 nm波长处的吸光度。按式(1)计算DPPH自由基清除率。
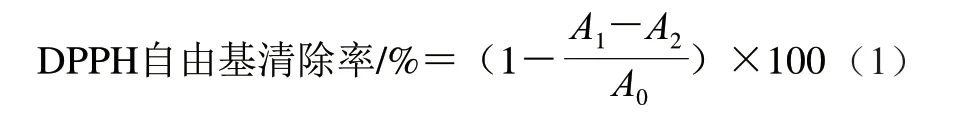
式中:A0表示空白组吸光度;A1表示样品组的吸光度;A2表示样品对照组的吸光度(乙醇代替反应液)。
1.3.6.2 超氧化物自由基清除率的测定
参照文献[26]的方法并稍作修改。配制不同质量浓度(0、0.4、0.8、1.2、1.6 mg/mL和2.0 mg/mL)的多糖样品溶液,取0.5 mL多糖样品溶液,加入3 倍体积50 mmol/L Tris-HCl缓冲溶液,30 ℃下孵育20 min。冷却至室温,加1.5 mL 7 mmol/L邻苯三酚溶液。3 min后,加0.5 mL质量分数37.5%的HCl溶液终止反应,以VC为阳性对照。测定320 nm波长处的吸光度,按式(2)计算超氧化物自由基清除率。
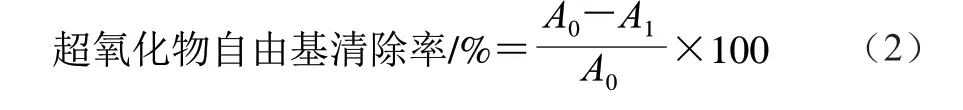
式中:A0为对照组的吸光度(蒸馏水代替样品);A1表示样品组的吸光度。
1.3.6.3 羟自由基清除率的测定
参照文献[21]的方法并稍作修改。配制不同质量浓度(0、0.4、0.8、1.2、1.6 mg/mL和2.0 mg/mL)的多糖样品溶液。在试管中分别加入1.0 mL FeSO4溶液(9 mmol/L)、样品溶液和H2O2(9 mmol/L),室温放10 min,最后加1.0 mL 9 mmol/L水杨酸-乙醇溶液,充分摇匀,37 ℃水浴30 min,冷却至室温,在6 000 r/min下离心10 min,测定上清液在510 nm波长处的吸光度,按式(3)计算羟自由基清除率。
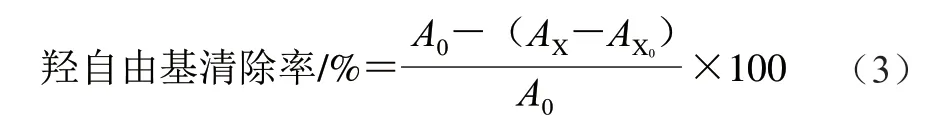
式中:AX为样品组吸光度;AX0为样品对照组的吸光度(H2O代替水杨酸);A0则表示空白对照组的吸光度(H2O代替样品)。
1.3.7 LDL的提取及纯化
参照文献[20]并稍作修改。在猪血血浆中加入10 倍体积沉淀液(64 mmol/L柠檬酸钠溶液,用5 mol/L HCl调节pH 5.04,肝素钠浓度为50 000 U/L),混匀后37 ℃水浴15 min。10 000 r/min离心15 min,向沉淀中加入5 倍洗涤剂(64 mmol/L柠檬酸钠溶液,用5 mol/L HCl调节pH 5.11),10 000 r/min下离心25 min离心即得LDL沉淀。用20 倍体积的0.01 mol/L pH 8.2磷酸盐缓冲溶液(phosphate buffered saline,PBS)完全溶解后4 ℃透析(可截留分子质量为10 000 Da的透析袋)24 h。根据文献[27]的方法测定LDL中的蛋白质量浓度,并将质量浓度调整到400 mg/L后冷冻保藏于-20 ℃冰箱中备用(贮存时间少于2 周)。
1.3.8 LDL纯度鉴定
参考文献[28],用质量分数0.5%的琼脂糖凝胶电泳对LDL的纯度进行鉴定,0.5 mL猪血血浆(用去离子水稀释3 倍)和0.5 mL 400 mg/L LDL中分别加入质量分数0.05%溴酚蓝甘油染色液0.5 mL混匀,离心(4 ℃、10 000 r/min,15 min)后取上清液进行上样,加样量为20 μL。电极液为pH 8.4的巴比妥酸缓冲液,电压120 V,电泳时间50 min。用G-250染色1 h,甲醇-冰乙酸脱色,用凝胶成像系统采集图像。
1.3.9 多糖对LDL氧化的影响
1.3.9.1 多糖对共轭二烯形成的延缓作用的测定
参考文献[6]并稍作修改来测定多糖对共轭二烯(conjugated dienes,CD)产生的延缓作用。将LDL样品(蛋白质量浓度为400 μg/L)在含PBS(10 mmol/L,pH 7.4)和多糖(0.2、0.4、0.6、0.8 μg/mL和1.0 μg/mL)的培养基中37 ℃孵育5 min,然后加入CuSO4(终浓度10 μmol/L)进行氧化。测定时,不同时间点取出来自培养基反应的等分试样用于评估CD的形成,间隔40 min(0~240 min)测定234 nm波长处的吸光度。CuSO4组(即促氧对照组)中的多糖样品以等体积的甲醇代替;空白组以等体积的甲醇代替多糖样品,以等体积的去离子水代替CuSO4溶液。
1.3.9.2 硫代巴比妥酸反应物水平的测定
脂质过氧化的最终产物通过测定硫代巴比妥酸反应物质(thiobarbituric acid reactive substance,TBARS)的水平进行评估,具体方法参照文献[6]并稍加修改。组别设置为:多糖样品组:LDL(蛋白质量浓度400 μg/L)含有PBS(10 μmol/L,pH 7.4)+不同质量浓度多糖(0.2~1.0 μg/mL)+CuSO4(最终浓度10 μmol/L);CuSO4组:样品被去离子水代替;空白组:用等体积去离子水代替CuSO4和样品。
将上述反应体系在37 ℃下培养2 h。向1 mL混合物中添加50 μL质量分数1%乙二胺四乙酸二钠、2 mL质量分数15%三氯乙酸和2 mL质量分数0.76% 2-硫代巴比妥酸进行TBARS的显色反应。沸水浴35 min后冷却,并在532 nm波长处测定吸光度。TBARS水平按公式(4)计算。
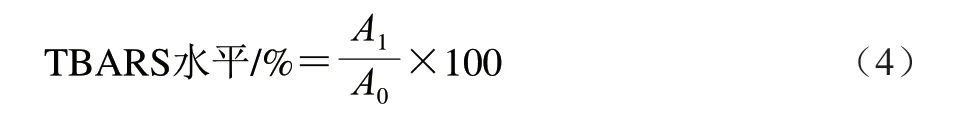
式中:A1是CuSO4组或多糖样品组的吸光度;A0是空白对照组的吸光度。
1.3.10 多糖对LDL糖化的影响
1.3.10.1 LDL糖化形成糖化终产物参照文献[6]的方法稍作修改,建立LDL糖化孵育体系。组别设置如下:空白组:PBS(10 mmol/L,pH 7.4)+LDL(蛋白质量浓度1.4 mg/mL);糖化模型组:PBS(10 mmol/L,pH 7.4)+LDL(蛋白质量浓度1.4 mg/mL)+葡萄糖(500 mmol/L);阳性对照组:PBS(10 mmol/L,pH 7.4)+AG(10 mmol/L)+LDL(蛋白质量浓度1.4 mg/ mL)+葡萄糖(500 mmol/L);多糖样品组:PBS(10 mmol/L,pH 7.4)+多糖溶液(质量浓度为1.0 μg/mL)+LDL(蛋白质量浓度1.4 mg/mL)+葡萄糖(500 mmol/L)。各组样品在37 ℃下培养48 h,并于10 mmol/L PBS(pH 7.4)中4 ℃透析。
1.3.10.2 琼脂糖凝胶电泳
参照文献[23]的方法并稍作修改,在TAE缓冲液中进行电泳实验。实验组别与1.3.10.1节相同,具体操作方法和实验条件同1.3.8节。
1.4 数据处理与分析
所有结果均表示为平均值±标准差,采用SPSS 16.0软件进行单因素方差分析,通过邓肯多重比较进行事后检验,P<0.05表示差异显著。
2 结果与分析
2.1 山药多糖的组分分析
由表1可知,山药多糖中的总糖质量分数为(65.79±1.03)%,说明提取的多糖较纯。蛋白质量分数为(5.89±0.43)%,于海芬[29]研究结果表明,用Sevag法脱蛋白8 次后,多糖的脱蛋白率为55.77%,表明多糖中的蛋白质不是特别容易被完全去除,而且可能与多糖发生共价反应。灰分质量分数为(5.51±0.14)%,说明山药多糖中含有矿物质。糖醛酸质量分数达(10.81±1.14)%。

表1 山药多糖的化学组成Table1 Chemical composition of Chinese yam polysaccharides
2.2 山药多糖的分子质量
如图1A所示,HPGPC洗脱出的峰主要集中在40~45 min之间。以葡聚糖标准品绘制的标准曲线见图1B,根据lgmw-tR(mw表示分子质量/Da;tR表示保留时间/min)校正曲线方程y=-0.200 2x+12.75,R2=0.994 8计算可得出多糖的分子质量。多糖主要由4 个多糖组分组成,分别为933 742 Da(tR=33.865 min)、148 878 Da(tR=37.848 min)、39 233 Da(tR=40.741 min)、17 318 Da(tR=42.515 min)。这一结果与Yang Weifang等[30]的实验结果不同,其用热水浸提法得到粗多糖,对得到的粗多糖进行Sevag法脱蛋白,然后采用Sephadex G-100柱色谱法进一步纯化得到纯多糖,HPGPC分析结果显示只有一个单峰,对应的分子质量为16 619 Da。分析造成结果不同的原因可能是提取多糖的条件和除杂方法不同。
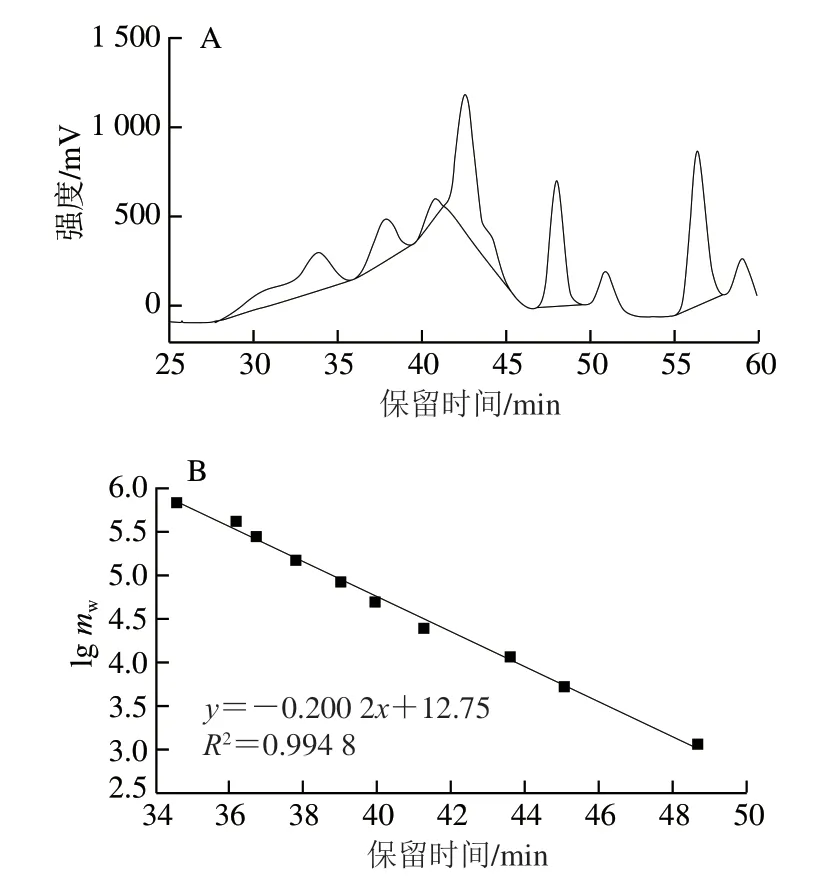
图1 山药多糖的HPGPC洗脱曲线(A)和分子质量标准曲线(B)Fig. 1 High performance gel permeation chromatography elution curve of polysaccharides from Chinese yam (A) and standard curve for molecular mass estimation (B)
2.3 山药多糖的抗氧化性
2.3.1 山药多糖的DPPH自由基清除率
由图2可知,阳性对照VC具有很强的抗氧化性,其DPPH自由基清除率在质量浓度为0~0.4 mg/mL时快速增加,0.4~0.8 mg/mL时增加缓慢,之后趋于平稳。山药多糖的DPPH自由基清除率和质量浓度呈线性依赖关系,且相同质量浓度下,山药多糖的DPPH自由基清除率显著低于VC(P<0.05)。经计算得山药多糖的半抑制质量浓度(half maximal inhibitory concentration,IC50)为1.06 mg/mL,当质量浓度为2 mg/mL时,山药多糖的DPPH自由基清除率可达(79.0±0.2)%。
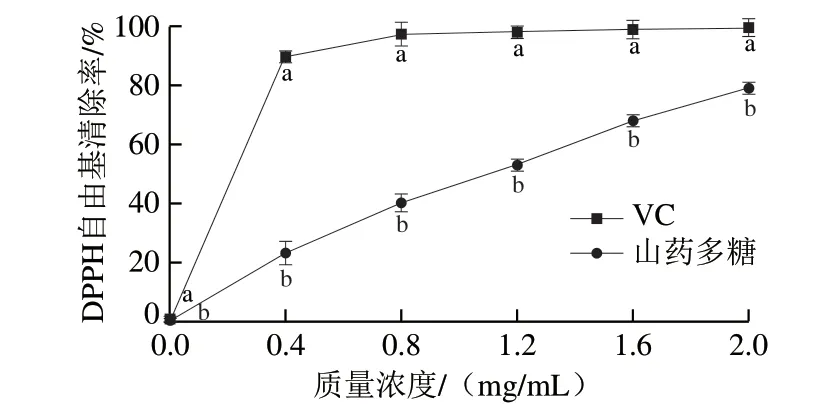
图2 不同质量浓度下山药多糖的DPPH自由基清除率Fig. 2 DPPH radical scavenging capacity of Chinese yam polysaccharides at different concentrations
2.3.2 山药多糖的超氧化物自由基清除率
山药多糖对超氧化物自由基的清除能力如图3所示,VC对超氧化物自由基活性的抑制趋势与DPPH自由基相近,山药多糖在质量浓度0~1.2 mg/mL范围内增加时,其超氧化物自由基清除率明显增加,在1.2~2.0 mg/mL范围内增加时增加缓慢。山药多糖对超氧化物自由基的IC50为1.06 mg/mL,这与Yang Weifang等[30]的研究结果相似,其对山药多糖进行纯化后得当山药多糖质量浓度为1.0 mg/mL时,对超氧化物自由基的清除率为43%。当质量浓度为2.0 mg/mL时,山药多糖对超氧化物自由基的清除率可达(76.0±2.8)%。
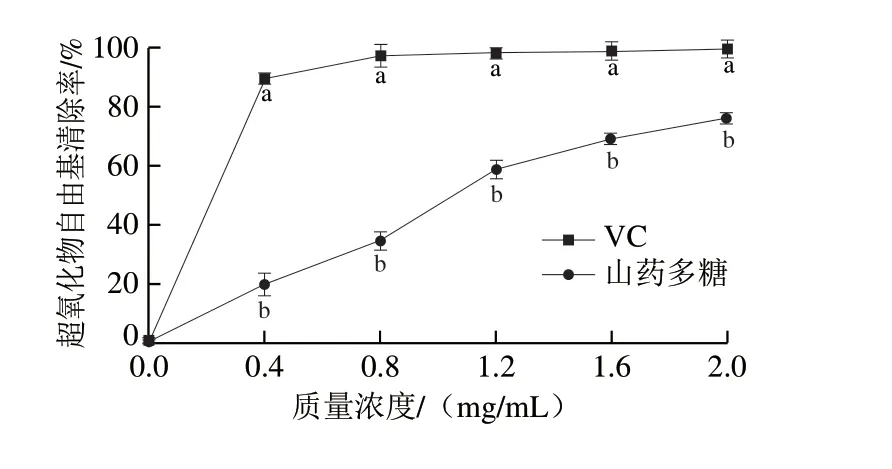
图3 不同质量浓度下山药多糖的超氧化物自由基清除率Fig. 3 Superoxide radical scavenging capacity of Chinese yam polysaccharides at different concentrations
2.3.3 山药多糖的羟自由基清除率
图4反映了不同质量浓度山药多糖对羟自由基的清除率,山药多糖对羟自由基的清除能力随质量浓度(0~2.0 mg/mL)的增加而增加,表现出良好的质量浓度依赖关系。山药多糖对羟自由基的IC50为0.98 mg/mL。当山药多糖质量浓度达2.0 mg/mL时,其羟自由基清除率为(65.0±0.4)%。
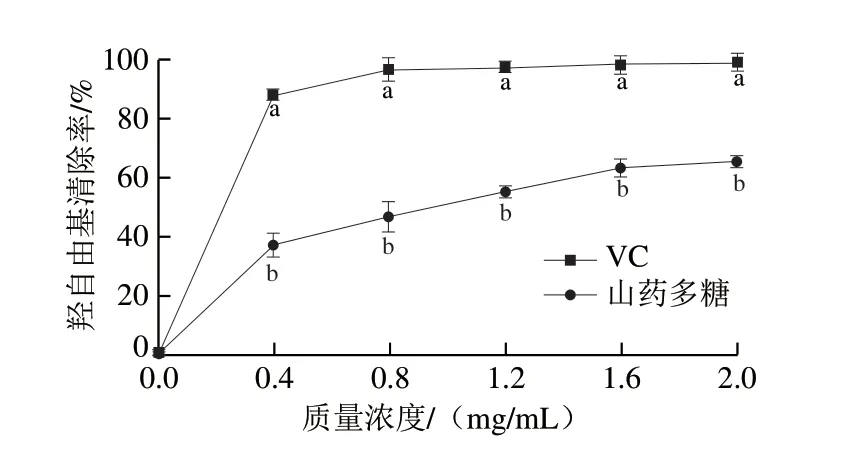
图4 不同质量浓度下山药多糖的羟自由基清除率Fig. 4 Hydroxyl radical scavenging capacity of Chinese yam polysaccharides at different concentrations
2.4 LDL纯度鉴定结果
如图5所示,与血浆(泳道1)相比,纯化后的LDL显示出单一的条带,且颜色较浅(泳道2),说明所制备的LDL纯度较高,这与王丽丽等[28]的研究结果一致。

图5 LDL琼脂糖凝胶电泳Fig. 5 Agarose gel electrophoresis of purified LDL
2.5 山药多糖对LDL氧化的影响
2.5.1 山药多糖对共轭二烯形成的延缓作用
CD的形成是LDL氧化在延迟、增殖和早期降解阶段动态变化的重要指标。基于上述结果,进一步研究了山药多糖对LDL氧化的抑制作用。吸收度变化越小,表明抑制LDL氧化的作用越强。由图6可知,空白组和多糖组的吸光度变化均低于CuSO4组,表明多糖能有效延缓CuSO4诱导LDL氧化过程中CD的形成。反应40 min时,空白组、CuSO4组、多糖组(0.2、0.4、0.6、0.8、1.0 μg/mL)的吸光度分别变化0.016、0.105、0.054、0.048、0.043、0.039、0.036。120 min后,多糖组的组间吸光度差异显著(P<0.05),当反应进行到240 min时,空白组、CuSO4组、多糖组(0.2、0.4、0.6、0.8、1.0 μg/mL)的吸光度分别变化0.167、0.725、0.485、0.480、0.460、0.450、0.436。这些结果表明,山药多糖可通过延缓CD的形成时间来降低LDL氧化速率,从而延缓动脉粥样硬化的形成。
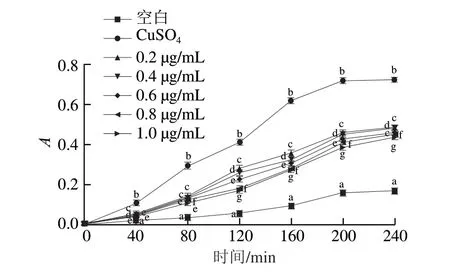
图6 不同质量浓度山药多糖对CD形成的延缓作用Fig. 6 Inhibitory effect of different concentrations of Chinese yam polysaccharides on conjugated dienes formation
2.5.2 山药多糖对硫代巴比妥酸反应物形成的影响
随着LDL脂质过氧化反应的进形,LDL氧化修饰进入降解阶段,导致在增殖期产生的LOOH发生降解,形成大量的有毒醛,与硫代巴比妥酸反应生成在532 nm波长处有特征吸收峰的粉红色物质。通过测定TBARS水平,可进一步确定山药多糖对降解阶段LDL氧化的延迟作用。如图7所示,山药多糖在1.0 μg/mL时对LDL氧化的抑制效果最好,对TBARS产生的抑制率为促氧对照组的16.28%,但是质量浓度在0.4~0.8 μg/mL时对LDL氧化抑制效果差异不显著(P>0.05)。总的来说,山药多糖可以抑制TBARS的产生,并且呈现出质量浓度依赖关系。
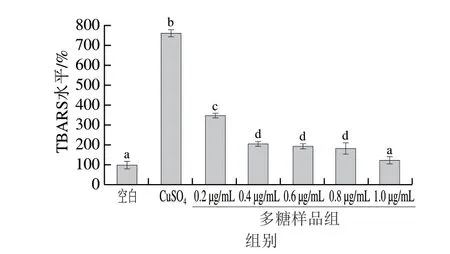
图7 山药多糖对CuSO4诱导LDL氧化时TBARS产生的影响Fig. 7 Inhibitory effect of Chinese yam polysaccharides on TBARS production during LDL oxidation induced by CuSO4
2.6 山药多糖对LDL糖化的影响
人体内糖化终产物含量过高会引发高血糖等疾病。因此,进一步研究山药多糖对LDL糖化的影响,以探讨山药多糖是否可以通过多途径抑制LDL的氧化。如图8所示,糖化模型组电泳迁移距离最长(5.2 cm),阳性对照组电泳迁移距离最短。多糖样品组的迁移距离为4.7 cm,明显短于糖化模型组的迁移距离,略短于空白组,但是比阳性对照组的迁移距离长,说明山药多糖对LDL糖化有抑制作用,但是效果不明显。

图8 山药多糖对琼脂糖凝胶电泳法测定LDL糖化的影响Fig. 8 Effect of Chinese yam polysaccharides on LDL glycation evaluated by agarose gel electrophoresis
3 结 论
本研究以山药为试材,对山药多糖进行提取除杂。对纯山药多糖的化学组成和体外清除自由基的能力进行了分析,对山药多糖能否抑制LDL的氧化进程进行了探讨。结果表明,山药多糖的化学组成为:总糖质量分数(65.79±1.03)%、蛋白质量分数(5.89±0.43)%、灰分质量分数(5.51±0.14)%、糖醛酸质量分数(10.81±1.14)%。与VC相比,在相同质量浓度条件下,山药多糖的自由基清除率显著低于VC,对DPPH自由基、超氧化物自由基和羟自由基的清除能力的IC50分别为1.06、1.06 mg/mL和0.98 mg/mL。山药多糖不仅可以有效延缓LDL氧化过程中CD的形成和TBARS的产生,还对LDL糖化有抑制作用。值得注意的是,在山药多糖提取物中可能存在糖蛋白,该物质也可参与到抑制LDL的氧化进程中来。因此,未来山药山药多糖的研究重点可以从糖蛋白的角度出发进一步研究山药多糖抑制LDL氧化进程的机制。

