多糖协同超声波处理对低盐鸡肉糜凝胶特性的影响
高廷轩,邓绍林,赵 雪,周光宏
(南京农业大学食品科学技术学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
食盐在加工肉制品中扮演着重要作用,除提供咸味、补充人体必需矿物质外,高盐环境还可抑制微生物的生长,延长产品的保存时间。对于肉糜制品而言,食盐可以促进肌原纤维蛋白(myofibrillar protein,MP)为主的盐溶性蛋白溶出。由于MP是形成蛋白凝胶网络、保持水分及维持乳化体系稳定性的主要蛋白质,因此食盐添加对保证肉糜制品的品质至关重要[1]。然而,研究证明长期摄入过量钠离子会导致心血管疾病以及肾脏相关疾病的风险增加[2]。对于肉糜制品,如香肠、肉丸和肉饼等,降低盐含量不仅会导致产品出现结构松散、出水出油等问题,也会使风味降低[1]。因此开发低钠肉制品已是近年来肉类科学家的研究重点。当前肉制品中常见的减钠方法主要有钠盐替代[3]、添加植物蛋白(如鹰嘴豆分离蛋白或大豆分离蛋白)[4-5],或添加多糖类物质(如海藻粉、刺槐豆胶、卡拉胶和膳食纤维)[6-9]等。然而钠盐替代常会产生苦味和金属味,严重影响产品风味,因此限制了其添加量。同时,相比植物蛋白,添加多糖可以降低成本,增加产量,提高保水保油性,同时还是潜在的脂肪替代物[2,10]。
多糖是一类由单糖聚合而成的重要的大分子物质,来源于多种动植物和微生物。活性多糖如香菇多糖、银耳多糖和黄芪多糖因其生物学特性在医药领域发挥重要作用;而非活性多糖如淀粉、树胶和纤维素等则通常作为食品和化妆品的添加剂[11]。多糖按其离子特性可分为阴离子多糖、阳离子多糖和中性多糖,不同种类的多糖依据其特殊的离子特性或凝胶特性对肌肉肉糜体系产生影响。壳聚糖(chitosan,CH)是由甲壳素脱乙酰形成的分子质量在10~1 000 kDa的线性多糖。它由β-(1-4)-D-葡糖胺(脱乙酰化单元)和N-乙酰基-D-葡糖胺(乙酰化单元)组成,酸度系数接近pH 6.5[12],在酸性环境中,分子中氨基可与氢质子结合使自身携带正电荷,因此CH是一种阳离子多糖,也是自然界中唯一的阳离子多糖。研究发现,带正电的CH在肉糜体系中能够与带负电的蛋白质相缔合,并主要依靠静电作用力和氢键与蛋白质相互作用,改变蛋白凝胶特性[13-14]。瓜尔豆胶(guar gum,GG)提取自瓜尔豆,是一种广泛使用且廉价的中性多糖。由于GG主链存在大量羟基,在水中可以与水分子间形成大量氢键,因而即使很微量的GG也可以显著增加体系表观黏度[15]。GG性质稳定,对pH值和一价金属离子都不敏感,常用作食品增稠剂和持水剂[15-16]。GG常在肉制品中作为脂肪替代物来改善低脂导致的产品品质劣变[17],或作为稳定剂来稳定乳化体系[18]。虽然通过添加多糖改善肉制品品质已得到广泛研究,然而针对低盐肉制品,由于添加量的限制使得单一的多糖添加不足以弥补减盐带来的品质劣变。因此需要寻找可以与添加多糖协同作用的处理方式。
近年来,超声波因其低成本、低污染和高效率的特点在食品加工领域广泛使用[19-20]。超声波是指频率高于人类听觉阈值的机械波,主要分为高频和低频两种。高频超声波由于低能量高灵敏度常用于食品的无损检测,而低频高能量超声波则依靠其物理或化学效应广泛用于食品加工[21]。超声波处理(ultrasound treatment,UT)能够在液体介质中形成声空化效应,促进气泡形成并瞬间膨胀爆破,释放高能量,从而在固体表面形成微射流,并催化水分子分解成自由基。UT可以增强化学反应,引起蛋白质的交联[22]。许多研究表明UT是一种高效的鸡肉凝胶品质改善方法。Zhang Ziye[23]和Wang Jingyu[24]等分别探究了不同超声时间和不同超声功率对MP功能特性的影响,并分别在6 min或600 W处理下得到最佳的质构特性、保水效果、MP溶解度和微观结构。采用超声波处理鱼MP-黄原胶复合体系能够促进MP和黄原胶的络合,并有效改善MP的凝胶乳化性能[25]。UT还被证明是改善异质肉糜或低盐肉糜凝胶性质的有效方法[26-27]。虽然超声波技术已经在肉品加工中得到广泛研究,然而针对低盐制品的UT往往需要更高的处理强度和更长处理时间,因此其在低钠产品中的应用仍需要进一步探索[28]。
综上所述,综合性探究添加多糖与UT的协同作用并研究其作用机制对低钠肉糜制品的开发具有深远意义。本研究采用多糖协同超声波处理(polysaccharideutrasonic treatment,PS-UT)技术手段对低盐鸡胸肉糜体系进行处理,通过比较添加不同多糖并协同或不协同UT对低盐鸡胸肉糜体凝胶特性的变化,为阐明不同PS-UT协同处理机制提供理论基础,为提高低凝胶类鸡肉制品品质,保证产品价值提供新的思路。
1 材料与方法
1.1 材料与试剂
新鲜鸡胸肉 泰森华东食品发展有限公司;壳聚糖(中黏度:200~400 mPa·s) 上海阿拉丁生化科技股份有限公司;瓜尔豆胶和质量分数2.5%戊二醛固定液上海源叶生物科技有限公司;氯化钠、磷酸二氢钠、磷酸氢二钠、乙醇和冰乙酸(均为分析纯) 中国医药集团有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒 中国赛默飞世尔科技有限公司。
1.2 仪器与设备
VC750超声波细胞破碎仪 美国SONICS有限公司;Type HM100绞肉机 北京格瑞德曼仪器设备有限公司;Avanti J-26S XP离心机 美国贝克曼库尔特有限公司;PD500匀浆机 英国PEIMA仪器有限公司;FiveEasy Plus台式pH计 梅特勒-托利多仪器(上海)有限公司;TW20水浴锅 德国优莱博有限公司;XY105MW水分含量测定仪 常州市幸运电子设备有限公司;TA-XT2i质构仪 英国Stable Micro Systems公司;Physical MCR 301流变仪 奥地利Anton Paar公司;MesoMR23-060H-I弛豫分析和磁共振一体核磁成像分析仪 上海纽迈电子有限公司;CR-400色差仪 日本Konica Minolta公司;SU8100扫描电子显微镜 日立(中国)有限公司。
1.3 方法
1.3.1 多糖溶液的制备
取CH 2.5 g溶于100 mL质量分数1%的乙酸溶液,搅拌至完全溶解,4 ℃密封保存。取GG 2.5 g溶于100 mL去离子水,80 ℃下搅拌至完全溶解,4 ℃密封保存过夜。
1.3.2 低盐鸡胸肉糜多糖体系的制备
取500 g新鲜鸡胸肉,擦去表面水分,剔除脂肪和结缔组织,切成边长约1 cm的正方体,用Type HM100绞肉机在3 000 r/min下斩拌20 s。采用XY105MW水分含量测定仪测定肉糜水分含量,采用BCA试剂盒测定肉糜蛋白质量分数。将多糖溶液、肉糜、NaCl及去离子水按比例混合,使最终体系蛋白质量分数为6%,多糖质量分数为0.5%,NaCl质量分数为1%,空白组用去离子水代替多糖溶液。将混合后的体系至于碎冰中,用PD500匀浆机以5 000 r/min冰浴匀浆30 s/次,匀浆3 次,每次间隔1 min。为避免不同pH值对结果的干扰,采用2 mol/L NaOH和2 mol/L HCl调整各处理组pH值至6.0。
1.3.3 鸡胸肉糜处理
将1.3.2节制备好的各组样品转移至100 mL烧杯中,用VC750超声波细胞破碎仪处理,处理过程中用冰水浴冷却烧杯,保持样品温度为4~8 ℃。所用探头直径6 mm,超声频率为20 kHz,功率450 W,探头的位置放置于距样品表面1.5 cm深处,脉冲持续2 s,停止4 s,处理1 min后置于冰水浴中降温2 min,然后再次进行1 min间歇超声处理,重复3 次。实验共设置6 个组,分别为CON(空白对照组)、UT(只进行UT)、GG(添加GG未进行UT)、GG-UT(添加GG并协同UT)、CH(添加CH未进行UT)、CH-UT(添加CH并协同UT)组。
1.3.4 热诱导鸡胸肉糜凝胶的制备
将1.3.3节处理后的每组样品静置平衡8 h后,分装至50 mL离心管,每管约20 g,用Avanti J-26S XP离心机低速离心(500×g、3 min)除去气泡,于TW20恒温水浴锅中,以1 ℃/min速率由20 ℃升温至80 ℃,并在80 ℃保温20 min,热诱导制备肉糜凝胶,随后置于4 ℃冷却8 h后待测。
1.3.5 质构特性的测定
肉糜凝胶样品质构特性的测定参考文献[29]并略作修改。取1.3.4节制备的肉糜凝胶样品,使用平行刀切2.0 cm厚的圆柱体,通过质构分析仪TA-XT2i的P/50探头进行质构测定。测定样品条件如下:两次压缩测试间隔5 s,压缩量为样品高度的50%;测定前速率为1 mm/s,测定中速率为5 mm/s,测定后速率为5 mm/s;触发力为5.0 g,触发类型为自动。测定后使用TA-XT Express软件计算得出凝胶硬度。
1.3.6 蒸煮损失率的测定
1.3.4节每只离心管装入的肉糜体系质量为m1/g,将热诱导制备肉糜凝胶4 ℃冷却8 h后从离心管中取出,擦干表面水分,称得质量m2/g。按式(1)计算肉糜凝胶的蒸煮损失率。

1.3.7 色泽特性的测定
取1.3.4节所得肉糜凝胶样品,采用CR-400便携式色差计进行色泽特性的测定。色差仪用标准白板校准后,每组凝胶选取5 个点测定红度a*值、黄度b*值和亮度L*值,并按式(2)计算白度[30]。

1.3.8 流变特性测定
取1.3.3节肉糜样品静置静置平衡8 h后采用Physical MCR 301流变仪测量肉糜凝胶流变特性,参考Zhao Yingyu等[8]的方法,并略有改动。采用半径为50 mm的平板探头,将样品均匀涂抹于平板上,间距设定为1 mm,采用温度扫描模式和剪切速率扫描模式分别测定储能模量G’和表观黏度η。
温度扫描模式:将样品于20 ℃保温1 min,随后从20 ℃升温至80 ℃,升温速率为2 ℃/min,振幅1%,频率1 Hz,用液体石蜡将平板间隙密封,防止水分挥发。
剪切速率扫描模式:将样品置于50 mm平板上于25 ℃平衡30 s,达到测试温度。记录剪切速率从0.1 s~1 000 s-1的表观黏度,剪切时间为330 s。
1.3.9 水分分布测定
取1.3.3节肉糜样品静置平衡8 h后各组肉糜体系的水分分布采用MesoMR23-060H-I弛豫分析和磁共振一体核磁成像分析仪测定,参考Han Minyi等的方法[31],略有改动。取约2 g肉糜样品放置于直径为8 mm的核磁管中,密封后于恒温水浴锅中,以1 ℃/min速率由20 ℃升温至80 ℃,并在80 ℃保温20 min形成凝胶,随后置于4 ℃冷却8 h。测量前使样品恢复至室温,擦干核磁管表面水分,放入直径15 mm的测试管中进行测试。样品测定参数如下:温度为32 ℃,自旋-弛豫时间(T2)使用CPMG序列进行测定,所测定使用参数τ值(90°和180°脉冲之间的时间)为0.40 ms,重复扫描8 次,回波数10 000,两次扫描之间重复时间为4 000 ms,通过仪器自带的MultiExp Inv分析软件进行反演获得T2值。反演的结果为弛豫图和各个弛豫时间(T21、T22、T2b)及其所对应的峰面积比例(P21、P22、P2b)。每个处理测定3 次。
1.3.10 凝胶微观结构观察
取1.3.4节所得肉糜凝胶样品,将肉凝胶样品切成2 mm×2 mm×2 mm的立方体,放置于质量分数2.5%戊二醛的固定液中低温4 ℃下固定48 h。固定好的样品0.1 mol/L pH 7.4磷酸缓冲液漂洗3 次,每次 15 min。用0.1 mol/L pH 7.4磷酸缓冲液配制质量分数1%锇酸,室温避光固定1~2 h。0.1 mol/L pH 7.4磷酸缓冲液漂洗3 次,每次15 min。随后依次用体积分数为30%、50%、70%、80%、90%、95%、100%乙醇溶液冲洗,每次15 min,再用乙酸异戊酯脱水15 min。脱水后将样本放入临界点干燥仪内进行干燥。将干燥后样本紧贴于导电碳膜双面胶上放入离子溅射仪样品台上进行喷金30 s 左右。使用SU8100扫描电子显微镜观察样品,并放大800 倍拍照。
1.4 数据处理与分析
每个实验至少重复3 次。采用SAS 8.2软件中的Duncan多重比较进行组间差异显著性分析,P<0.05为差异显著,并分析因素间交互作用,结果以平均值±标准差表示。
2 结果与分析
2.1 PS-UT对低盐鸡胸肉糜凝胶蒸煮损失率的影响
PS-UT对低盐鸡胸肉糜凝胶蒸煮损失率的影响如图1所示。与CON组相比,UT后低盐鸡胸肉糜的蒸煮损失率由29.01%显著降低至25.36%(P<0.05),说明UT可以有效减少低盐鸡胸肉糜的汁液流失,这与Li Ke[26]、Nasyiruddin[32]等的研究结果一致。MP通常被认为不溶于低离子强度(钠离子浓度小于0.2 mol/L)的溶液,需要高浓度的盐(钠离子浓度高于0.3 mol/L))来溶解[33]。UT可使蛋白分子进一步展开,内部亲水基团暴露,并引起构象变化形成可溶性蛋白聚集体,使蛋白在低盐环境的溶解度增加[34]。同时也暴露出更多活性基团,有利于加热过程中蛋白间交联程度增加,使蛋白热凝胶网络变得更为牢固,水分更易于保持在凝胶结构内部[27]。与CON组相比,添加GG可以显著降低低盐鸡胸肉糜凝胶的蒸煮损失率(P<0.05)(由29.01%降低至2.43%),Sajad等[17]在实验中用GG替代部分动物脂肪同样发现GG替代组持水性更优。GG分子中大量的羟基可以在水溶液中形成氢键,增强持水力[15]。GG-UT组与GG组的蒸煮损失率无显著差异。可能是由于GG较高的黏稠度限制了UT空化作用在GG-肉糜体系内的传播[35],因此在超声后并无显著变化。与CON组相比,添加CH对低盐鸡胸肉糜的蒸煮损失率降低效果显著(P<0.05),可能是因为CH为阳离子多糖,会通过静电相互作用与带负电的蛋白质结合而减少水分流失[14]。CH-UT组蒸煮损失率与CH组相比进一步降低,相比UT组有更低的蒸煮损失且差异显著(P<0.05),但添加CH不如添加GG对减少蒸煮损失的效果明显。Zhou Yanzi等[36]在实验中同样发现CH对肌球蛋白凝胶保水性的改善效果弱于中性多糖刺槐豆胶。

图1 PS-UT对低盐鸡胸肉糜凝胶蒸煮损失率的影响Fig. 1 Effect of polysaccharide combined with ultrasonic treatment on the cooking loss percentage of low-salt chicken breast meat gel
2.2 PS-UT对低盐鸡胸肉糜凝胶质构特性的影响
PS-UT对低盐鸡胸肉糜凝胶质构特性的影响如图2所示。与CON组相比,UT可以显著提高低盐鸡胸肉糜凝胶的硬度(P<0.05)。由于UT促进蛋白溶解,使参与凝胶形成的蛋白含量增多[34],因此得到更均一稳定的三维凝胶网络结构,Xing Tong等[37]也在实验中发现UT可以增加低盐鸡胸肉糜凝胶的硬度。与CON组相比,添加GG会使低盐肉糜凝胶的硬度显著增加(P<0.05)。GG由于其较高的黏度和良好的保水性将更多成分留存在凝胶网络内部,提升了凝胶硬度。费立天[18]、邱春强[38]等通过添加0.1%~1.0%的GG同样提升了MP凝胶的质构特性。与CON组相比,添加CH对低盐鸡胸肉糜凝胶硬度无显著影响(P>0.05)。在类似研究中添加0.5% CH到盐溶性鸡肉蛋白质凝胶对硬度提升效果显著[12],因此推测导致这一差异的原因可能是由于低盐环境下蛋白溶出量不足[33],CH阳离子基团虽可与蛋白质发生交联形成更为致密的凝胶网络,但也一定程度影响了蛋白分子间的交联,因此对硬度提升并不显著。对添加多糖组进行UT可以进一步提升其硬度。与UT组相比,GG-UT组硬度显著增加(P<0.05),但相较于UT组和CH-UT组,GG-UT组硬度增加较小。这可能是由于UT增加了鸡肉蛋白在CH-肉糜体系内的盐溶性,并且在声空化作用下蛋白分子进一步展开暴露更多活性基团[23],有利于加热过程中蛋白间交联程度增加,因此提升显著。而GG自身黏度过高,限制了超声作用在多糖-肉糜体系内的传递效率。

图2 PS-UT对低盐鸡胸肉糜凝胶质构特性的影响Fig. 2 Effect of polysaccharide combined with ultrasonic treatment on the texture properties of low-salt chicken breast meat gel
2.3 PS-UT对低盐鸡胸肉糜凝胶色泽的影响
PS-UT对低盐鸡胸肉糜凝胶色泽的影响如表1所示。肉糜凝胶的色泽是由肌红蛋白和血红蛋白的含量与其余添加物的色泽所共同决定的[39-40]。与CON组相比,UT组低盐鸡胸肉糜凝胶的L*值、a*值和b*值无显著变化(P>0.05)。与CON组相比,添加GG后低盐鸡胸肉糜凝胶L*值、a*值和b*值无显著变化(P>0.05),但协同UT后L*值显著增加(P<0.05),a*值和b*值仍无显著变化(P>0.05);添加CH会使凝胶L*值显著降低(P<0.05),协同UT后L*值、a*值、b*值无显著变化(P>0.05)。相反,Amiza等[41]则在实验中发现随着CH的添加量增加,鲶鱼鱼糜凝胶的L*值和白度增加,这一差异可能是所用原料不同导致。通过比较各组的白度可以发现,相比CON组,添加GG可以显著提升肉糜凝胶的白度(P<0.05),添加CH则会显著降低低盐肉糜凝胶的白度(P<0.05)。协同UT对各组的白度无显著影响(P>0.05)。可能是由于本研究所使用的GG溶液为米白色,且GG可以使凝胶的水分含量增高,增强光散射性,提升白度。而CH溶液为暗黄色,且对蒸煮损失率影响不大,因此会使白度降低。

表1 PS-UT对低盐鸡胸肉糜凝胶色泽的影响Table1 Effect of polysaccharide combined with ultrasonic treatment on the color properties of low-salt chicken breast meat gel
2.4 PS-UT对低盐鸡胸肉糜凝胶流变特性的影响
对低盐鸡胸肉糜凝胶进行温度扫描动态流变测试,可得到其储能模量G’,表征肉糜体系弹性的变化。如图3所示,CON组呈现典型的低盐肉糜流变曲线[37],其特点是G’升温曲线在48 ℃左右的峰不明显或消失。在正常盐浓度条件下由于肌球蛋白头部展开结合,形成具有一定弹性的结构,使G’上升,随后又由于肌球蛋白轻链变性导致体系流动性增加,G’小幅下降[42-43]。在温度超过55 ℃以后,蛋白结构大量展开,相互不可逆交联形成稳固的凝胶弹性网络,使G’持续增加。低盐条件下由于盐溶性蛋白溶出量不足,影响了肌球蛋白头部和尾部的展开及结构变化导致峰的消失,且在后续加热过程中虽然达到蛋白变性温度但未能立即开始形成凝胶结构,表现为CON组在60 ℃左右G’才开始增加。
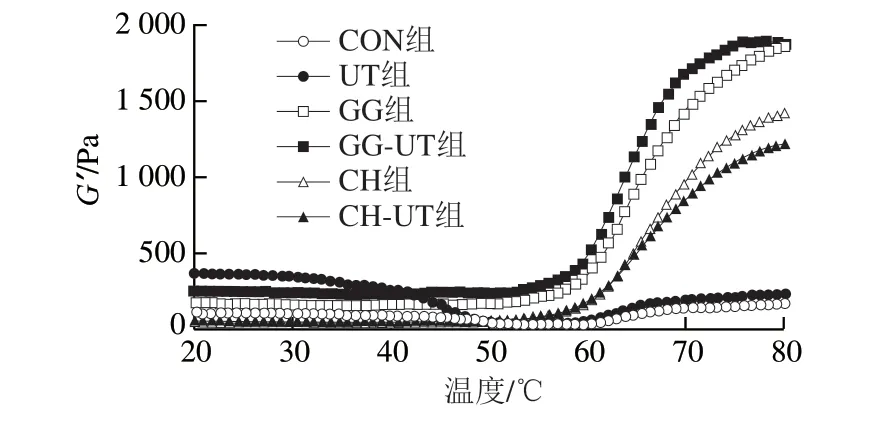
图3 PS-UT对低盐鸡胸肉糜凝胶储能模量G’的影响Fig. 3 Effect of polysaccharide combined with ultrasonic treatment on the storage modulus (G’) of low-salt chicken breast meat gel
与CON组相比,UT组的初始G’始终高于CON组,可能是由于UT使肉糜中的蛋白分子解折叠并碎片化,导致内部基团暴露[23],相互之间交联结合使得体系初始状态下具有较高的弹性特征。随着温度升高,UT组蛋白质逐渐发生变性,交联状态被破坏,G’下降至与CON组相近。在60 ℃附近开始逐渐形成凝胶网络,最终在加热终点时G’高于CON组,表明形成了更好的弹性网络。这一结果与质构特性测定结果一致。Li Ke[44]、Xing Tong[37]等在UT低盐鸡胸肉糜体系后都发现了相比空白对照组G’的增加。原因可能是UT一方面增加了蛋白溶解度[34],使参与凝胶形成的蛋白含量增加;另一方面使其结构展开,暴露更多基团,增强了蛋白之间的交联强度,使其凝胶结构更为坚固[23]。
添加GG和CH均可明显提升低盐鸡胸肉糜凝胶的G’,在80 ℃时获得远高于未添加组的G’。相比于CON组和UT组,添加GG和CH可以使得分子间交联更早开始形成,表现为G’在52 ℃左右开始持续增加,而CON组和UT组的G’则在60 ℃左右才开始持续增加。观察G’可以发现,添加GG可获得最高的G’值,在协同UT后G’进一步提升,这与硬度的结果一致。添加CH同样有明显的改善效果,但在协同UT后G’值反而有所下降,这一结果与硬度趋势不完全一致。研究显示蛋白凝胶在降温过程中G’会进一步增加[36,45],因此这一差异可能是测量时的温度差异导致的。由于硬度测试时已恢复至室温,并低温静置过夜使凝胶网络稳固,因此与CH组相比,CH-UT组虽然硬度增加,但在80 ℃时G’降低。
不同PS-UT下的表观黏度随剪切速率的变化情况如图4所示。黏度代表流体的流动阻力,取决于组分之间的相互作用[46]。与CON组相比,UT可以提升低盐肉糜体系黏度。这一结果与Amiri等[45]的研究结果相反,其研究表明随着超声处理时间延长和功率的增加,牛肉MP的黏度降低,这一差异可能是蛋白种类和盐含量等不同导致。在低盐环境下,UT使蛋白溶解量增加,结构展开,增加了蛋白间的交联,使黏度增加。相比CON组,添加GG使黏度显著增大,GG侧链含有大量羟基,溶于水后形成氢键,增稠效果显著[16],常被用于食品中的增稠剂,因此添加GG组呈现出最大的体系黏度。协同UT后,声空化作用除作用于蛋白分子外,也可使GG更均匀的分散于肉糜体系中,降低蒸煮损失率的同时也使GG-肉糜体系黏度进一步增加。然而,与CON组相比,添加CH会明显降低体系黏度,并且在协同UT后黏度进一步降低。可能是由于在pH 6.0环境下,带正电荷的CH与带负电的MP通过静电相互作用发生缔合,使容留水分的空隙部分减小,因此导致水分渗出,降低了体系黏度。协同UT能够加强CH与蛋白的交联程度,容留水分的空隙部分进一步减小,降低体系黏度,对于这一猜想还需进一步验证。

图4 PS-UT对低盐鸡胸肉糜凝胶表观黏度的影响Fig. 4 Effect of polysaccharide combined with ultrasonic treatment on the apparent viscosity of low-salt chicken breast meat gel
2.5 PS-UT对低盐鸡胸肉糜凝胶水分分布特性的影响
为进一步探究PS-UT对低盐鸡胸肉糜凝胶水分分布的影响,对各处理组凝胶进行低场核磁共振测定。低场核磁共振波谱基于对横向水质子弛豫时间的测量,并已被用于检测食品在冷冻贮存或加工过程中发生的性质变化[47]。根据图5可以看出,各组均得到3 个明显的峰,分别为T2b(1~21 ms)、T21(100~230 ms)和T22(1 800~2 900 ms)。其中,T2b代表结合水,代表与蛋白紧密结合的水分;T21代表不易流动水,对应存留在凝胶结构内部的水;T22代表自由水,表现出很高的流动性,对应于蒸煮损失的水分[31]。Han Minyi等[31]也在研究中得到相似的水分分布图。

图5 PS-UT对低盐鸡胸肉糜凝胶不同组分水分弛豫时间的影响Fig. 5 Effect of polysaccharide combined with ultrasonic treatment on the relaxation time of water protons in low-salt chicken breast meat gel
由表2可知,低盐肉糜凝胶中65%以上的水分为不易流动水,其次为自由水,结合水含量最少。CON组自由水相对含量最高,但在经过UT后由32.80%减少到20.99%(P<0.05),结合水未出现明显变化。与CON组相比,添加GG可以显著降低自由水含量(P<0.05),并在协同UT后进一步降低,这些结果均与蒸煮损失率变化趋势一致。添加CH后P22为所有组别中最低,仅3.35%,但在协同UT后却显著增加至11.05%(P<0.05),P21则由92.22%下降至87.57%。由图5可以看出,低盐肉糜凝胶大部分水分的弛豫时间集中在低于200 ms的范围。对于CON组,UT并没有使其弛豫时间发生改变。与CON组相比,添加GG后T21峰变宽并向右延长,而T22峰并没有发生移动,在协同UT后其弛豫时间未发生改变;添加CH不会影响其弛豫时间,但在协同UT后其峰弛豫时间均向左迁移。

表2 PS-UT对低盐鸡胸肉糜凝胶不同组分水分弛豫时间峰面积百分比的影响Table2 Effect of polysaccharide combined with ultrasonic treatment on the area percentages of relaxation time peaks of water protons inlow-salt chicken meat gel
峰顶点向更低弛豫时间迁移时代表水分流动性减弱,峰变宽则代表的成分的复杂化[48]。相比于CON组,UT通过其空化作用明显改变了低盐鸡胸肉糜凝胶中水分分布,但并未影响水分与蛋白的结合程度,这与Zhang Ziye等[23]的研究结果一致。GG有良好的保水性能,将更多水分留存在了凝胶内部。GG组T21峰变宽说明P21中的水分成分变复杂,即除存留在凝胶网络中的水分外,还包含GG分子膨胀吸收的水分,使P21显著增加。且水分-GG结合程度低于水分-蛋白结合程度,因此T21弛豫时间延长。费立天将0.1%~0.5%的GG添加到MP凝胶中同样发现,随着GG添加量增加,凝胶的T21延迟[18]。CH组及CH-UT组核磁共振氢谱结果与蒸煮损失率结果无法形成对照。Zhou Yanzi等[36]通过对比3 种离子性多糖同样发现CH组有较高的P21和较低的保水性。实验中观察发现,不同于其他组别,CH及CH-UT组肉糜凝胶从离心管中取出后,部分水分以缓慢渗出形式流失(“渗出水”),在一定时间后达到平衡状态。因此猜测,在进行核磁共振氢谱测试时,由于未从核磁管中取出肉糜凝胶,CH组低盐肉糜凝胶中“渗出水”仍存留在凝胶体系内部,因此表现为不易流动水。协同UT增强了CH与蛋白之间的交联程度,增加凝胶网络矩阵的网络密度,一方面,由于凝胶网络密度增加,容留水分的空隙部分减小,使“渗出水”转化为自由水,表现为P22显著增加;另一方面,UT能够使得网络结构分布更加均匀,增加了网络结构毛细管作用力,增加了水分结合程度,表现为T21和T22降低,蒸煮损失率降低。
2.6 PS-UT对低盐鸡胸肉糜凝胶微观结构的影响
为了进一步探究PS-UT对低盐鸡胸肉糜凝胶微观结构的影响,通过扫描电子显微镜观察各处理组微观结构。如图6所示,CON组的凝胶结构疏松,存在较大孔隙,且有明显的蛋白聚集体。UT后结构相对更为紧凑均一,但仍存在部分孔隙。与CON组相比,添加GG后孔隙无明显改善,有较为明显的颗粒,有组分不均匀现象。协同UT可以明显改善其均一性,且结构更为致密,孔隙几乎消失。与CON组相比,添加CH后纤丝状交联结构增加,疏松多孔。协同UT可使纤丝状交联转变为团簇状,孔隙缩小,结构更为紧实。

图6 PS-UT对低盐鸡胸肉糜凝胶微观结构的影响Fig. 6 Effect of polysaccharide combined with ultrasonic treatment on the microstructure of low-salt chicken breast meat gel
在肉糜体系中,MP在溶胀过程中会吸附大量的水分,但加热后变性导致吸附的水分渗出,转变成自由水,在流失过程中形成大量水通路[49],因此CON组大量的孔隙可能是由于水分流失形成的通路。高强度超声波会造成蛋白的破裂和机械损伤,并分解水分子产生自由基,从而减小颗粒粒径,并通过声空化作用改变蛋白聚集[50]。UT组获得更为均匀的结构,但由于低盐环境盐溶性蛋白溶出量不足,孔隙仍然清晰可见。Li Ke等[27]认为,UT使MP分子粒径减小,暴露出更多基团,加强了相互交联从而改善凝胶品质。GG可以通过吸附蛋白变性过程中渗出的水分来降低蒸煮损失率,使水分流失形成的孔隙大量减少,并吸水膨胀压缩凝胶网络使其更为致密。协同UT可促进GG均匀分散在凝胶网络中,孔隙几乎消失,获得更低的蒸煮损失率和更高的硬度。CH为阳离子多糖,在pH 6.0的环境下,MP带负电,因此CH与肉糜蛋白之间可能发生了一定程度的相互交联,但较为杂乱,不利于水分保持。Zhou Yanzi等[36]同样在GG-肌球蛋白凝胶中发现更大腔体和更严重的相分离。CH-UT可使交联增加,形成井然有序、致密均一的凝胶网络结构,从而有利于提高硬度,降低蒸煮损失率。相关研究也证明CH-盐溶性蛋白凝胶可通过静电相互作用和氢键改善复合凝胶的质构特性、保水性和微观结构[14]。
3 结 论
与CON相比,本研究中GG-UT和CH-UT可以显著提高低盐鸡胸肉糜热诱导凝胶的硬度(P<0.05),显著降低蒸煮损失率,提高储能模量G’。添加GG会提高凝胶白度,增加体系表观黏度,使更多自由水转化为不易流动水,减少微观结构中的孔隙,并在加热过程中填充至肉糜凝胶网络改善其凝胶品质。添加CH会降低凝胶白度,降低体系表观黏度,使水分流动性减弱,微观结构显示其与蛋白质发生交联改善凝胶品质。PS-UT可进一步降低凝胶蒸煮损失率,提升硬度。研究表明PS-UT是一种有效提升低盐鸡胸肉糜凝胶品质的方法,研究结果能够为低盐健康鸡肉制品的开发提供参考。

