不同新型冠状病毒核酸检测试剂(荧光PCR法)的选择和临床应用
沈默 周武 梁敏 王忠永
随着对新型冠状病毒肺炎(corona virus disease 2019,COVID-19)的不断了解,人们对于新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)核酸检测的认识也逐步深入。实时荧光PCR检测SARS-CoV-2核酸阳性是COVID-19确诊患者的主要诊断标准之一[1-3]。但在临床实际应用中,核酸检测“假阴性”的质疑也使核酸检测试剂盒的质量和性能备受关注。核酸检测容易受到各种因素,如病程、实验方法学、人员因素、采样、运送及保存及病毒本身变异等影响,检测试剂性能也是重要的影响因素之一[4]。本研究对早期取得注册证并已在临床使用的几种荧光PCR法SARS-CoV-2核酸检测试剂进行性能比较,发现不同品牌试剂间存在一定差异,提示临床诊疗过程中需对试剂性能差异造成的结果不同引起高度重视,实验室应加强对不同品牌、不同批号试剂的评估,选择适宜的检测方案,以利于SARSCoV-2核酸检测结果更好地应用于临床。
1 材料和方法
1.1 材料 收集2020年1月24日至3月20日温州医科大学附属第一医院检测样本共3 284例,以咽拭子和粪便标本为主,阳性样本数180例,阳性率为5.48%。利用1例隔离病房确诊COVID-19患者采集的咽拭子阳性标本提取的RNA模板,对市场上华大生物科技(武汉)有限公司(批号:6020200209)、上海之江生物科技有限公司(批号:P20200205)、上海伯杰医疗科技有限公司(批号:20200202A)、上海捷诺生物科技有限公司(批号:COV2020008)4种不同品牌试剂(分别为A、B、C、D试剂)进行评价分析。以选用C试剂为主,A试剂作为复检备用试剂的检测方案在国家卫生健康委员会临床检验中心的12个室间质评样本检测中的应用进行分析。
1.2 方法
1.2.1 仪器与试剂 EX3600全自动核酸提取仪、MVR01核酸提取试剂(上海之江生物技术有限公司);ABI 7500荧光定量PCR仪(美国ABI公司),4种不同品牌的SARS-CoV-2核酸检测试剂盒均为国家药品监督管理局审批通过的荧光PCR法检测试剂;病毒采样管(友康恒业生物科技有限公司,型号MT0301-1)。
1.2.2 检测方法
1.2.2.1 标本采样 用病毒采样管中拭子适度用力拭抹咽后壁部位,应避免触及舌部;迅速将无菌拭子放入采集管中,在靠近顶端处折断无菌拭子杆,旋紧管盖封闭[5]。
1.2.2.2 核酸提取 核酸提取严格按照试剂说明书操作。提取试剂货号:Z-ME-0044,型号:MVR01,批号:P20200104。本研究主要评估核酸扩增试剂的性能,故统一采用上海之江生物科技股份有限公司的自动提取仪器和提取试剂进行核酸提取,利用提取后的核酸模板进行平行试验验证。
1.2.2.3 标本稀释 确诊患者标本核酸模板采用DEPC 水进行 1×、10×、100×、1 000×、10 000×的梯度稀释(各稀释度样本分别用a~e表示),备用。
1.2.2.4 核酸扩增 根据不同品牌试剂说明书,在ABI 7500荧光定量PCR仪设置相应反应程序后扩增检测。不同试剂检测目的基因靶标不同(包括了ORF1ab/RdRp、N和E基因),评估的4种试剂中1种试剂检测单靶标,2种试剂检测双靶标,1种试剂检测三靶标;3种试剂含内标。扩增体系中模板加样量1种试剂为10 μl,其余均为5 μl。最低检测限1种试剂为100 copies/ml,1 种试剂为 500 copies/ml,2 种试剂为1 000 copies/ml。阳性判读标准参考各试剂说明书。质量控制:每批试验均带阴性和阳性对照,阴性和阳性对照检测结果在控,则该批次试验有效,反之无效。所有检测均进行3次重复,取平均循环阈值(cycling threshold,Ct)进行计算。
1.3 国家卫生健康委员会临床检验中心室间质评标本检测 使用本实验室常规配套使用的两种检测试剂(C+A)对2020年3月下发的编号为202001-202012的12个样本进行检测,样本提取方法见1.2.2.2,检测过程完全按照C试剂和A试剂的说明书进行。
1.4 统计学处理 采用SPSS 23.0统计软件。对SARS-CoV-2 ORF1ab/RdRp基因的A~D试剂扩增组Ct值比较采用随机区组设计的秩和检验。不同品牌试剂的批内重复性用变异系数(CV)表示。P<0.05为差异有统计学意义。
2 结果
2.1 4种试剂重复检测结果比较 4种试剂的基本情况见表1。4种试剂目标靶基因ORF1ab/RdRp的重复检测结果Ct值见表2。SARS-CoV-2 ORF1ab/RdRp基因的A~D试剂扩增组Ct值比较差异有统计学意义(P<0.001)。进一步进行两两比较,除了B试剂与D试剂差异无统计学意义(P>0.05),其余试剂两两比较差异均有统计学意义(均P<0.05)。按照4种品牌试剂说明书的阳性判断标准,A试剂5个稀释度标本检测结果均为阳性,其余试剂1×、10×、100×稀释度检出阳性结果,低浓度RNA模板标本检测结果均为阴性,见表3。

表1 4种品牌试剂基本情况表
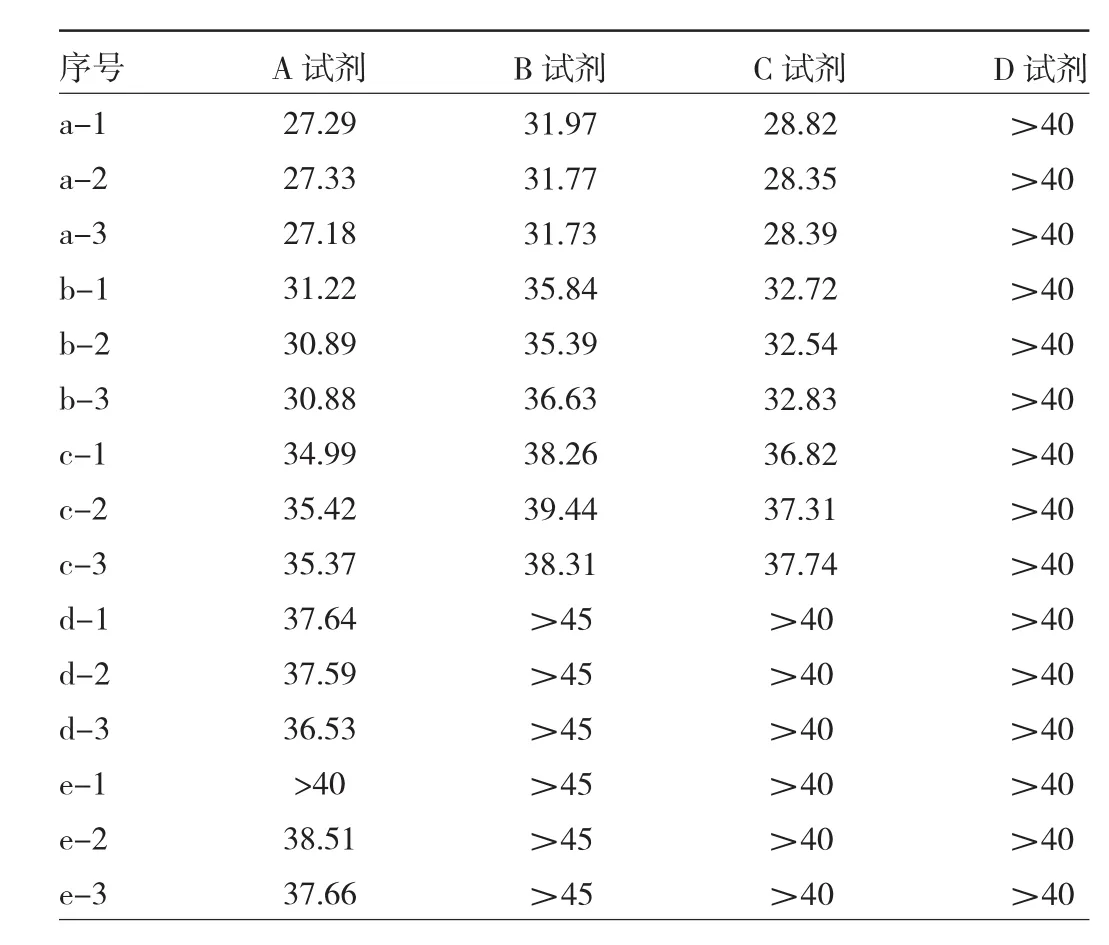
表2 不同品牌试剂重复检测结果(ORF1ab/RdRp基因)Ct值
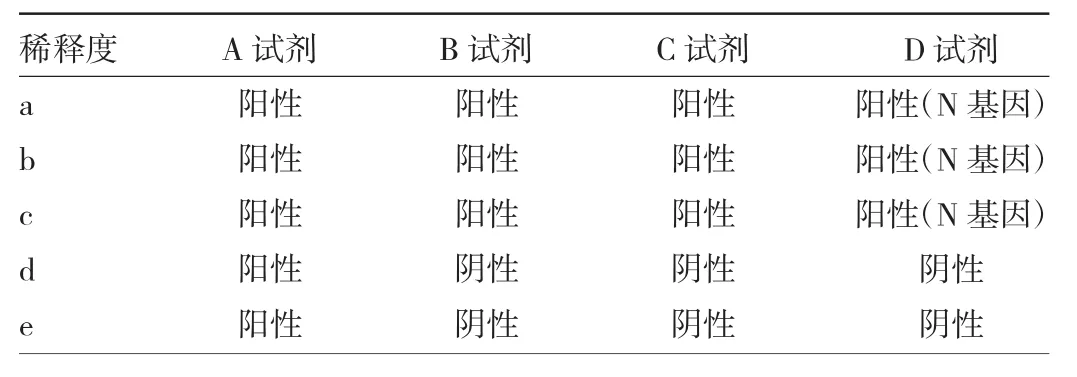
表3 不同稀释度标本用4种品牌试剂检测的结果
2.2 4种品牌试剂灵敏度比较 各选取每个稀释度中1次ORF1ab/RdRp基因扩增曲线,检测结果见图1。其中A试剂5个稀释度均呈现阳性扩增(最后一个稀释度3次重复试验出现2次阳性扩增),B和C试剂有3个稀释度呈现阳性扩增,后2个稀释度为阴性,D试剂ORF1ab/RdRp基因5个稀释度均无阳性扩增(该试剂N基因3个稀释度有阳性扩增)。结果显示A试剂灵敏度最高,B、C灵敏度类似,D试剂ORF1ab/RdRp基因检出存在较大问题,未见阳性扩增曲线。通过4种品牌试剂的ORF1ab/RdRp基因Ct值比较,A试剂比C试剂提早1~2个循环,C试剂比B试剂提早1~3个循环。
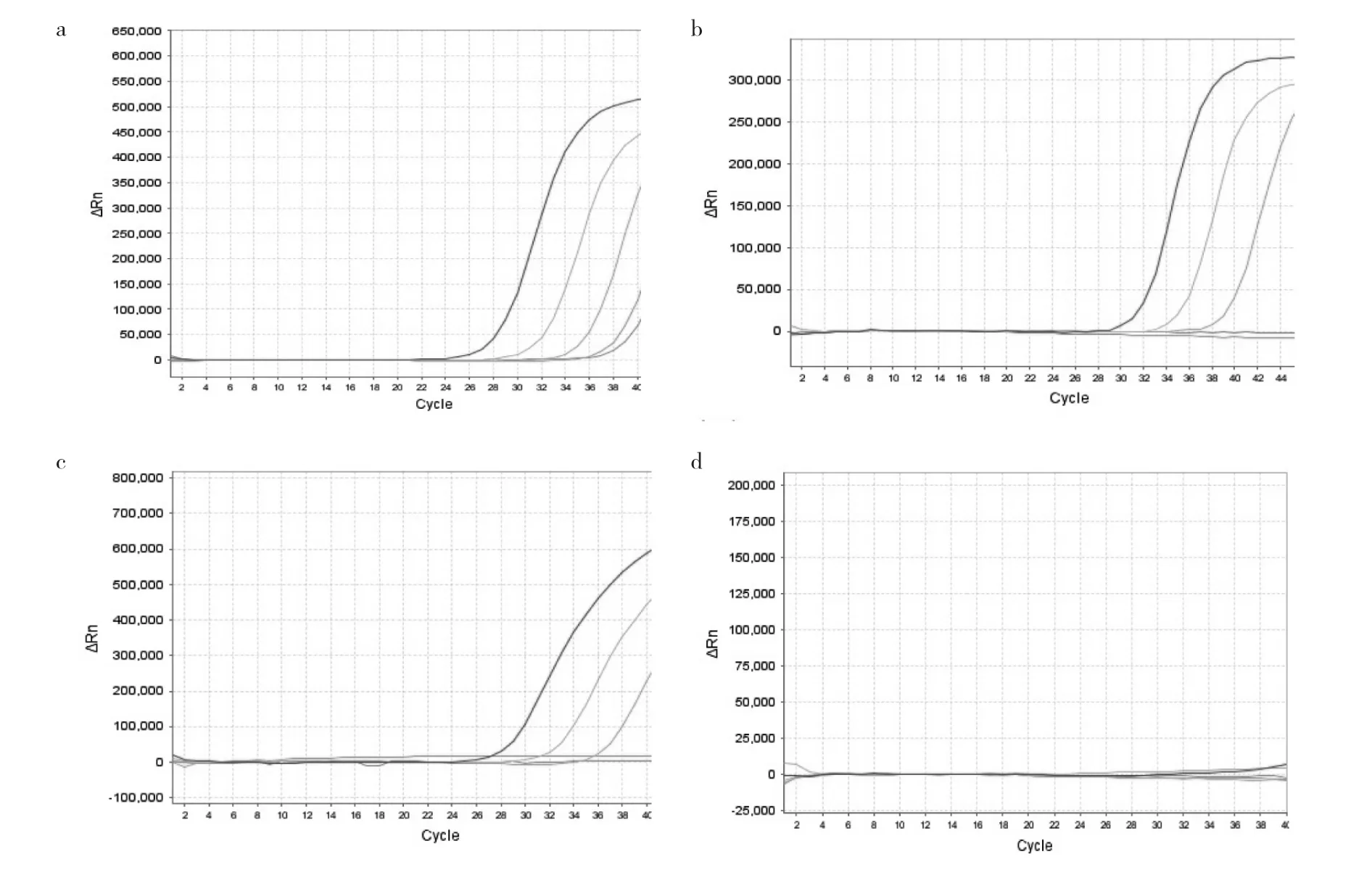
图1 4种品牌试剂ORF1ab/RdRp基因5个稀释度扩增的曲线图(a:A试剂;b:B试剂;c:C试剂;d:D试剂)
2.3 重复性试验 4种品牌试剂每个稀释度重复检测3次,ORF1ab/RdRp基因(D试剂采用N基因)扩增重复性见图2,A试剂重复性最好,C试剂次之。不同品牌试剂重复检测结果的Ct值变化CV见表4。
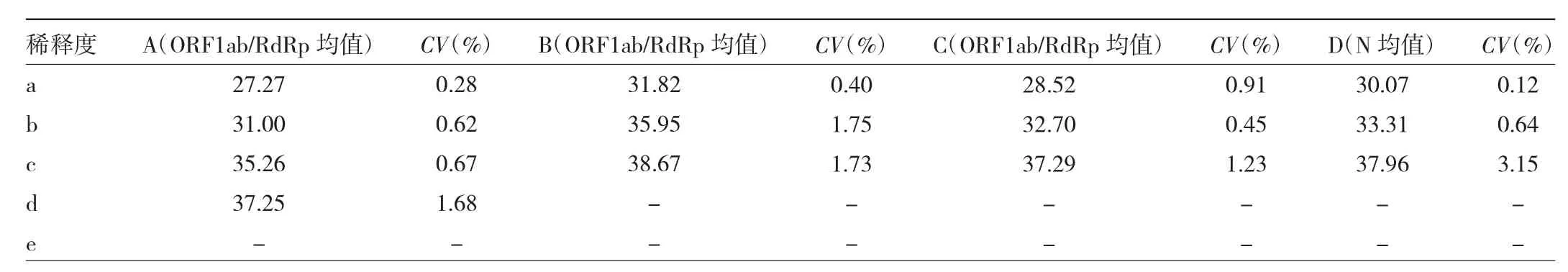
表4 4种品牌试剂ORF1ab/RdRp基因Ct均值和重复检测结果的CV
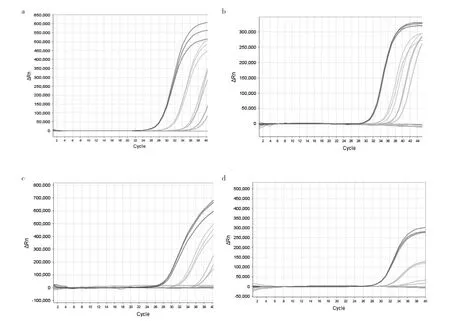
图2 4种品牌试剂ORF1ab/RdRp基因不同稀释度重复性试验扩增曲线图(a:A试剂;b:B试剂;c:C试剂;d:D试剂N基因)
2.4 A、B、C 3种品牌试剂除ORF1ab/RdRp基因外,D试剂除N基因外其他靶标基因检出情况 A试剂为单标靶,无其他靶标基因;B试剂为三标靶,其N基因与E基因的检测曲线见图3;C试剂为双标靶,其N基因检出见图3;D试剂为双靶标,其除N基因外的ORF1ab/RdRp基因所有稀释度标本中均无扩增。B试剂的E基因和C试剂的N基因扩增曲线要优于B试剂的N基因扩增,见图3。

图3 B、C两种品牌试剂其他靶标基因扩增曲线图(a:B试剂N基因;b:B试剂E基因;c:C试剂N基因)
2.5 国家卫生健康委员会临床检验中心室间质评标本的检测结果 C试剂为主要检测试剂,A试剂作为复检备用试剂,检测结果见表5。

表5 C试剂和A试剂检测国家卫生健康委员会临床检验中心室间质评标本结果
3 讨论
COVID-19疫情属于突发公共卫生事件,传播迅速且广泛,给人民的生命健康带来了极大的威胁,这使得SARS-CoV-2短时间内成为全球关注的焦点。2020年1月7日,研究人员从1例武汉患者体内成功分离出病毒并进行了全基因组测序[6-7],疫情形势严峻的特殊情况下,各厂家在较短时间内完成了核酸检测试剂盒的研发,不可否认,核酸检测试剂盒应用于临床给COVID-19的诊疗提供了强有力的支持,但短时期内多种试剂通过应急审批上市,各核酸检测试剂的质量和性能参数可能并不尽如意,而且在应用过程中试剂也在不断更新和优化,导致部分品牌试剂存在较大的批次间差异,临床使用过程中发现,部分试剂不同批次间的差异甚至非常之大。本研究仅针对各品牌试剂的某一个批号试剂进行评估,对不同批号试剂可能存在的性能差异未进行研究,但根据实验室工作经验,仍提醒实验室人员在进行SARS-CoV-2核酸检测时务必关注试剂批号变更可能带来的检测结果误差,应按规定做相应的性能验证,以满足实验室检测的要求[8]。
本研究比较了4种品牌试剂对同一例COVID-19患者咽拭子标本提取的核酸模板不同稀释度样本的检测结果,研究发现,不同品牌试剂检测ORF1ab/RdRp基因的结果 Ct值存在差异;4种试剂检测ORF1ab/RdRp基因的灵敏度也不同;A试剂批内重复检测结果优于其他3种试剂。基于以上研究结果,不同品牌试剂之间检测能力存在明显差异,4种试剂的灵敏度、重复性均存在一定差别,究其原因,存在以下几种可能:(1)与试剂的引物、探针设计有关;(2)与引物、探针的稳定性有关;(3)不同试剂的不同靶标基因检测能力存在一定的差异。相对而言,高浓度核酸模板不同试剂检测定性结果一致性较好,随着核酸模板稀释度加大,不同试剂检测结果不一致,试剂盒的最低检测限如果不能满足低浓度样本的检测,可能会导致假阴性结果[9]。虽然目前SARS-CoV-2荧光PCR试剂均为定性试剂,且各厂家均在试剂说明书中列出了各自的最低检测限,但由于临床实验室很难做到采用定量标准物质评估其灵敏度,故采用梯度稀释方法对不同品牌的试剂进行相对比较仍不失为一个简单有效的评估方法。4种SARS-CoV-2核酸扩增检测试剂的检测能力有差异,尤其对于弱阳性标本的检测差异明显,部分试剂的准确性、灵敏度及重复性欠佳,亟需进一步优化,提高其性能,以便更好地适应临床筛查的需求,减少假阴性结果的出现。
基于对不同品牌试剂的评估,结合试剂本身的特性和临床需求,本研究采用C试剂作为主要检测试剂,A试剂作为复检备用试剂的SARS-CoV-2核酸检测方案。采用该方案检测国家卫生健康委员会临床检验中心室间质评标本,结果全部符合预期结果。国家卫生健康委员会临床检验中心发布的《全国新型冠状病毒核酸检测室间质量评价结果报告》对除202003和202009外的10个样本进行了统计,公布的样本信息显示:样本 202001、202005、202006、202007、202012 不含SARS-CoV-2核酸,预期结果应该为阴性,本研究选用的两种试剂检测结果与预期结果完全一致,其中样本2020001含有SARS,2020012含MERS和OC43等其他冠状病毒成分,C试剂和A试剂均未检出阳性结果,选用试剂的特异性符合要求;202002、202004、202008、202010、202011均为SARS-CoV-2阳性样本,核酸浓度分别为 640、3.2×103、1.6×104、128、8.0×104copies/ml,按照说明书标明的阳性判断标准,C试剂检测样本202002 和 202004(浓度为 640 和 3.2×103copies/ml)出现了假阴性结果,A试剂复检得出阳性结果,保证了低浓度检测结果的准确性。样本202010由于核酸浓度只有128 copies/ml,两种试剂均未检出阳性结果,国家卫生健康委员会临床检验中心的评价原则500 copies/ml以上的样本要求检出,因此该标本的阴性结果不作为假阴性判定,统计结果也显示,该样本的总体符合率只有0.6%(931份结果中6份阳性)。样本2020028和202011两种试剂均检测阳性结果,与预期结果符合。A试剂作为复检试剂,对C试剂起到一定的补充作用,能够大大减少低浓度样本的漏检率,减少假阴性结果的出现。两种试剂组合的临床应用基本满足需求。
本研究仅针对部分品牌的某一批号试剂性能进行简单评估,并不一定能全面反映试剂性能。另外,本研究仅针对SARS-CoV-2核酸扩增试剂进行比较,未对不同试剂间的提取方法和效率进行评估。作为疫情下最为重要和常用的实验室判断手段,荧光PCR病毒核酸检测具有极其重要的作用,实验室人员应重视不同试剂间的性能差异,选用高性价比试剂。实验室在充分评估试剂性能的基础上,在临床实际应用中最好在常规使用试剂的基础上准备1~2种备用试剂,作为对与临床或影像学特征不符的可疑结果的补充验证试剂,以避免出现假阴性或假阳性结果。

