通过生物信息学分析筛选影响胃腺癌患者预后的铁死亡相关基因*
黄 玉,邹燕梅,孙 伟,彭 平,张 鹏,周 磊
华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030
胃癌是全世界常见的恶性肿瘤之一,在2018年有超过100万新发病例,同时估计有78.3万死亡病例。胃癌是世界上第5大常被诊断的癌症和第3大癌症死亡原因,男性发病率是女性的2倍[1]。目前我国胃癌患者的5年生存率低,胃癌预防和治疗工作责任重大,应用科学的方法和标准,对该疾病进行及时的诊断、合理治疗、有效预测预后都非常重要[2-3]。
非凋亡形式的细胞死亡可能促进某些肿瘤细胞的选择性清除或在特定的病理状态下被激活。铁死亡是一种新型的、以细胞内活性氧堆积为特征的、铁依赖性的非凋亡形式死亡,与细胞凋亡、经典坏死、自噬和其他形式的细胞死亡不同[4]。铁死亡(ferroptosis)最早是由Stockwell实验室在2012年首次提出的,他描述了一种由小分子erastin或RSL3引起的独特的细胞死亡。铁死亡有别于其他已知的程序性死亡方式,具有独特的形态学和生物能量特征[5]。铁死亡的特点和功能涉及到生物体的各个方面,包括机体的功能和各种疾病状态,例如癌症等。有大量的研究表明,铁死亡在癌症治疗中有着多种前景。目前,一系列小分子已被发现能够在多种的癌细胞中诱导铁死亡。这些发现提供了通过基因或药物干预铁死亡进行癌症治疗的可能性,这在科学研究和临床医学上都具有重要意义。不同种类的癌症对铁死亡似乎有不同的敏感性。
在本研究中我们探讨了铁死亡相关基因(ferroptosis related genes,FRGs)与胃腺癌患者预后之间的关系。我们使用TCGA数据库下载了基因表达数据和临床数据,发现14个与预后密切相关的基因,并使用其中8个基因建立了风险模型,为研究胃腺癌的发生机制以及预后提供了线索。
1 材料与方法
1.1 数据采集和分析
使用癌症基因组图谱计划(The Cancer Genome Atlas,TCGA)(https://cancergenome.nih.gov/)数据库下载RNA测序数据,共有443例患者临床信息,407个数据集。FRGs从FerrDb数据库(http://www.zhounan.org/ferrdb)下载得到,包括铁死亡启动基因、抑制基因和标志物。将铁死亡相关蛋白基因集与表达谱基因集取交集,得到铁死亡相关蛋白表达数据集。通过R语言,使用limma包,将肿瘤组织表达谱与正常组织表达谱进行非参数检验,设定条件为错误发现率(false discovery rate,FDR)小于0.05,得到在胃腺癌中差异表达的FRGs。将FRGs与患者的生存时间和生存状态整合,使用survival包,得到与生存预后相关的FRGs。使用venn包取差异表达的FRGs和生存预后相关的FRGs的交集,得到影响胃癌预后的FRGs。使用pheatmap包,绘制差异表达的预后FRGs热图。使用survival包绘制差异表达的预后FRGs的森林图。通过在线蛋白互作网络(protein protein interaction network,PPI)工具(https://string-db.org/)研究蛋白之间的互作关系。计算蛋白质表达相关性并使用igraph包绘制蛋白质互作网络图,显示蛋白之间的表达关联。
1.2 风险模型的构建以及验证
使用glmnet包构建LASSO比例风险回归模型得到相关基因风险系数,将患者分为高风险组和低风险组。使用survival和survminer包比较高、低风险组的生存差异,使用timeROC包得到时间依赖的受试者工作特征曲线(receiver operator characteristic curve,ROC)。使用pheatmap得到患者的风险值热图。使用survival包进行单因素和多因素独立预后分析。
1.3 数据成分分析
使用Rtsne包进行主成分分析(principal component analysis,PCA)和T分布随机近邻嵌入(t-distributed stochastic neighbor embedding,tSNE)分析,使用ggplot包进行图形绘制。使用enrichplot进行基因本体(gene oncology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,使用ggplot包进行图形绘制。
1.4 统计学方法
数据分析使用了R语言4.0.3版本,以R Studio软件包进行统计分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 数据收集和分析
使用TCGA数据库下载数据,共有443例患者临床信息,407个数据集,通过分析得到25个预后相关的FRGs。25个预后相关的FRGs与163个差异基因取交集,得到14个影响胃癌预后的FRGs,包括NOX4、NOX5、GLS2、GABARAPL1、CDO1、MYB、TGFBR1、DUSP1、TSC22D3、SLC1A4、NNMT、NF2、ZFP36和CAV1(图1A)。依据上述14个基因表达绘制基因热图(图1B),同时上述基因的风险比率(Hazard Ratio,HR)以及95%的置信区间见表1。

A:预后相关的FRGs与差异FRGs取交集;B:影响胃癌预后的FRGs热图图1 数据采集分析Fig.1 Data collection and analysis

表1 影响胃癌预后的14个FRGsTable 1 14 FRGs related to the prognosis of gastric cancer
2.2 蛋白质相互作用分析
通过PPI蛋白质互作网络,发现NNMT、CAV1、NOX4、DUSP1、ZFP36、TSC22D3和TGFBR1基因可能有相关性(图2A)。通过基因表达相关性分析表明CDO1、TGFBR1、NOX4、DUSP1、ZFP36、TSC22D3、NNMT和GABARAPL1基因表达呈正相关,MYB与多个基因表达呈负相关(图2B)。
2.3 风险模型的构建以及验证
使用LASSO回归分析构建风险模型,最终筛选出8个基因来构建风险模型,风险模型计算公式为:风险值=NOX4×0.41+NOX5×1.14-GLS2×0.22-MYB×0.022+TGFBR1×0.053+DUSP1×0.092-SLC1A4×0.12-NF2×0.27。
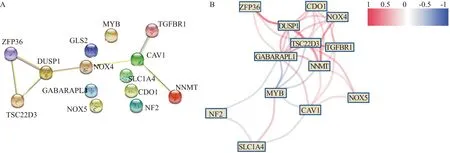
A:蛋白质相互作用网络图;B:基因表达相关性分析网络图,红色代表正相关,蓝色代表负相关图2 蛋白质互作网络分析Fig.2 Protein interaction network analysis
依据患者的风险值,以中位数为临界点,将患者分为高、低风险组,再通过生存分析比较患者的时间依赖的总生存率,发现高风险组患者的生存率显著低于低风险组(图3A)。由于生存曲线有交叉,可以认为对于HR的计算,logrank检验前提比例风险假定(proportional hazard assumption,PH)不满足,因此HR值不可信。我们检验了另外一个指标,限制性平均生存时间差(restricted mean survival time,RMST)。通过计算6年的随访期间曲线下面积差,显示高风险组患者预估生存时间为2.85年,而低风险组预估生存时间为3.56年,两者相差0.74年(95%CI:0.03~1.44),提示高风险组患者生存时间较短。通过R包绘制多重时间依赖性的ROC曲线,发现患者5年生存率的ROC曲线下面积为0.668,说明我们的风险模型较为可靠(图3B)。依据患者的分组以及风险值,绘制风险值热图(图3C)以及患者的生存状态(图3D)。最后再进行单因素(图3E)和多因素的独立预后分析(图3F),发现年龄、T分期和风险值可以作为独立预后因子。

A:高、低风险组生存预后曲线;B:时间依赖性的ROC曲线;C:高、低风险组的风险值分布;D:高、低风险组的生存状态;E:单因素独立预后分析;F:多因素独立预后分析图3 风险模型的构建以及准确度和敏感度检测Fig.3 Risk model construction and accuracy and sensitivity testing
2.4 可视化分析与FRGs的通路富集分析
为了进一步研究高、低风险组基因分布情况,使用PCA主成分分析和tSNE高维数据可视化分析,表明高风险和低风险组根据风险模型区分较为明显(图4A、4B)。高、低风险组差异基因通过GO分析表明,生物学过程主要集中于细胞外基质组成和细胞外结构构成,细胞组成主要集中于含有胶原蛋白的细胞外基质,分子功能主要集中于细胞外基质结构成分(图4C)。
KEGG分析表明差异基因集中于PI3K-Akt信号通路、cGMP-PKG信号通路和局部粘附信号通路(图4D)。
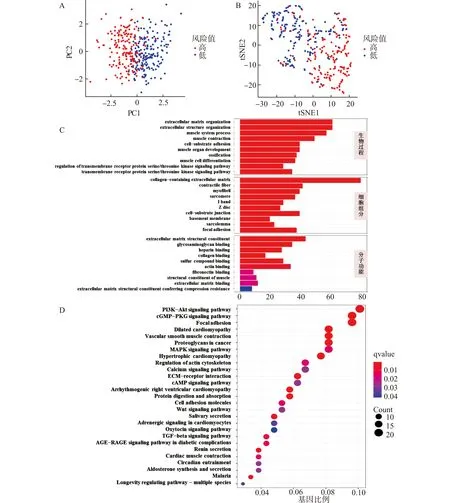
A:PCA主成分分析;B:tSNE分析;C:GO富集分析柱状图;D:KEGG富集分析气泡图图4 数据分布情况分析Fig.4 Data distribution analysis
3 讨论
影响胃癌预后的因素很多,TNM分期是影响胃癌预后和指导治疗策略的主要因素,但是相同分期的患者预后也存在差异[6],因此探索和研究其他胃癌的预后因素亦非常重要。越来越多的证据表明,铁死亡在肿瘤发生和治疗中起着至关重要的作用。在这项研究中,我们通过生物信息学方法来研究胃腺癌与FRGs的表达谱变化。在这些分析的基础上,我们确定了14个与胃癌预后相关的FRGs的特征。我们进一步结合生存时间和生存状态确定8个与预后显著相关的差异表达的FRGs,并构建出可有效预测预后的风险模型。
铁死亡不同于任何形式的程序性死亡,脂质过氧化物积累与铁依赖是铁死亡的两个主要特征。越来越多的证据表明,铁死亡与癌症的发生、发展密切相关[7]。其被发现在多种癌症中存在,包括乳腺癌、肺癌等[8-9],同时铁死亡复合物在不同的肿瘤细胞中具有选择致死性。
铁死亡最开始在RAS突变的细胞中被定义[10]。许多RAS突变的癌细胞对铁死亡诱导敏感。后来的研究逐渐发现,没有RAS突变的细胞对铁死亡诱导也具有敏感性[5]。越来越多的研究将诱导铁死亡应用于肿瘤的治疗中。在传统放疗或者化疗的过程中,加入铁死亡诱导剂能够协同增敏传统治疗的疗效[11]。Roh等[12]在头颈部恶性肿瘤的研究中发现,诱导铁死亡可以克服顺铂的耐药性。Erastin是一种铁死亡诱导剂,有研究发现低剂量的Erastin可以促进2种一线化疗药在HL-60细胞中的抗肿瘤作用[13]。同样,放疗可以诱导癌症患者铁死亡,铁死亡的增加与疗效更好及生存时间更长有关[14]。此外,铁死亡在肿瘤的靶向治疗及免疫治疗中都发挥着重要作用[11]。化疗、放疗、靶向治疗、免疫治疗是胃癌治疗的重要方式,探讨铁死亡在胃癌中的作用具有重要意义。铁死亡在癌症预后中也扮演着重要角色,Tang等[15]的研究显示有11个铁死亡调节基因与胰腺癌的预后相关。Cai等[16]通过分析发现7个铁死亡相关lncRNAs(LINC01503、AC004687.1、AC010973.2、AP001189.3、ARRD-C1-AS1、OIP5-AS1、NCK1-DT)可以预测结肠腺癌的预后。
本研究中,我们发现8个与胃癌预后显著相关的铁死亡基因,包括NOX4、NOX5、GLS2、MYB、TGFBR1、DUSP1、SLC1A4和NF2。NOX4是一个重要的FRGs,在对胶质瘤细胞的研究中显示,土荆皮乙酸(pseudolaric acid B)可以通过激活NOX4信号通路调节铁死亡[17]。GLS2也参与了癌症的铁死亡,在对胃癌的研究中发现miR-103a-3p/GLS2参与了铁死亡过程[18]。在另外一项研究中发现NF2-YAP信号通路参与了铁死亡,该信号通路的突变将有可能预测铁死亡诱导治疗的反应性[19]。
本研究对高、低风险组患者中的差异基因进行GO和KEGG分析,发现差异基因可能与细胞外基质组成和细胞外结构构成、PI3K-Akt等基因通路有关。最近的一项研究也显示,PI3K信号通路激活突变,与癌细胞的铁死亡抵抗有关,而抑制PI3K/AKT/mTOR信号通路使癌症细胞对铁死亡诱导更敏感[20]。基于此,本研究的发现将有助于胃癌的预后及治疗研究。
本研究探讨了FRGs与胃癌预后的关系,筛选出8个与胃癌预后相关的FRGs。同时通过预后预测模型的建立,初步证实了FRGs对胃癌预后的影响。本研究为胃癌的预后评估及探索新的治疗方式提供了新方向。
(2021-04-18 收稿)

