Sphk1在胰腺癌中的临床意义及其对胰腺癌细胞增殖和迁移能力的影响*
杨梦灵,汪 理,李 盛
华中科技大学同济医学院附属协和医院 1中西医结合科 2急诊外科,武汉 430022 3华中科技大学医院,武汉 430074
胰腺癌是恶性程度极高的肿瘤之一,具有起病隐匿,手术切除率低,传统放化疗不敏感等特点,预后极差[1]。其发病机制涉及多个方面,如癌基因激活、抑癌基因失活及DNA修复异常等。随着精准医疗所带来的诊疗方式的变革,靶向治疗成为恶性肿瘤最有前瞻性的治疗手段,但目前仍未研制出针对胰腺癌非常有效的靶向药物。因此,探索胰腺癌发生、发展机制,寻找新的治疗靶点对于提高胰腺癌诊治水平具有重大临床意义。
1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)是具有重要生理功能的一种膜磷脂类代谢产物[2],具有促进细胞的增殖和血管生成,抑制细胞凋亡的作用。而鞘氨醇激酶1(sphingosine kinase1,Sphk1)是调节S1P在体内合成过程的关键限速酶,越来越多的研究表明Sphk1与肿瘤的发生发展密切相关。研究显示:Sphk1在包括胃癌、前列腺癌、乳腺癌、神经胶质瘤等多种肿瘤组织中高表达,且与肿瘤的进展和预后密切相关[3-6];相关研究还发现,使用siRNA和药物抑制Sphk1能够显著抑制卵巢癌、胆管癌等肿瘤细胞的增殖、迁移和血管生成。上述研究表明:Sphk1可能是一种促癌基因,然而Sphk1在胰腺癌中的作用还鲜见报道。
本研究首先通过查找公共数据库信息,利用生物信息学技术分析Sphk1在胰腺癌中的表达差异及其与临床病理参数的相关性,分析其参与肿瘤发展进程的潜在信号通路,及其与肿瘤微环境中免疫细胞浸润的相关性;再通过上调Sphk1基因的表达观察其对人胰腺癌BxPC-3细胞的增殖及迁移的影响,验证其与生物信息学分析异同点,评估Sphk1作为胰腺癌治疗靶点的潜在可能,为其参与胰腺癌发生发展中的作用机制提供有价值的佐证。
1 资料与方法
1.1 TCGA数据库
TCGA数据库整合了33种肿瘤类型的基因组、转录组及蛋白质组等多组学数据,本项研究从TCGA数据库(https://tcga-data.nci.nih.gov/tcga/)[7]获取179例胰腺癌患者的RNA-seq数据(HTSeq-FPKM)及相关临床数据。
1.2 GEO数据集
GSE15471[8]和GSE16515[9]数据集均从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)获得,比较Sphk1在胰腺癌组织和癌旁组织中的表达差异。
1.3 Kaplan-Meier Plotter数据库
Kaplan-Meier Plotter(https://kmplot.com/analysis/)[10]数据库包含GEO、EGA和TCGA的表达谱和临床数据,用于生存标志物的预后分析。本研究使用该数据库,在线评估Sphk1基因表达与胰腺癌患者总生存时间和无复发生存时间之间的关系。
1.4 Vioplot
从CIBERSORT(http://cibersort.stanford.edu/)[11]下载白细胞基因签名矩阵(LM22),首先使用CIBERSORT计算方法分析每个胰腺癌样本中22个免疫细胞的浸润比例,然后使用R x64.4.0.0软件及软件包BiocManager和vioplot绘制vioplot,分析及可视化Sphk1转录水平与免疫细胞浸润程度的关系。
1.5 GSEA分析
从Broad研究所网站(http://software.broadinstitute.org/gsea/index.jsp)[12]获得富集分析的HALLMARK、KEGG、GO基因集。采用GSEA软件(V4.0.2)分析胰腺癌患者基因集富集情况,所有NOMP-value<0.01和FDRq-value<0.05的样本认为有统计学意义。
1.6 细胞培养及转染
人胰腺癌细胞株BxPC-3由华中科技大学同济医学院附属协和医院普外科实验室提供。细胞用含10%胎牛血清DMEM培养液(购于美国Thermo Fisher公司)于37°、5%CO2、饱和湿度的培养箱内培养,选择对数生长期的细胞进行实验。将BxPC-3细胞以1.0×105个/mL密度接种于6孔板内,培养24 h后利用Lipofectamine 3000(购于美国Thermo Fisher公司)进行转染,每个孔内加入脂质体3 μL,质粒GV230-Sphk1 2 μg,或对照质粒GV230 2 μg(购于上海吉凯基因公司)。转染72 h后收集细胞进行功能实验及Western blot实验。
1.7 CCK8法及细胞单克隆实验检测肿瘤细胞的增殖能力
取上述各组处于对数生长期的BxPC-3细胞,按4×103个/孔细胞接种于96孔板;每隔24 h测量1次,连续4 d;实验终止前1 h吸弃培养液,每孔加入100 μL DMEM及10 μL CCK8(购于美国GlpBio公司),1 h后于酶标仪上读取吸光度值,检测波长为450 nm;以细胞生长时间为横轴,实验组与空白对照组吸光度差值与第1天的吸光度值的比值为纵轴绘制各组细胞的生长曲线;取各组处于对数生长期的BxPC-3细胞,按1×103个/孔细胞接种于6孔板,第4天开始换液,10 d吸弃培养液,利用多聚甲醛固定细胞20 min,弃多聚甲醛后再使用结晶紫染液染色20 min,洗净结晶紫后风干,计算克隆数目。
1.8 Transwell实验检测肿瘤细胞的侵袭能力
取经处理后的对数生长期的BxPC-3细胞,用200 μL无血清培养液进行重悬,以6×104个/孔种于上室,下室加入700 μL含30%血清的DMEM培养液,培养箱放置20 h后取出小室(购于美国Corning公司),使用多聚甲醛(购于武汉谷歌生物)固定20 min,弃多聚甲醛后再使用结晶紫染液(购于武汉谷歌生物)染色20 min,流水洗净结晶紫,用棉签擦拭上室细胞,风干小室后置于载玻片,显微镜下进行拍照,对穿透膜的细胞进行计数。
1.9 Western blot检测
用RIPA、PMSF、磷酸化蛋白酶抑制剂A、磷酸化蛋白酶抑制剂B(均购于武汉谷歌生物)按照100∶1∶1∶1的比例配置蛋白裂解液,提取BxPC-3细胞总蛋白,BCA法测定蛋白质浓度。配置10%分离胶、4%浓缩胶,以80 mV恒压进行电泳,以270 mA恒流转膜;含5%脱脂奶粉的TBST配置成封闭液,室温摇床封闭1 h,TBST洗3次,每次10 min,4 ℃过夜孵育一抗(Sphk1,购于武汉三鹰公司,1∶500稀释;GAPDH,购于武汉三鹰公司,1∶2000稀释),孵育完毕使用TBST洗膜,共3次,每次10 min;室温下摇床孵育二抗1 h,孵育完毕后洗膜,TBST洗3遍,每次10 min;ECL化学发光显影(购于武汉三鹰公司)。
1.10 统计学方法
数据用Graphpad prism 7软件及R语言进行统计学分析,组间均数比较用t检验或者方差分析,以Wilcoxon检验分析免疫浸润组间差异,以P<0.05为差异有统计学意义。
2 结果
2.1 Sphk1 mRNA在胰腺癌组织中的表达
将GEPIA数据库中TCGA数据和GTEx数据库数据进行整合,比较Sphk1基因在胰腺癌组织和正常胰腺组织之间的表达差异,结果显示:Sphk1在胰腺癌组织中表达量高于正常组织(P<0.05,图1A);进一步利用GEO数据库对比分析GSE15471及GSE16515数据集中胰腺癌组织与癌旁组织中Sphk1的表达,结果显示:Sphk1在胰腺癌组织中表达显著高于癌旁组织(图1B、1C)。

A:TCGA-PAAD数据库胰腺癌与正常组织Sphk1表达量差异统计图;B:GSE15471数据库胰腺癌与癌旁组织Sphk1表达统计图;C:GSE16515数据库胰腺癌与癌旁组织Sphk1表达统计图;*P<0.05 **P<0.01图1 胰腺癌组织与正常胰腺及癌旁组织中Sphk1的表达差异Fig.1 Difference of Sphk1 expression between pancreatic adenocarcinoma,normal and adjacent tissues
2.2 Sphk1基因对胰腺癌患者预后的影响
利用Kaplan-Meier Plotter数据库分析Sphk1 mRNA表达量与胰腺癌患者总生存期和无复发生存期之间的关系,结果显示:Sphk1高表达组胰腺癌患者的总生存期和无复发生存期明显低于低表达组[总生存期:图2A,HR=1.91(1.13~3.22),Log-rankP=0.013;无复发生存期:图2B,HR=2.88(1.26~6.58),Log-rankP=0.0086]。结果提示Sphk1可能在胰腺癌的生长过程中起促癌作用。

A:Sphk1表达量与胰腺癌患者总生存期生存曲线;B:Sphk1表达量与胰腺癌患者无复发生存期生存曲线图2 Sphk1 mRNA表达量与胰腺癌预后的关系Fig.2 Relationship between Sphk1 mRNA expression and prognosis of pancreatic adenocarcinoma
2.3 Sphk1基因与胰腺癌患者临床病理参数的相关性
分析TCGA-PAAD的mRNA表达谱及临床数据集,评估Sphk1 mRNA表达量与胰腺癌患者临床病理参数的相关性。结果显示:Sphk1 mRNA表达量与胰腺癌患者年龄、性别无显著相关性(P>0.05)(图3A、3B);随着肿瘤体积增大,Sphk1 mRNA表达量逐渐上升,但T4期Sphk1表达量较T3期降低(图3C);具有淋巴结转移和远处转移的胰腺癌组织中Sphk1表达量高于无淋巴结转移患者,但两者之间差异无统计学意义,不排除样本量差异所致(均P>0.05)(图3D、3E)。Sphk1在分化程度越低的胰腺癌组织中表达量越高,其中,G2期与G3期Sphk1 mRNA表达量明显高于G1期,差异有统计学意义(P<0.05),G4期高于其它3期,但差异无统计学意义(P>0.05),分析原因可能系G4期样本量较少导致(图3F)。临床分期Ⅱ期患者Sphk1表达量明显高于Ⅰ期患者(P<0.05)(图3G)。综上所述,Sphk1基因可能促进胰腺癌的生长、侵袭和转移及恶性转化。
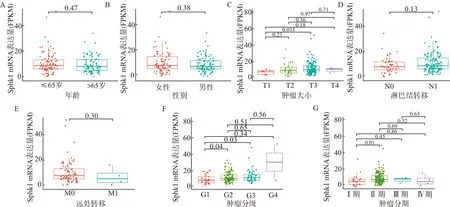
Sphk1 mRNA表达量随:年龄(A)、性别(B)、肿瘤大小(C)、肿瘤淋巴结转移数目(D)、肿瘤远处转移数目(E)、肿瘤病理分级(F)、肿瘤临床分期(G)变化的情况图3 Sphk1 mRNA表达量与胰腺癌患者临床病理参数的相关性Fig.3 Correlation between Sphk1 mRNA epxression and clinicopathological parameters in patients with pancreatic adenocarcinoma
2.4 Sphk1基因表达与胰腺癌组织免疫浸润丰度的关系
利用CIBERSORT数据库分析Sphk1 mRNA表达量与胰腺癌组织中免疫细胞浸润丰度的关系,根据Sphk1 mRNA表达量中位数将患者分为Sphk1 mRNA高表达组和Sphk1 mRNA低表达组。结果显示:Sphk1 mRNA高表达组的滤泡辅助性T细胞、调节性T细胞、未分化巨噬细胞和树突状细胞较低表达组明显升高;静息记忆CD4+T细胞、M1型巨噬细胞、静息态肥大细胞及单核细胞较低表达组明显降低(图4)。上述研究表明Sphk1可能通过影响肿瘤组织周围免疫细胞浸润丰度调控胰腺癌的进展。
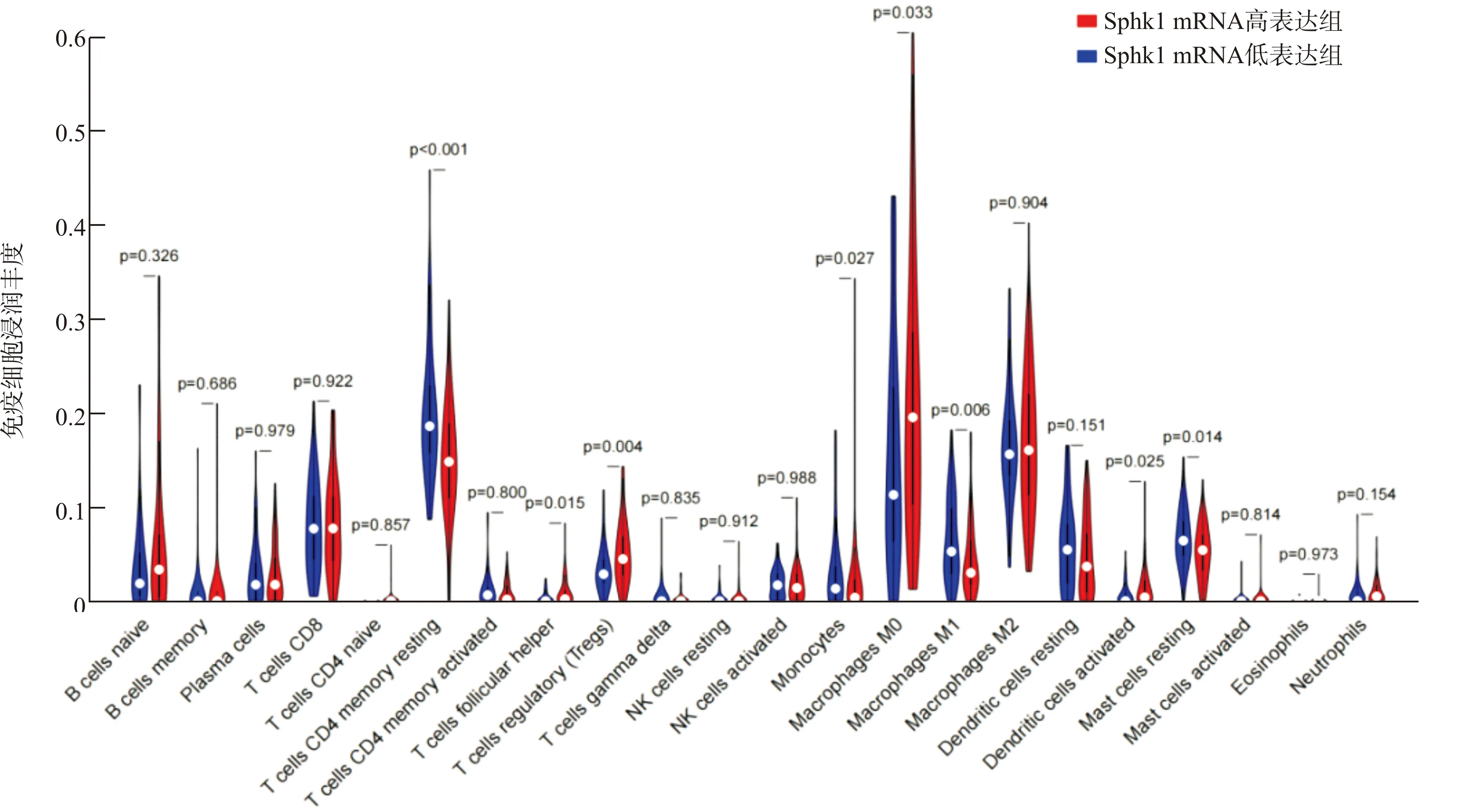
图4 Sphk1 mRNA表达量与胰腺癌组织免疫浸润丰度的关系Fig.4 Relationship between Sphk1 mRNA and abundance of immune infiltration in pancreatic adenocarcinoma
2.5 Sphk1基因通路富集情况
利用GSEA对TCGA-PAAD数据集进行通路富集分析,探讨Sphk1影响胰腺癌进展的潜在机制。我们对Sphk1在HALLMARKES和KEGG数据集富集的所有通路,在GO数据集富集的部分通路进行了总结绘图(所有基因集矫正后NOMP-value<0.01,FDRq-value<0.05)。
结果显示:HALLMARKES中有7个基因集中富集在Sphk1高表达组,其中包括新生血管生成、上皮间质转化、炎症反应、缺氧、NF-κB信号通路等(图5A),无基因集富集在Sphk1低表达组;KEGG有2个基因集富集在高表达组,分别是ECM受体相互作用、糖胺聚糖合成硫酸软骨素途径(图5B),有3个基因集富集在Sphk1低表达组,分别是丁酸甲酯代谢途径、丙酸代谢途径、过氧化物酶体(图5C);GO数据集当中有28个基因集富集在Sphk1高表达组,包括硫酸软骨素蛋白聚糖代谢过程、胶原纤维组织等(图5D),无基因集富集于Sphk1低表达组。

A:高表达Sphk1 mRNA组在HALLMARKES数据集显著富集通路;B:高表达Sphk1 mRNA组在KEGG数据集显著富集通路;C:低表达Sphk1 mRNA组在KEGG数据集显著富集通路;D:高表达Sphk1 mRNA组在GO数据集显著富集通路图5 GSEA富集分析Fig.5 GSEA enrichment analysis
2.6 Sphk1基因可以促进胰腺癌细胞增殖和迁移能力
将Sphk1过表达质粒转染入BxPC-3细胞,构建Sphk1过表达胰腺癌细胞系,并验证转染效果(图6A)。通过CCK8和平板克隆实验检测细胞增殖能力,CCK8结果显示:Sphk1过表达的BxPC-3细胞显示出更强的增殖能力,从第3天开始差异具有统计学意义(均P<0.01,图6B);平板克隆结果显示:Sphk1过表达的BxPC-3细胞克隆数目较对照组增多(P<0.01,图6C)。通过Transwell实验检测细胞的迁移能力。结果显示:Sphk1过表达的BxPC-3细胞迁移数目较对照组增加(P<0.05,图6D)。说明Sphk1基因表达对胰腺癌BxPC-3细胞生长和迁移能力有促进作用。
3 讨论
胰腺癌被称为“癌中之王”,其5年生存率仅10%[1]。在其它肿瘤如肺癌、胃肠道恶性肿瘤、乳腺癌等生存期不断提高,有望把癌症从绝症变成慢性疾病的背景下,胰腺癌治疗效果改善的严重滞后值得我们研究。据权威预测:到2030年,胰腺癌可能成为癌症死亡的第2大病因[13]。本研究创新性运用生物信息学技术通过海量数据库分析,“抽丝剥茧般”探索调控胰腺癌发生、发展可能的分子机制,并在体外人胰腺癌细胞系上加以验证,以期寻找新的治疗靶点,进而提高胰腺癌诊治效果。
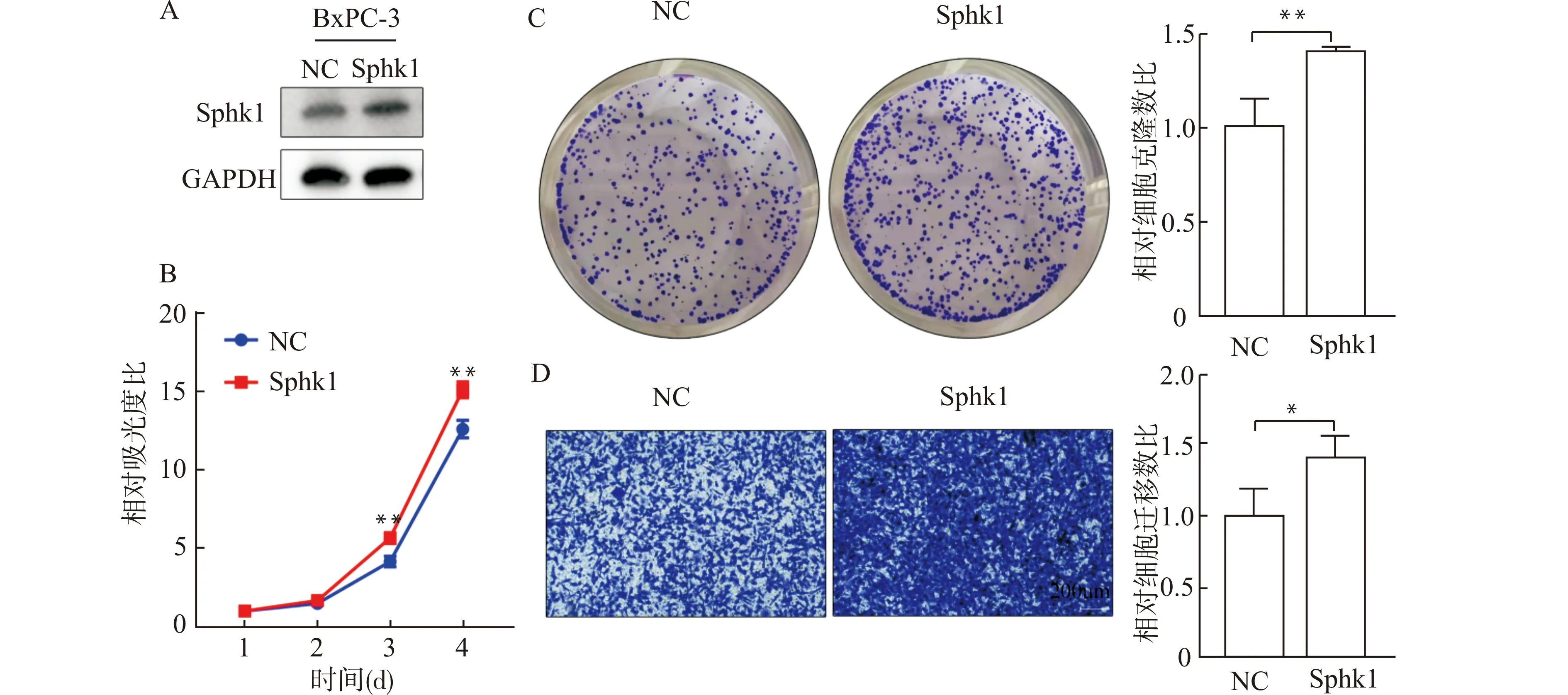
A:BxPC-3细胞过表达Sphk1基因Western blot图;B:CCK8实验统计图;C:平板克隆实验代表图及统计图;D:Transwell实验代表图及统计图;NC:对照组。Sphk1:Sphk过表达组;*P<0.05 **P<0.01图6 过表达Sphk1促进胰腺癌细胞BxPC-3的增殖和迁移能力Fig.6 Overexpression of Sphk1 promoted the proliferation and migration of BxPC-3 pancreatic cancer cells
随着组学技术及生物信息学技术的发展,公共数据库所提供的信息为基础研究提供了便利。本研究利用公共数据库资源及生物信息学技术,对Sphk1在胰腺癌当中扮演的角色进行深入挖掘。研究表明Sphk1在胰腺癌组织中表达量升高,高表达Sphk1胰腺癌患者总生存时间和无病生存期缩短;临床病理参数统计分析亦表明:Sphk1高表达的胰腺癌呈现分化程度低、肿瘤体积大、侵袭转移范围广的特点,且表达高低与患者年龄、性别无显著相关性。上述结果提示胰腺癌中Sphk1基因的过表达可能促进肿瘤的生长、侵袭和转移。为验证Sphk1在胰腺癌中的促癌作用,本研究在体外成功构建过表达Sphk1的人胰腺癌BxPC-3细胞系,结果显示上调Sphk1的表达能够显著促进癌细胞的增殖和迁移。据此我们有理由相信Sphk1的过度表达能够促进胰腺癌的进展,导致其恶性转归——周围组织侵犯和远处转移。
肿瘤细胞所处的微环境影响着肿瘤细胞的生长、转移,在肿瘤的演进中起着重要的作用。胰腺癌的肿瘤微环境主要由基质成分组成,包括肿瘤相关成纤维细胞、细胞外基质和具有免疫抑制特征的免疫细胞,而细胞也是药物传递屏障,是产生耐药的重要原因[14-15]。针对肿瘤免疫微环境的癌症免疫治疗对高免疫原性肿瘤,如肾癌、黑色素瘤及非小细胞肺癌等患者预后产生巨大影响[16-20]。但胰腺癌呈现出的低免疫原性和肿瘤微环境免疫抑制等特点是导致其免疫治疗效果不佳的重要原因[21-22]。因此,迫切需要寻找影响胰腺癌肿瘤免疫微环境的靶点,为开发新的靶向性辅助药物,增强免疫治疗疗效提供强有力手段。TCGA数据显示,Sphk1高转录水平组的滤泡辅助性T细胞、调节性T细胞、未分化巨噬细胞和树突状细胞较低表达组明显升高;而静息记忆CD4+T细胞、M1型巨噬细胞、静息态肥大细胞及单核细胞较低表达组明显降低。上述结果提示Sphk1可能影响肿瘤免疫微环境,以其为靶点的免疫治疗可能为胰腺癌的靶向治疗提供新的思路。
接下来通过GSEA分析,预测Sphk1可能参与血管生成、上皮间质转化、缺氧、炎症反应、NF-κB、胶原纤维沉积及丁酸等多种代谢途径。新生血管可以为肿瘤组织提供氧气和扩散营养物质,释放促血管生成因子,诱导肿瘤发生和促进肿瘤转移,是肿瘤进展的重要标志之一[23]。细胞低氧应激状态以及胶原纤维沉积亦是肿瘤耐药的重要因素[24]。NF-κB是多条信号转导通路的枢纽,在胰腺癌中参与包括炎症反应、免疫细胞调节、癌细胞存活及增殖、肿瘤微环境、血管生成、转移等多种细胞事件[25]。同时,NF-κB可以上调穿孔素和颗粒酶B的表达来调节自然杀伤细胞的抗肿瘤潜能[26]。多项通路富集结果显示,Sphk1具有促进肿瘤发生、发展的潜在能力,我们在前述体外研究亦证实上调Sphk1可促进胰腺癌细胞的增殖和迁移,而进一步研究将依据富集分析结果探索具体的分子调控机制,例如Sphk1是否通过NF-κB信号通路调控胰腺癌细胞生物学行为的改变。
综上所述,本研究发现Sphk1在胰腺癌中表达上调,促进胰腺癌增殖和迁移,与不良预后密切相关,可作为胰腺癌患者早期诊断和预后的潜在指标。另外,Sphk1可能参与血管新生、胶原纤维沉积、缺氧及NF-κB等肿瘤相关通路,同时调控胰腺癌免疫浸润,发挥促癌作用。因此,Sphk1有望成为胰腺癌肿瘤免疫治疗的新靶点。本研究有一定的局限性,后续需要收集临床样本,验证Sphk1在胰腺癌中的表达差异和临床相关性;同时,需要进一步验证Sphk1对肿瘤相关信号通路的影响。本研究为Sphk1后续研究提供了依据和方向。

