基于深度学习方法的胶质母细胞瘤MGMT启动子甲基化基因序列状态预测
张杉杉 张杨洁 李彤
摘要:直接通过胶质母细胞瘤患者脑部MRI图像预测MGMT启动子甲基化基因序列状态,可以有效减少医生手动勾画病灶所花费的时间并可能最大限度地减少手术次数和改进所需的治疗类型。本文使用深度学习方法,在RSNA-MICCAI 脑肿瘤放射基因组学分类数据集上对胶质母细胞瘤MGMT启动子甲基化基因序列状态进行预测。
关键词:MRI;胶质母细胞瘤;基因预测;深度学习
1 引言
膠质母细胞瘤是最常见和最恶性的人类脑肿瘤,占脑瘤的15%。即使采用积极治疗,患者的中位生存期也只有12至14个月。最近,深度学习的性能在计算机视觉领域得到了集中展示,它能够提取图像中大量的深度特征,与传统放射组学提取手工特征相比,这些深度特征包含更多的医学图像抽象信息。O6 -甲基鸟嘌呤-DNA 甲基转移酶( MGMT ) 启动子甲基化可改善胶质母细胞瘤的预后和治疗反应。到目前为止,胶质母细胞瘤基因序列状态预测的研究中,仍然要依赖医生手工勾画肿瘤区域,这一任务十分浪费医生的时间和精力。因此本研究提出了一个深度学习模型,从未经医生勾画的胶质母细胞瘤患者的MRI脑部图像来预测胶质母瘤患者的MGMT启动子甲基化状态。
2 方法
研究根据患者脑部MR图像使用均值投影,得到患者二维图像。对于每个患者的二维图像,使用裁剪方法裁减掉图像周围的黑色区域,减少其对于网络的干扰。最后将得到的图像重采样到256×256,并进行归一化操作。经过预处理的二维图像作为本研究网络的输入。研究所采用的深度学习网络结构如图2所示。网络由卷积、池化和全连接层组成。10个卷积层(Conv)分别由32,32,64,64,64,64,128,128,128,128个滤波器组成,核大小均为3×3。每个卷积层之后是批处理归一化(Batch Normalization,BN)层,使网络训练更快、更稳定。最大池化层(Max-pool)用在BN层之后来降低特征图的维数,步长为2。在最大池化层之后,使用密集块(Denseblock)加强特征的传递,更有效地利用各层信息。最后经过全局平均池化层(AVG-pool)和全连接层得到最后的分类结果。为了防止网络过拟合,我们在深度学习网络的训练过程中,对于神经网络单元,按照一定的概率抑制神经元的输出,即进行dropout操作。
3 实验与结果
3.1 实验数据
本次实验采用的数据集为RSNA-MICCAI 脑肿瘤放射基因组学分类数据集,该数据集由585位胶质母细胞瘤患者的脑部MR图像组成,编号为109,123,709的三位患者因为缺少序列被排除,剩余的582个病人的MR图像均包含流体衰减反转恢复 (FLAIR)、T1 加权预对比 (T1w)、T1 加权后对比 (T1Gd)和T2 加权 (T2)四个模态。本次实验将582位患者数据中的524个数据作为训练集,58个病人作为测试集,使用十折交叉验证得到预测结果。
3.2 评价指标
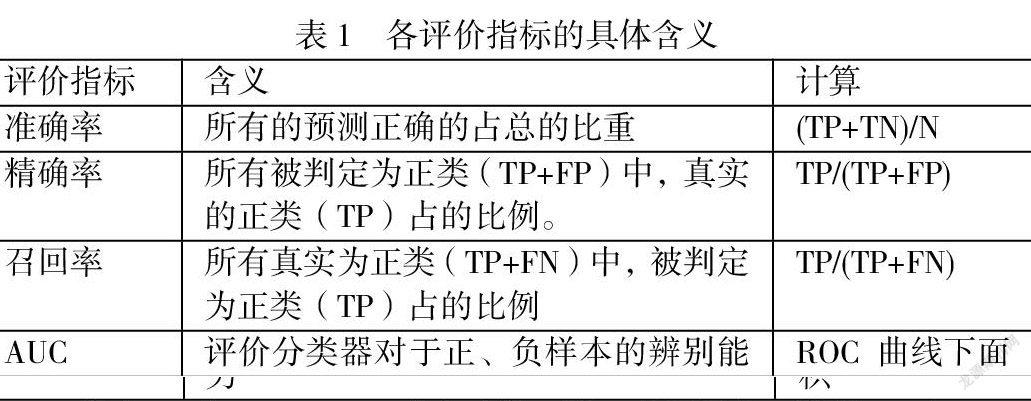
根据受试者工作特征曲线(ROC)下的面积(AUC)、准确率、精确率和召回率进行对模型分类性能的评估。各评价指标的意义及计算公式如表1所示:
其中,TP(True Positives)表示将正类正确预测为正类数;FP(False Positives)表示将负类错误预测为正类数;FN(False Negatives)表示将正类错误预测为负类数;TN(True Negatives)指将负类正确预测为负类数。
3.3 实验结果
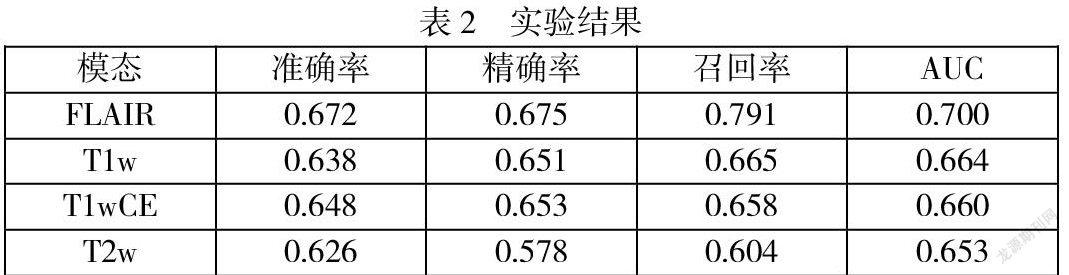
表2展示了研究构建的深度学习模型在胶质母细胞瘤MGMT启动子甲基化基因序列状态预测中的性能。研究从准确率,精确率,召回率以及AUC值四个方面对模型进行评估,并分别比较了四个模态的预测性能。可以看到,单序列中,FLAIR模态在模型中表现出相对较好的预测性能。其中,召回率为0.791,即模型对于MGMT启动子甲基化存在有较好的预测性能。
4 结束语
直接通过医学影像对胶质母细胞瘤MGMT启动子甲基化存在与否进行预测是可行的。实验表明,在胶质母细胞瘤患者MR图像中,FLAIR序列能够取得优于T1W、T1WCE和T2W三者的预测性能。同时,这一工作能够有效节省医生勾画肿瘤所花费的精力。
参考文献:
[1]Dolecek,T. A.,Propp,J. M.,Stroup,N. E. & Kruchko,C. Cbtrus statistical report: primary brain and central nervous system tumors diagnosed in the united states in 2005–2009. Neuro-oncology 14,v1–v49 (2012).
[2]Lao,J.,Chen,Y.,Li,ZC. et al. A Deep Learning-Based Radiomics Model for Prediction of Survival in Glioblastoma Multiforme. Sci Rep 7,10353 (2017). https://doi.org/10.1038/s41598-017-10649-8.
[3]Yogananda CGB,Shah BR,Nalawade SS,Murugesan GK,Yu FF,Pinho MC,Wagner BC,Mickey B,Patel TR,Fei B,Madhuranthakam AJ,Maldjian JA. MRI-Based Deep-Learning Method for Determining Glioma MGMT Promoter Methylation Status. AJNR Am J Neuroradiol. 2021 May;42(5):845-852. doi: 10.3174/ajnr.A7029. Epub 2021 Mar 4. PMID: 33664111;PMCID: PMC8115363..
[4]U.Baid,et al.,“The RSNA-ASNR-MICCAI BraTS 2021 Benchmark on Brain Tumor Segmentation and Radiogenomic Classification”,arXiv:2107.02314,2021.
第一作者简介:张杉杉(1997),女,汉族,河南省新乡县,硕士研究生,图像分析与图像处理,兰州财经大学,730010。
作者简介:李彤(1997-),女,汉族,甘肃白银,硕士研究生在读,图像处理。兰州财经大学,730010。
作者简介:张杨洁(2000-),男,汉,浙江台州,本科在读,研究方向医学图像处理,兰州财经大学,730010。

