植入前胚胎的短期酒精暴露对植入后胚胎发育的影响
李欢欢,周鑫,王秋月,于芳芳,王荣,李文雍,张迪
(阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037)
过量饮酒会导致酒精中毒、酒精依赖及相关疾病的发生,并对机体的各个系统产生损伤作用。此外,酒精还具有较强的致畸作用,可使发育中胚胎的神经细胞发生凋亡,是导致神经系统发生缺陷的重要因素之一[1]。随着近年来孕产期妇女饮酒比例的升高,胎儿罹患胎儿酒精综合征(FAS)的比例不断增加,并导致不可逆的胎儿生长发育损害,表现为一系列病理、生理、行为和智力缺陷,这些缺陷被归类为“胎儿酒精谱系异常疾病”(FASD)[2-3]。
酒精在人体内在乙醇脱氢酶和乙醛脱氢酶的催化下氧化脱氢并产生大量的氧化应激物,升高细胞的氧化应激水平并参与细胞癌变[4-5]。而妊娠期的氧化应激水平升高还会导致胎儿的表观遗传发生改变,影响胎儿的生长发育[6]。此外,酒精可以通过母胎屏障直接进入子宫及胎儿体内,由于胎儿体内缺少乙醇脱氢酶,导致酒精在胎儿体内富集,对胎儿造成直接的损伤。研究表明,酒精对胎儿的损伤作用具有时间和剂量依赖性[7-8],由于酒精在日常生活中被广泛应用,尤其增加了早期胚胎接触酒精的风险,从而引起严重的后果,包括早期胚胎发育显著受到抑制和基因组甲基化的改变[9]。胚胎着床是胎生哺乳类动物的胚泡和母体子宫壁结合,建立母子间联系并进行物质交换的过程。在前期研究中也已经发现酒精暴露会显著影响胚胎的植入[10]。因此,为研究早期胚胎的酒精暴露对胚胎植入的影响,本研究采用体外受精的方法获得胚胎,在胚胎培养液中添加酒精,采用体外培养的方式建立小鼠早期胚胎酒精暴露模型。通过免疫荧光技术对囊胚期胚胎的谱系分化进行检测;以及胚胎移植技术对13.5 d 的胎儿和胎盘的生理病理状态进行分析,来评价早期胚胎酒精暴露对胚胎着床后的发育的的影响。
1 实验材料和方法
1.1 实验动物
实验动物采用SPF 级的8 周龄以上昆明白雌性小鼠和8~10 周龄ICR 雄性小鼠,购自安徽医科大学实验动物中心。保持12 小时光周期调控,温度控制在22~26℃,相对湿度60%~70%。
1.2 实验试剂
实验中主要试剂有:小鼠胚胎体外培养液(KSOM,美国Sigma 公司),小鼠胚胎操作液(M2,美国Sigma 公司),小鼠胚胎获能夜(HTF,美国Sigma 公司),Cdx2、Oct4 一抗(Abcam 公司),山羊抗鼠二抗(Abcam 公司)。
1.3 实验设备和仪器
实验中主要的实验仪器和设备有:体式显微镜(日本尼康,SMZ745T),三气培养箱(Themo,3141),激光扫描共聚焦显微镜(德国Leica,TCS SP5Ⅱ),超净工作台(苏州净化,SW-CJ-2E)等。
1.4 实验方法
1.4.1 体外胚胎的获得
选取8-10 周龄性昆明白雌鼠,腹腔注射10 IU 的PMSG,48 小时后腹腔注射10IU 的HCG 进行超数排卵,12 小时后采用颈椎脱臼法处死雌鼠,取其输卵管,在体式显微镜下用眼科镊撕开膨大的壶腹部获得成熟的MⅡ卵母细胞,将其置于孵育了4-6 小时的小鼠HTF 获能液中获能。半小时后采用颈椎脱臼法处死正常交配一周内的雄鼠,取附睾尾放入HTF 中,在附睾尾中段剪开,使精子流出并在HTF 中获能,卵子获能1 小时后,加入60-70μL 获能后的精子悬液,在5%CO2,37℃培养箱中培养4-6 小时后挑出有双原核的受精卵进行培养。
1.4.2 胚胎培养
将具有双原核的受精卵分别移至对照组和1.0%酒精组的胚胎培养液中,其中,对照组即为未添加无水乙醇的正常1mL KSOM 培养液;1.0%酒精组即为吸取10 μL 无水乙醇加入到990 μL 正常KSOM 培养液中并吹打均匀后的胚胎培养液,并在5%CO2,37℃的二氧化碳培养箱中培养至囊胚,观察两组胚胎在各个时期的发育情况并做好统计。
1.4.3 假孕鼠准备
进行IVF 实验的当天,选取健康且处于发情期状态的性成熟昆明白雌性小鼠与输精管切除的雄性小鼠进行交配,并于12 小时后检查雌鼠阴道栓,见栓的雌鼠作为假孕鼠进行标记备用。
1.4.4 胚胎移植
根据假孕鼠体重注射麻醉药(10-15 μL/g),夹脚趾测试麻醉度,待深度麻醉后,找到其子宫所在位置,剪去毛发,酒精棉球消毒后,剪开皮肉,拉出卵巢和子宫,在子宫角处用移卵针将胚胎移入,每侧子宫各10 枚胚胎,缝合伤口并消毒,禁水禁食24 小时观察其生理状态。
1.4.5 免疫荧光
每组选取20 枚形态相似囊胚,在4%多聚甲醛中室温固定30 min 以上,0.1%PVA 洗去残留多聚甲醛,然后用0.5%的TritonX-100 室温通透30min,0.1% PVA 洗去残留溶液后在2% BSA 中室温封闭2 小时,直接转移至Cdx2 和Oct4 的一抗混合液(1∶200,封闭液稀释)中,4℃孵育过夜(12-16h),然后用0.1% PVA 清洗3 次,每次5 min,之后转移至二抗混合液(1∶500,封闭液稀释)中,37℃孵育1 小时,1% PVA 清洗3 次,每次5 min,Hoechest33342(1∶200,0.1%PVA 稀释)室温染核10 min,最后用0.1%PVA 清洗6 次洗去多余染料,将胚胎转移至含有抗荧光淬灭剂的载玻片上进行压片,使用共聚焦显微镜来获得轻微压缩的囊胚中每个荧光团的图像,其中Hoechst33342激发波长为405 nm,Cdx2 激发波长为647 nm,Oct4 激发波长为488 nm,通过扫描染色后的囊胚调整到饱和荧光强度,同时保持参数:像素值102 4x1 024,物镜40x,line3,frame1,Zoom Factor2-3,在同一参数下获取不同组别染色后的图片,使用Image Pro-Plus6.0 及SPASS 软件进行荧光强度分析。
1.4.6 统计分析
采用SPSS16.0 对各期胚胎形成率差异进行分析,单因素方差分析,p<0.05,差异显著;p<0.01,差异极显著。
2 结果与分析
2.1 E13.5 胚胎发育情况
在假孕母鼠子宫两侧分别移植10 枚正常组与1.0%酒精组囊胚,避免小鼠后代数量不因移植囊胚数量不同而产生显著性差异。胚胎移植后第10 天剖取胎盘及胎儿,与正常组相比,酒精暴露的早期胚胎移植后难以发育为成型的胎儿和胎盘(图1),对两组胚胎移植后的成型胎儿获得率进行统计分析(图2 A B)发现,相较于正常组,植入前酒精处理的胚胎的植入率显著降低(p<0.01),胎儿获得率也显著降低(p<0.01)。接下来对所得两组胎儿和胎盘进行称重统计,结果显示(图2 C),与正常组相比,酒精组的胎儿体重显著降低(p<0.01);随后根据胎盘形态和质量对所得胎盘进行分类,其中形态较好、质量大于0.9 g 的胎盘记为Ⅰ类胎盘,形态一般、质量小于0.9 g 的胎盘记为Ⅱ类胎盘,在Ⅰ类胎盘中,酒精组胎盘质量显著低于正常组(p<0.01),在Ⅱ类胎盘中,两组的胎盘质量无显著差异,酒精组的Ⅱ类胎盘数量明显多于正常组。由此说明植入前胚胎的短期酒精暴露会影响胚胎植入后的生长发育,对其造成损伤。

图1 正常组与1.0%酒精组E13.5 解剖观察。A.子宫解剖图,B.胎儿胎盘解剖图,C.胎盘解剖图。
2.2 囊胚分化检测
胚胎细胞命运决定和分化是胚胎发育的基础,其调控机制是发育生物学重要的研究领域。内细胞团(Inner cell mass,ICM)和滋养层(Trophectoderm,TE)的形成是哺乳动物胚胎发育命运决定的关键。在小鼠早期胚胎发育过程中,Cdx2 是TE细胞的标记基因之一,在TE 形成过程中,Cdx2 是TE 发育所必需的同源盒转录因子,Cdx2 敲除胚胎因为无法形成成熟的TE 导致植入失败,而滋养层的缺失则会导致胚胎无法扩大成腔[11];Oct4 是内细胞团的标记基因,也是维持胚胎干细胞多能性的关键因子,在没有Oct4 存在的情况下胚胎无法形成ICM,桑葚胚内部细胞被驱动进入滋养层细胞分化。Cdx2 和Oct4 在谱系分化的角色扮演中维持相对地表达平衡,是维持ICM 和ES 所必需的[12]。我们通过检测Cdx2 和Oct4 在囊胚期细胞中的表达来评价酒精暴露对小鼠早期胚胎发育和胚层分化的影响。
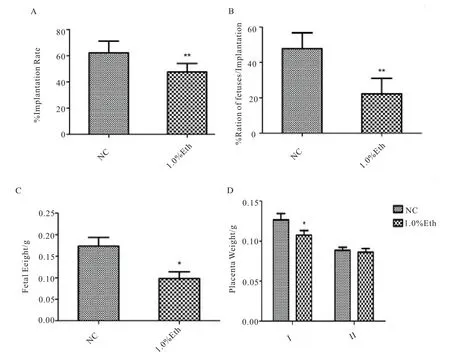
图2.E13.5 解剖结果统计。A.胚胎植入率,B.胚胎植入后获得胎儿比率,C.13.5d 胎儿称重,D.13.5dⅠ类、Ⅱ类胎盘称重。使用单向ANOVA 检验分析组间差异。其中,*表示p<0.05,差异显著;**表示p<0.01,差异极显著。误差线显示标准偏差(SD)。
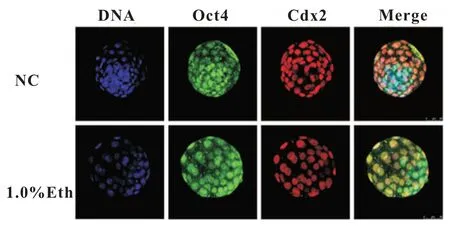
图3 正常组,1.0%酒精组囊胚细胞免疫荧光染色图
我们前期的研究已经证明酒精暴露会导致早期胚胎的囊胚率降低,且对胚胎发育的损伤具有剂量依赖性[8],为弄清酒精暴露对早期胚胎谱系分化的影响,分别对囊胚期细胞的TE 和ICM 的标记基因Cdx2 和Oct4 进行免疫荧光染色观察,并应用Imagepro Plus 6 对其结果进行分析。结果显示,1.0%酒精组的囊胚细胞的总染色细胞数显著低于正常组(图4.A,P<0.01),1.0%酒精组Cdx2染色细胞数显著低于正常组(图4.B,P<0.01),1.0%酒精组Cdx2 染色细胞数占总细胞数目之比显著低于正常组(图4.C,p<0.01)。接下来对Cdx2 和Oct4 的单位荧光强度进行分析,发现两种转录因子的单位荧光强度呈现不同的结果,酒精组的Oct4 的单位荧光强度显著高于正常组(图5.A,p<0.05)而Cdx2 的单位荧光强度则显著低于正常组(图5.B,P<0.01),且相较于Oct4,Cdx2 的荧光变化更显著,酒精组Cdx2 与Oct4 单位荧光强度比值显著低于正常组(图5.C,p<0.01)。两种转录因子Cdx2 和Oct4 作为谱系分化的标志物,在正常胚胎中存在相互抑制平衡[13],从本研究结果来看,这种平衡在酒精暴露的早期胚胎中明显被打破,导致其基因表达的改变,而这种改变必然对胚胎的发育产生严重影响。
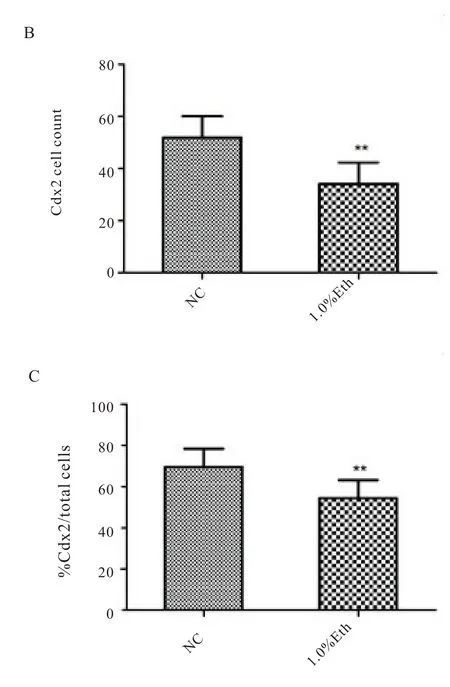
图4 正常组,1.0%酒精组囊胚细胞计数。A.囊胚总细胞数;B.Cdx2 染色细胞数;C.Cdx2 染色细胞数占总细胞数比例.
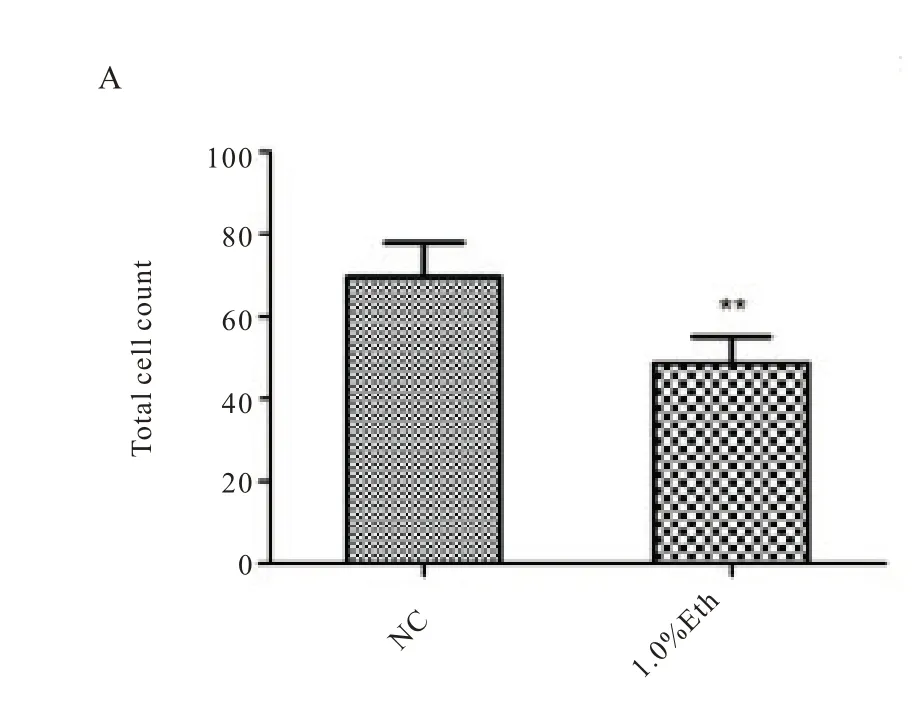
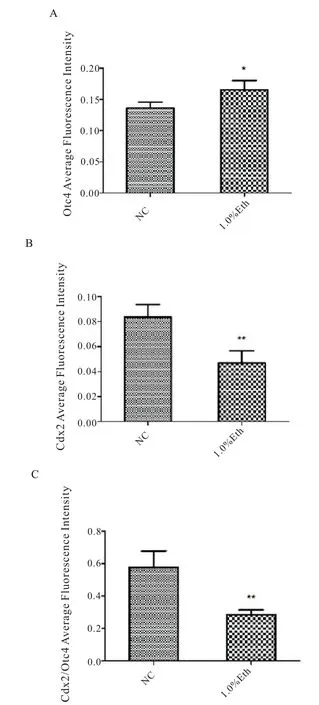
图5 正常组,1.0%酒精组免疫荧光强度分析。A.Oct4 单位荧光强度;B.Cdx2 单位荧光强度;C.Cdx2/Oct4 单位荧光强度比值。
讨论
妊娠期间酒精暴露导致的胎儿发育异常统称为胎儿酒精综合征(FAS),包括胎儿中枢神经系统(CNS)功能障碍和可识别的面部异常[14]。近年来,女性妊娠期饮酒比例大幅度上升,而早期胚胎的短期酒精暴露将对植入后胚胎发育产生怎样的影响尚不清楚。因此,我们选择植入前胚胎体外暴露于酒精,观察其植入后的发育情况来探索短期的酒精暴露对植入后胚胎发育的影响。
妊娠期间不良的宫内环境也会造成胎儿的宫内发育迟缓,对其相应基因的全血甲基化分析发现其启动子区的甲基化状态发生改变从而导致胎儿的生长发育受到影响[15]。植入前胚胎受到外界环境的毒性效应也会对植入后胚胎的宫内发育造成损伤。胚胎移植后10 天的小鼠胚胎解剖结果显示,酒精组胚胎的植入率和胎儿发育率显著降低,胎盘的发育也呈现出明显的改变。酒精组胎盘重量显著减少,且胎盘成型率降低。胎盘作为胎儿和母体联系的纽带,在胎儿发育过程中负责向胎儿输送养料以及运输废物,胎盘发育受损将直接影响胎儿在母体子宫内的发育,胎盘结构和功能的损伤直接影响胎儿以及出生后的后代的生长发育[16-17]。然而植入前酒精暴露的胚胎在植入后的胎儿和胎盘损伤的具体机制以及胎儿和胎盘间是否存在相互作用尚不清楚,需要进一步探究。
在小鼠胚胎中,Cdx2 被认为是TE 的特异性转录因子,Oct4 被认为是ICM 的特异性转录因子[18]。细胞谱系的正确建立决定着细胞命运,研究发现,Cdx2 和Oct4 的表达具有拮抗作用,Cdx2可以结合到Oct4 基因的启动子区抑制其表达,同样Oct4 也可以结合到Cdx2 基因的启动子区抑制其表达,这种相互作用决定了早期胚胎中ICM/TE谱系的分化[19-20]。在暴露于酒精的早期胚胎中,囊胚期细胞的免疫荧光染色结果显示,Cdx2 和Oct4的表达平衡改变,酒精暴露的早期胚胎的谱系分化发生改变,我们推测,早期胚胎酒精暴露可能通过影响谱系分化而影响植入后胚胎在子宫内的生长发育。
结论
胚胎发育是一个神秘而又复杂的过程,环境的微小改变都会对其造成不可逆转的影响。本研究探究了早期胚胎酒精暴露对植入后胚胎在母体子宫内的发育的影响,研究发现早期胚胎酒精暴露后会造成植入后胎儿和胎盘的发育损伤,导致囊胚期细胞谱系分化改变,对胚胎发育产生极大的影响。

