EPHX2 rs751141变异位点对肾脏微炎症的影响及其分子机制研究
马 亮 赵海玲 赵婷婷 赵美美 刘 怡 高 芃 李 平 曹永彤*
(1.中日友好医院检验科,北京 100029;2.中日友好医院临床医学研究所 免疫炎性疾病北京市重点实验室,北京 100029)
2型糖尿病(diabetes mellitus, DM)是一种复杂的代谢紊乱疾病,长期高血糖会导致机体多器官受累并出现较严重的并发症。糖尿病相关肾病(diabetic kidney disease, DKD)是DM的主要血管并发症,约有30%~40%的DM患者最终发展为DKD。DKD是多种因素综合作用的结果,其中糖代谢紊乱、肾血流动力学的改变、微炎症以及遗传背景等均起到非常重要的作用[1]。近年来,微炎症在DKD的发病机制中受到越来越多的重视。Tuttle等[2]认为DM是一种由代谢紊乱触发的炎症性疾病。长时间微环境炎症是DKD发病的主要原因之一,相关研究[3]表明,抗炎分子能减轻DKD,促炎因子如白细胞介素-1(interleukin-1,IL-1)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等可以促进DKD进展[4]。
近年来,可溶性环氧化物水解酶(soluble epoxide hydrolase, sEH)在肾脏疾病尤其是DKD发病中所起的作用逐渐被重视,sEH抑制剂的研究以及该基因敲除有可能成为DKD治疗的新靶点。EPHX2编码的sEH可水解体内由芳香族和烯类化合物代谢产生的环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)生成相应的二羟基二十碳三烯酸(dihydroxyeicosatrienoic acids,DHETs),而且多个研究也表明EETs具有抗炎、舒张血管平滑肌、抗凝、促进血管生成、抗凋亡等多种功能。肾脏EETs浓度降低可促进DKD的发展,给予外源性EETs可以抑制2型糖尿病肾病大鼠肾脏组织中炎症因子单核细胞趋化蛋白表达,降低尿白蛋白排泄率,减轻肾脏病理改变[5]。肾脏EETs浓度升高可通过阻断核转录因子-κB的活化和减少肾脏巨噬细胞的浸润来抑制肾脏微炎症的进展[6]。本课题组前期临床研究[7]显示,编码sEH的EPHX2基因rs751141多态性(R287Q)与DKD的发生有关,该多态性与DKD相关性的具体机制有待于进一步研究。本研究中采用外源基因过表达、重组表达质粒转染等技术开展体外细胞实验,探讨EPHX2 rs751141基因多态性(G860A, R287Q)对sEH酶活性的影响及其分子机制。
1 材料与方法
1.1 实验材料
HK2细胞株(美国ATCC公司);核酸提取试剂盒(德国QIAGEN公司);EcoRⅠ限制性内切酶、XhoⅠ限制性内切酶(美国New England Biolab公司);pcDNA3.1/V5-His真核表达载体(美国Invitrogen 公司);pUC-T TA连接试剂盒(北京康为世纪生物科技有限公司);11,12-EET(美国Cayman公司);11,12-EET DHET免疫测定试剂盒(美国Detroit R&D公司);sEH和β-actin单克隆抗体(美国Santa Cruz公司);p-AKT单克隆抗体、AKT单克隆抗体、PI3K单克隆抗体(美国CST公司)、高保真酶2×Es Taq Master Mix(康为世纪)。
1.2 PCR扩增EPHX2基因
Trizol提取HK2细胞株总RNA,取3 μg RNA经反转录试剂盒反转录为cDNA。根据GeneBank中人EPHX2 mRNA CDS序列,以Oligo 7软件设计引物,上游引物引入EcoRⅠ酶切位点,下游引物引入XhoⅠ酶切位点。以高保真酶2×Es Taq Master Mix(康为世纪)进行扩增EPHX2 cDNA片段。配制50 μL PCR反应体系:25 μL 2×Mix,上下游引物各2 μL(20 μmol/L),cDNA 6 μL,无RNase水 15 μL。PCR反应条件:94 ℃ 预变性2 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃ 延伸45 s,共32个循环,最后72 ℃10 min灭活Taq酶。
EPHX2 PCR扩增引物序列:正向引物为5′-GAATTCATGACGCTGCGCGCGGCCGT-3′;反向引物为5′-CTCGAGCATCTTTGAGACCACCGGTG -3′(EcoRⅠ酶切位点:GAATTC,XhoⅠ酶切位点:CTCGAG)。
1.3 合成点突变引物并诱导点突变
运用Primer premier 5.0设计软件,以加州大学圣克鲁兹分校UCSC Feb.2009(GRCh37/hg19)数据库提供的EPHX2基因组序列为参照序列,R287Q点突变引物序列正向引物: 5′- TCTGGCCCAGGCAGGTTACCAGGTCCTAGCTATGGACATG-3′; 反向引物: 5′- CATGTCCATAGCTAGGACCTGGTAACCTGCCTGGGC- CAGA-3′。
1.4 EPHX2 DNA亚克隆至pcDNA3.1/V5-His A真核载体
将测序正确的质粒DNA与载体pcDNA3.1/V5-His A分别经EcoRⅠ和XhoⅠ双酶切,T4连接酶连接后,重新转化入DH5α感受态细胞,接种至LB固体培养基,同时接种载体自身连接作为阴性对照。37 ℃培养16 h后挑取单克隆菌,依次经扩增、提取、酶切鉴定、测序等步骤后,得到含有正确插入片段的重组质粒DNA。
1.5 细胞培养液中11,12-DHET含量测定
本实验共设置3组:空质粒转染组(NC)、突变型组(EPHX2/R287Q/pcDNA3.1/V5-His,R287Q)、野生型组(EPHX2/pcDNA3.1/V5-His,WT)。实验结束前2 h加入11,12-EET,终浓度为1 μmol/L。终止实验收集细胞培养上清。使用ELISA试剂盒检测11,12-DHET浓度。
1.6 流式细胞仪检测IL-17A和IL-1细胞因子浓度
标准品用前2 000 g离心10 s,加入250 μL稀释液,混匀并冰浴10 min,取一个八联管,标记1~8,将最高浓度标准品转入1号管,其余每管加入120 μL 稀释液,由1号管依次转移60 μL到下一管混匀,到7号管,8号管不加为本底,完成梯度稀释。获取模板的建立,打开一个新程序,建立散点图及柱状图。运行检测程序样品的检测结果分析。
1.7 实时定量PCR法检测转染重组质粒后相关指标IL-17A和IL-1表达变化
配置总体积为25 μL/管的PCR反应体系如下:UltraSYBR Mixture(含ROXⅠ) 12.5 μL;上游引物: 1 μL(10 μmol/L);下游引物:1 μL(10 μmol/L);cDNA模板 2 μL(10 ng);无RNase水 8.5 μL。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火/延伸1 min,共计40个循环,融解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。引物序列详见表1。
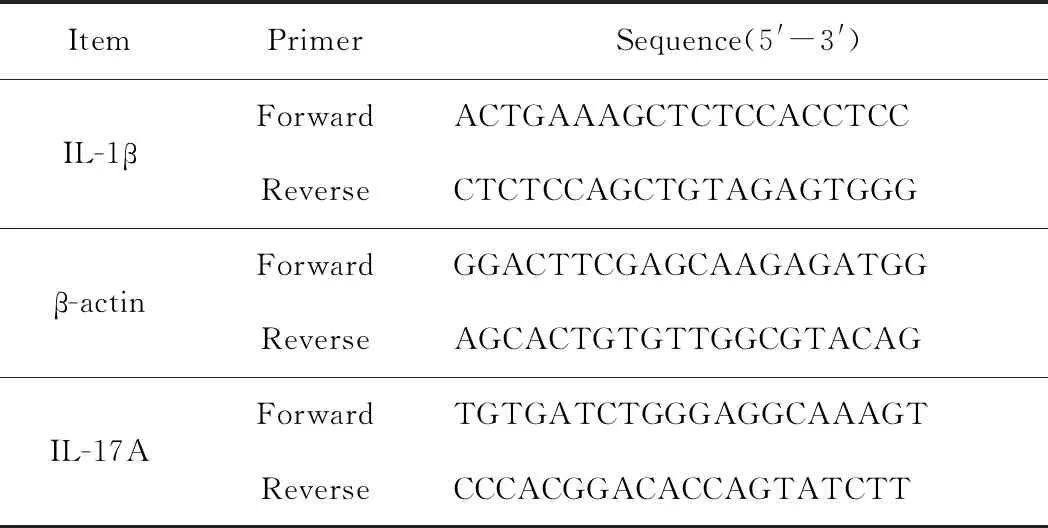
表1 Real-time PCR引物序列
1.8 Western blotting检测细胞转染重组质粒后相关指标变化
提取R287Q组、WT组、NC组蛋白,BCA法测定蛋白浓度,蛋白上样量40 μg,经凝胶配置、上样电泳、转膜、5%(质量分数)脱脂奶粉封闭1 h,分别加入p-AKT、AKT、PI3K、β-actin抗体4 ℃孵育过夜,TBST洗膜后,滴加HRP标记羊抗鼠/兔 IgG室温孵育1 h。使用凝胶摄像仪器曝光信号检测, Image J 1.43软件进行灰度值分析测量,将相应目的蛋白与内参蛋白(β-actin)灰度值比值作为目的蛋白的相对表达量。
1.9 统计学方法
2 结果
2.1 构建EPHX2 WT、R287Q突变型重组表达质粒
EPHX2 WT、R287Q突变型重组表达质粒和空载体转染至HK2细胞后48 h收集细胞进行实验。用Western blotting方法检测融合蛋白的表达(图1),sEH蛋白的相对分子质量为62 500。该结果表明WT、R287Q突变型重组表达质粒构建成功。
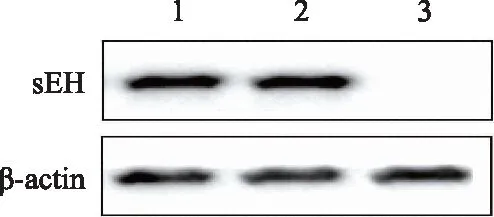
图1 构建的重组表达质粒及空载体转染后sEH蛋白表达情况Fig.1 Expression of sEH protein after transfection with recombinant plasmid and empty vector1: wild type; 2: R287Q mutant; 3: empty vector; sEH: soluble epoxide hydrolase.
2.2 R287Q突变型重组质粒对HK2细胞培养上清11,12-DHET浓度的影响
将WT组、R287Q组、NC组转染HK2细胞,并在细胞培养液中加入1 μmol/L 11,12-EET后,细胞培养上清中11,12-DHET的量显著上调,表明转染进入细胞的EPHX2重组质粒成功在细胞内表达,并且具有较强的水解酶活性。R287Q组水解11,12-EET活性明显低于野生型WT(P<0.01),详见图2。
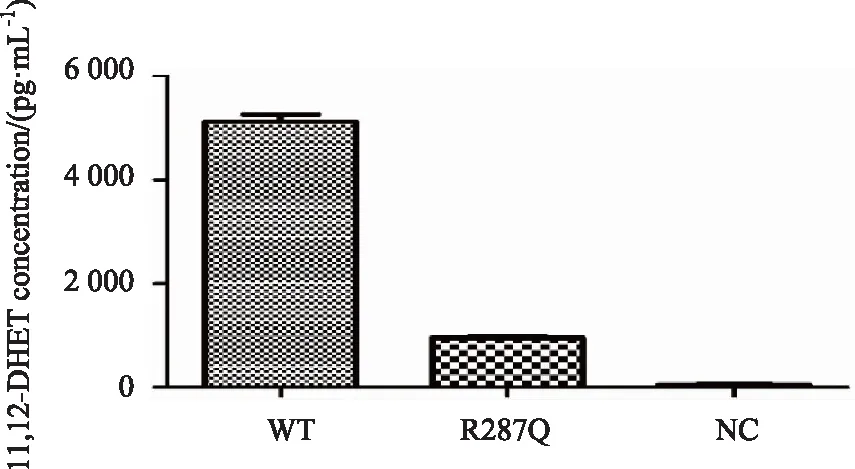
图2 WT组、R287Q组重组表达质粒和NC组转染HK2细胞后,给予11,12-EET细胞培养上清中11,12-DHET浓度Fig.2 Concentration of 11,12-DHET in the supernatant of HK2 cells transfected with the recombinant expression plasmids of WT, R287Q and NC was measuredn=3; 11,12-EET: 11,12-epoxyeicosatrienoic acid; 11,12-DHET: 11,12-dihydroxyeicosatrienoic acid; WT:EPHX2/pcDNA3.1/V5-His; R287Q:EPHX2/R287Q/pcDNA3.1/V5-His; NC:pcDNA3.1/V5-His.
2.3 R287Q突变型重组质粒对HK2细胞上清炎症因子浓度的影响
2.3.1 R287Q突变型重组质粒对HK2细胞上清IL-17A浓度的影响
如图3所示,突变型R287Q组细胞上清IL-17A浓度低于WT组(P<0.05),未干预的WT组IL-17A浓度为34.61 pg/mL,突变型R287Q组IL-17A浓度为24.13 pg/mL,NC组IL-17A浓度为29.00 pg/mL。

图3 突变型R287Q重组质粒对HK2细胞IL-17A浓度以及外源性11,12-EET干预对其影响Fig.3 Effect of mutant R287Q recombinant plasmid on the level of IL-17A and exogenous 11,12-EET intervention in HK2 cellsn=3,*P<0.05; IL: interleukin; 11,12-EET: 11,12-epoxyeicosatrienoic acid;WT:EPHX2/pcDNA3.1/V5-His;R287Q:EPHX2/R287Q/pcDNA3.1/V5-His;NC:pcDNA3.1/V5-His.
加入11,12-EET干预后,11,12-EET可以使WT组IL-17A浓度降低为30.56 pg/mL,低于未加11,12-EET 的WT野生型组(P<0.05),高于加入11,12-EET 突变型R287Q组IL-17A浓度(26.90 pg/mL)(P<0.05),NC组IL-17A浓度降低为27.99 pg/mL。
2.3.2 R287Q突变型重组质粒对HK2细胞上清IL-1浓度的影响
如图4所示,突变型R287Q组细胞上清IL-1浓度低于WT组(P<0.05),未干预的WT野生型IL-1浓度为0.70 pg/mL,突变型R287Q组 IL-1浓度为0.55 pg/mL, NC组IL-1浓度为0.70 pg/mL。
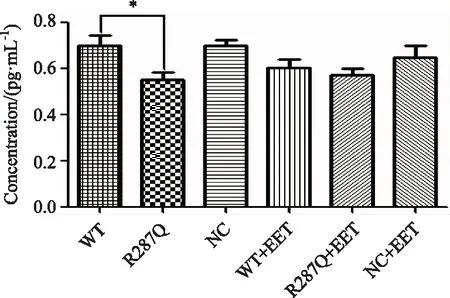
图4 突变型R287Q组重组质粒对HK2细胞IL-1浓度以及外源性11,12-EET干预对其影响Fig.4 Effect of mutant R287Q recombinant plasmid on the level of IL-1 and exogenous 11,12-EET intervention in HK2 cells n=3, *P<0.05; IL: interleukin; 11,12-EET: 11,12-epoxyeicosatrienoic acid;WT:EPHX2/pcDNA3.1/V5-His;R287Q:EPHX2/R287Q/pcDNA3.1/V5-His;NC:pcDNA3.1/V5-His.
加入11,12-EET干预后,11,12-EET可以使WT野生型IL-1浓度降低为0.60 pg/mL,低于未加11,12-EET 的WT组,但差异无统计学意义(P=0.15);高于加入11,12-EET的突变型R287Q 组IL-1(0.57 pg/mL),但差异也无统计学意义(P=0.52),NC组IL-1浓度为0.65 pg/mL。
2.4 R287Q突变型重组质粒对HK2细胞IL-17A和IL-1β mRNA水平的影响
2.4.1 R287Q突变型重组质粒对HK2细胞IL-17A mRNA表达的影响
如图5所示,突变型R287Q组相对于WT组HK2细胞IL-17A mRNA表达明显降低(P<0.01)。加入11,12-EET干预后,WT组低于未加11,12-EET 的WT组(P<0.05),高于加入11,12-EET的突变型R287Q组(P<0.05)。

图5 R287Q突变型重组质粒对HK2细胞株IL-17A mRNA表达的影响以及外源性11,12-EET干预后对其影响Fig.5 Effect of mutant R287Q recombinant plasmid on the expression level of IL-17A mRNA in HK2 cell line and after exogenous 11,12-EET intervention n=3, *P<0.05, **P<0.01; IL-17A: interleukin-17A;11,12-EET: 11,12-epoxyeicosatrienoic acid;WT:EPHX2/pcDNA3.1/V5-His;R287Q:EPHX2/R287Q/pcDNA3.1/V5-His;NC:pcDNA3.1/V5-His.
2.4.2 R287Q突变型重组质粒对HK2细胞IL-1β mRNA表达的影响
如图6所示,突变型R287Q组相对于WT组HK2细胞IL-1β mRNA表达明显降低(P<0.01)。WT组低于未加11,12-EET 的WT组,但差异无统计学意义(P=0.24),高于加入11,12-EET的突变型R287Q组(P<0.05),差异有统计学意义。
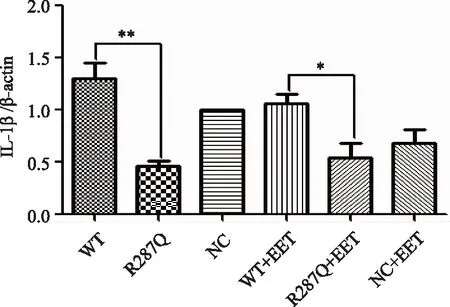
图6 R287Q突变型重组质粒对HK2细胞株IL-1β mRNA表达的影响以及外源性11,12-EET干预后对其影响Fig.6 Effect of mutant R287Q recombinant plasmid on the expression level of IL-1β mRNA in HK2 cell line and after exogenous 11,12-EET intervention n=3, *P<0.05, **P<0.01; IL-1β: interleukin-1β; 11,12-EET: 11,12-epoxyeicosatrienoic acid;WT:EPHX2/pcDNA3.1/V5-His;R287Q:EPHX2/R287Q/pcDNA3.1/V5-His;NC:pcDNA3.1/V5-His.
2.5 R287Q突变型重组质粒对HK2细胞p-AKT/AKT蛋白表达的影响
R287Q突变型相对于WT型HK2细胞p-AKT/AKT表达明显降低(P<0.05)。加入11,12-EET干预后,WT型低于未加11,12-EET 的WT型组(P<0.01),高于加入11,12-EET的R287Q突变型(P<0.05),详见图7。
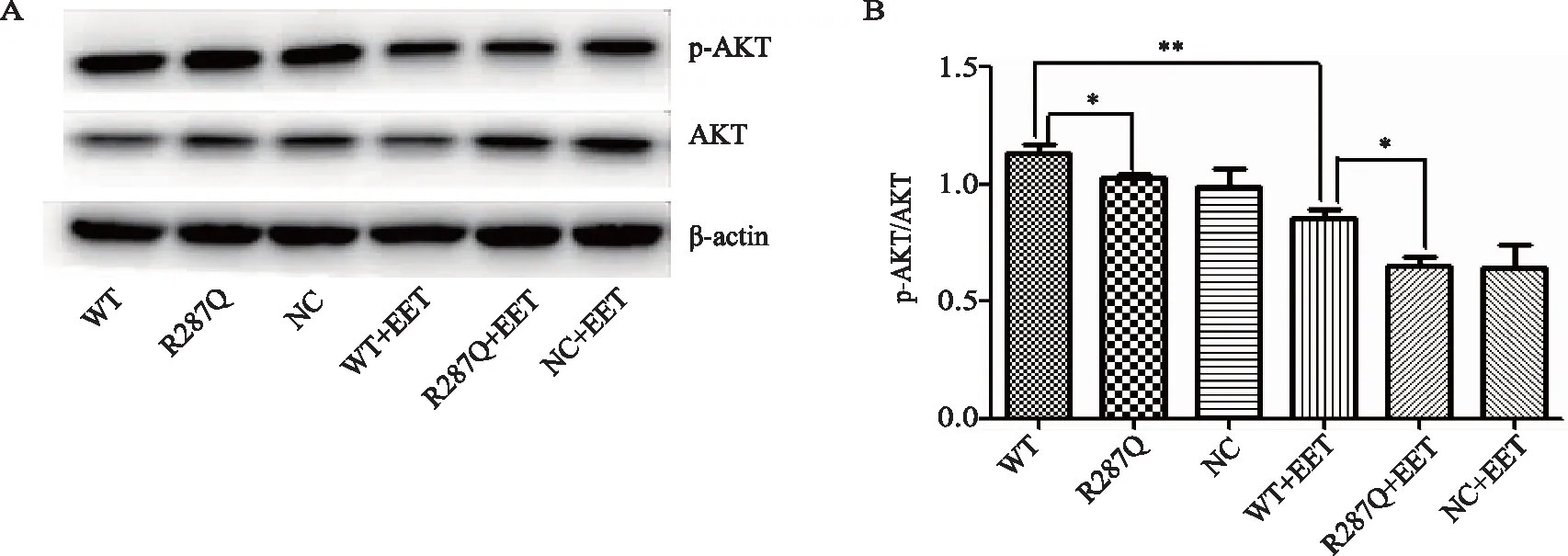
图7 R287Q突变型重组质粒对HK2细胞株p-AKT/AKT蛋白表达的影响以及外源性11,12-EET干预后对其影响Fig.7 Effect of mutant R287Q recombinant plasmid on the expression of p-AKT/AKT protein in HK2 cell line and after exogenous 11,12-EET intervention A: Western blotting; B: data analysis; n=3,*P<0.05, **P<0.01; 11,12-EET: 11,12-epoxyeicosatrienoic acid;WT:EPHX2/pcDNA3.1/V5-His;R287Q:EPHX2/R287Q/pcDNA3.1/V5-His;NC:pcDNA3.1/V5-His.
2.6 R287Q突变型重组质粒对HK2细胞PI3K蛋白表达的影响
R287Q突变型相对于WT型HK2细胞PI3K/β-actin表达明显降低(P<0.05)。加入11,12-EET干预后,WT型高于未加11,12-EET 的WT型组,但差异无统计学意义(P=0.37),低于加入11,12-EET的R287Q突变型(P<0.01)差异有统计学意义,详见图8。

图8 R287Q突变型重组质粒对HK2细胞株PI3K表达的影响以及外源性11,12-EET干预后对其影响Fig.8 Effect of mutant R287Q recombinant plasmid on the expression level of PI3K in HK2 cells and the effect of exogenous 11,12-EET intervention A: Western blotting; B: data analysis; n=3, *P<0.05, **P<0.01; 11,12-EET: 11,12-epoxyeicosatrienoic acid;WT:EPHX2/pcDNA3.1/V5-His;R287Q:EPHX2/R287Q/pcDNA3.1/V5-His;NC:pcDNA3.1/V5-His.
3 讨论
1973年Gill等[8]在研究类似昆虫保幼激素萜类环氧化物的代谢时发现sEH,因其主要位于细胞的可溶性成分如细胞质和过氧化酶体中而命名,主要分布于细胞质及过氧化物酶体中,在肝脏、肾脏、内皮细胞、胰岛和心肌细胞中表达最为丰富。sEH以同源二聚体的形式存在,具有氨基端和羧基端两个活性结构域,羧基端具有氧化水解的活性,而氨基端可能与sEH稳定性有关,具有磷酸酶活性。sEH须以二聚体的形式发挥其生物活性[9],该二聚体的三维结构模式图提示,两个羧基末端相互靠近,氨基末端之间不直接接触而是与相应的羧基末端联系,空间结构的破坏将导致其功能的丧失。
人类sEH编码基因EPHX2有19个外显子的长约45 kb,定位在8p21-p12[10]。Sandberg等[11]于2000年首次在25例肝脏组织中发现4例EPHX2基因cDNA序列860位碱基G突变为A(c.860G>A),相对应的氨基酸由精氨酸变为谷氨酰胺(R287Q),并进一步应用t-SO(trans -[3H ]stilbene oxide)作为底物对该突变酶活性研究发现R287Q突变型酶活性明显低于野生型。
本研究中,本课题组首先构建了sEH野生型和R287Q突变型表达质粒,将其在HK2细胞株中过表达,在实验结束前2 h加入11,12-EET,终浓度1 μmol/L,通过检测其代谢产物11,12-DHET,可以反映sEH不同突变类型代谢11,12-EET的能力,另一方面也间接反映不同突变类型sEH水解酶活性。研究结果显示,R287Q重组质粒水解11,12-EET的酶活性在所有构建的重组质粒中最低,并且明显低于野生型,这与之前的研究[9]较一致。R287Q不位于催化活性中心,表明sEH的催化作用并不能用简单的催化活性中心与底物相互作用来解释。Nelson等[9]sEH二聚体的研究显示,R287Q多态性与野生型相比并不改变二聚体结构状态,但是却呈现不稳定的二聚体状态,导致其水解能力降低,所以sEH二聚体结构状态对其水解活性具有非常重要的作用。
本研究的细胞实验结果显示,通过野生型和突变型外源基因过表达,在IL-1、IL17A等炎症因子水平上,R287Q突变型低于野生型,说明R287Q突变型具有减缓炎症作用。在mRNA水平表达上,R287Q突变型也能够降低炎症因子的表达。
蛋白激酶B(protein kinase B, PKB/Akt)是一种丝氨酸/苏氨酸特异性蛋白激酶,在葡萄糖代谢,细胞凋亡、存活、增殖以及细胞骨架的变化等活动中发挥重要的生物学功能。Akt广泛表达于体内各种组织,磷酸化的蛋白激酶B(p-Akt)是其活性形式。之前的研究[12]证实,在糖尿病大鼠中,胰岛素样生长因子刺激Akt的磷酸化,导致Akt通路的激活。而磷酸化的Akt能够激活IκB激酶,使IκB与核转录因子-κB形成具有活性的核转录因子-κB p65亚基,使得其进入细胞核,促进相关炎症因子的转录,从而导致炎症反应的发生[13]。而在本研究中,R287Q突变型相对于野生型p-Akt/Akt明显降低,说明R287Q突变型可以通过下调p-Akt减缓炎症。
当加入过量外源11,12-EET时,野生型炎性指标水平差距变小,但仍高于加入过量外源11,12-EET的R287Q突变型,说明野生型与R287Q之间差距部分可以被外源11,12-EET减弱,但并没有完全消除,这可能与sEH还代谢其他炎症相关活性物质有关,相关研究[14]也显示与EETs相比,新发现的sEH的底物EEQs具有更强的抗炎作用,因此R287Q减缓炎症的具体机制尚有待于进一步研究。
本研究首次构建了R287Q突变型重组表达质粒对该突变型酶活性进行了研究,与国外其他研究[8]该酶活性的方法不同,但结论一致。并通过外源基因过表达的方法证实了该酶点突变可以影响炎症水平及相关信号通路,为R287Q多态性的临床应用奠定了实验基础。
——一道江苏高考题的奥秘解读和拓展

