干扰ECT2基因表达对结直肠癌SW620细胞侵袭和迁移的影响及机制研究
李索妮 李丽娜 马婕群 郑 琪 张彦兵 翟 阳 周 菁
结直肠癌是常见的消化系统恶性肿瘤,也是全球肿瘤相关死亡的主要原因之一[1]。在西方发达国家中,结直肠癌是发病率仅次于肺癌的第2位恶性肿瘤,近年来中国结直肠癌的发病率迅速升高[2]。目前临床上虽已对结直肠癌的常规治疗方法(包括外科手术)进行了改进,但仍有超过三分之一的患者发生了转移[3]。研究表明结直肠癌形成过程与促癌基因的激活及抑癌基因的失活密切相关[4]。因此,探寻更多新的生物标志物有助于开发预防和治疗结直肠癌的新方法。上皮细胞转化序列2(ECT2)基因在进化上高度保守,研究表明ECT2在多种恶性肿瘤(包括非小细胞肺癌和乳腺癌等)中表达上调[5-6]。近年来研究显示,ECT2的异常表达与肿瘤患者的总生存期及预后等密切相关[7]。有研究报道ECT2在结直肠癌组织中呈高表达,且与肿瘤的大小及TNM分期有关[8]。然而,ECT2在结直肠癌发生和发展中的作用及机制方面鲜见报道。本实验探究了ECT2基因对人结直肠癌SW620细胞侵袭和迁移的影响,以期为ECT2基因作为结直肠癌治疗的新靶点提供理论依据。
1 材料与方法
1.1 材料
人结直肠癌细胞株SW620(中国科学院上海细胞库);胎牛血清、RPMI-1640培养基、Matrigel基质胶(美国Gibco公司);胰蛋白酶(美国Sigma公司);ECT2特异性siRNA及非特异性siRNA(上海吉玛生物有限公司);脂质体Lipofectamine 2000转染试剂、TRIzol试剂(美国Invitrogen公司);8 μm孔径的Transwell小室(美国Millipore公司);鼠抗人ECT2、基质金属蛋白酶-2(MMP-2)和MMP-9抗体及辣根过氧化物酶标记的山羊抗鼠二抗(美国CST公司);反转录试剂盒(大连宝生物工程有限公司);SYBR Green qPCR Master Mix检测试剂盒、超敏ECL化学发光检测试剂盒(赛默飞世尔科技有限公司);蛋白提取试剂盒(上海远慕生物科技有限公司);BCA蛋白浓度检测试剂盒(北京中科瑞泰生物科技有限公司)。
1.2 细胞培养
人结直肠癌SW620细胞常规复苏后置于RPMI-1640培养液(含10%胎牛血清)中,于5% CO2、饱和湿度、37 ℃恒温培养箱中孵育,使用显微镜观察细胞生长状态,每2~3 d更换新鲜培养液。待细胞生长汇合度达90%以上时,用胰蛋白酶消化细胞,按照1︰3的比例进行传代。
1.3 SW620细胞的转染和分组
将生长状态良好的SW620细胞以5×104个/孔的密度接种到6孔板中,置于37 ℃培养箱中常规培养,待细胞贴壁后汇合度为50%~60%时进行转染。根据脂质体Lipofectamine 2000转染试剂说明书,将ECT2特异性siRNA或非特异性siRNA转染至SW620细胞,分别记为si-ECT2组和si-NC组。将未行转染的SW620细胞作为空白对照,记为Control组。转染后将各组细胞置于37 ℃培养箱中培养48 h,分别收集各组细胞以备相关指标检测。
1.4 实时荧光定量PCR法检测ECT2 mRNA的表达水平
使用TRIzol试剂分别提取各组结直肠癌SW620细胞中的总RNA,按照反转录说明书将RNA反转录成cDNA,以cDNA为模板,以β-actin为内参,使用SYBR Green qPCR Master Mix检测试剂盒进行实时荧光定量PCR(real-time qPCR)检测。反应条件为:94 ℃预变性5 min;随后94 ℃ 30 s、60 ℃ 30 s、72 ℃ 20 s,循环40次。采用2-ΔΔCt法计算目的基因ECT2的相对表达量。引物序列见表1。

表1 引物序列
1.5 ECT2、MMP-2和MMP-9蛋白表达水平检测
采用蛋白质印迹法(Western blotting)检测 ECT2、MMP-2和MMP-9蛋白表达水平。使用蛋白提取试剂盒分别提取各组SW620细胞中总蛋白,以BCA法进行蛋白定量分析,蛋白与缓冲液混合于沸水中煮沸10 min使蛋白变性。配制十二烷基硫酸钠-聚丙烯酰胺凝胶,取等量蛋白进行上样,行电泳分离蛋白,以湿转法将蛋白转移至PVDF膜上,置于5%脱脂牛奶中封阻2 h,加入相应稀释的一抗(ECT2以1∶800稀释,MMP-2和MMP-9均以1∶1 000稀释),4 ℃孵育过夜,洗涤后再加入以1∶3 000稀释的二抗,室温下孵育2 h,采用ECL发光显影,使用Gel Doc凝胶成像仪观察并采集图像,应用Quantity One图像分析软件分析各条带灰度值,以GAPDH作为内参,分别计算各组SW620细胞中ECT2、MMP-2、MMP-9蛋白表达水平。
1.6 Transwell侵袭实验检测SW620细胞的侵袭能力
以无血清的RPMI-1640培养液稀释Matrigel基质胶,取50 μL稀释的Matrigel胶均匀涂抹在Transwell小室的上室,37 ℃培养箱中放置30 min以形成基底膜。收集各组SW620细胞,以无血清培养液重悬细胞,制成浓度为1×105个/mL的细胞悬液。取100 μL细胞悬液加入Transwell小室的上室,取600 μL含10%胎牛血清的培养液加入到Transwell小室的下室,置于37 ℃培养箱中常规培养48 h。以4%多聚甲醛固定Transwell小室滤膜20 min,以0.1%结晶紫染色20 min,用PBS洗去染液,晾干,在显微镜下随机选取5个视野观察并计数穿膜细胞数(取平均值),以穿膜细胞数表示各组SW620细胞的侵袭能力。
1.7 划痕愈合实验检测SW620细胞的迁移能力
将各组SW620细胞以5×104个/孔的密度接种到6孔板中,置于37 ℃培养箱中常规培养,待细胞生长汇合度达90%以上时,使用灭菌的枪头在6孔板中划线(呈直线),用PBS洗去划下的细胞,重复洗涤1次,向每孔细胞中加入不含血清的培养液,置于37 ℃培养箱中培养,分别在0 h和48 h拍照并测量划痕宽度,计算划痕愈合率[划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%]。
1.8 统计学分析
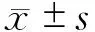
2 结果
2.1 各组SW620细胞中ECT2的mRNA和蛋白表达水平比较
real-time qPCR和Western blotting法检测结果显示,与si-NC组相比,si-ECT2组SW620细胞中ECT2 mRNA和蛋白表达水平均明显降低,差异均有统计学意义(P均<0.05);而Control组与si-NC组之间的差异则均无统计学意义(P均>0.05)。见图1和表2。
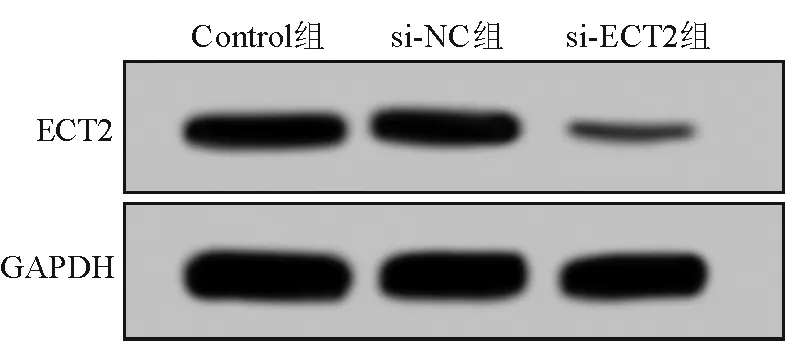
图1 Western blotting法检测各组SW620细胞中ECT2蛋白表达水平

表2 各组SW620细胞中ECT2的mRNA和蛋白表达水平比较()
2.2 各组SW620细胞的侵袭能力比较
Transwell侵袭实验结果显示,与si-NC组[(96.48±9.10)个]相比,si-ECT2组SW620细胞的穿膜细胞数量[(41.36±4.26)个]明显减少,差异有统计学意义(P<0.05);而Control组[(102.05±10.24)个] 与si-NC组之间的差异则无统计学意义(P>0.05)。该结果提示,干扰ECT2基因的表达可抑制SW620细胞的侵袭能力。
2.3 各组SW620细胞的划痕愈合率比较
划痕愈合实验结果显示,与si-NC组[(50.65±4.36)%]相比,si-ECT2组SW620细胞的划痕愈合率[(26.75±3.02)%]明显降低,差异有统计学意义(P<0.05);而Control组[(52.17±4.06)%]与si-NC组之间的差异则无统计学意义(P>0.05)。该结果提示,干扰ECT2基因的表达可抑制SW620细胞的迁移能力。
2.4 各组SW620细胞中MMP-2和MMP-9蛋白表达水平比较
Western blotting法检测结果显示,与si-NC组相比,si-ECT2组SW620细胞中MMP-2和MMP-9蛋白表达水平均明显降低,差异均有统计学意义(P均<0.05);而Control组与si-NC组之间的差异则均无统计学意义(P均>0.05)。该结果提示,干扰ECT2基因的表达可抑制SW620细胞中MMP-2和MMP-9蛋白的表达。见图2和表3。
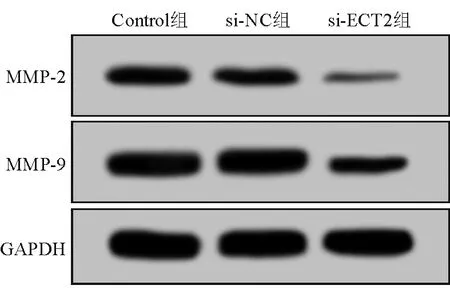
图2 Western blotting法检测各组SW620细胞中MMP-2和MMP-9蛋白表达水平

表3 各组SW620细胞中MMP-2和MMP-9蛋白的表达水平比较()
3 讨论
结直肠癌是常见的恶性肿瘤,近年来年轻人群的结直肠癌发病率呈上升趋势[9]。结直肠癌的治疗方法虽已取得了很大进步,包括手术联合放射治疗和化学治疗,但复发和远处转移导致患者的5年生存率较低,预后较差。目前研究显示,结直肠癌的发生、发展与多种表观遗传学变化及基因改变相关[10]。因此,亟需寻找转移相关基因并确定其在结直肠癌发生、发展中的作用机制,以便获取可靠的生物标志物,为结直肠癌的诊疗提供新靶点。ECT2基因是一种鸟嘌呤核苷酸交换因子,其参与了GTP和GDP的转换,在肿瘤中扮演促癌基因的角色。研究显示,ECT2能影响肿瘤的恶性转型,以及细胞生长、侵袭和转移等多种生物学功能[11]。Shi等[12]的研究显示,ECT2在肺癌组织中呈高表达,并且ECT2表达与肺癌患者的总生存期及无复发生存期呈负相关。乳腺癌细胞中ECT2的mRNA和蛋白表达水平均明显高于乳腺上皮细胞,沉默ECT2基因可抑制乳腺癌MDA-MB-231细胞的增殖,并促进细胞凋亡[13]。人前列腺癌组织中ECT2蛋白表达水平升高,其与临床病理参数、临床分期、肿瘤侵袭和淋巴结转移等指标呈正相关[14]。胃癌组织中ECT2表达水平升高,可通过调节上皮间质转化促进胃癌转移[15]。有研究显示,ECT2表达水平升高提示结直肠癌患者的预后不良[16]。然而,目前关于ECT2对结直肠癌细胞侵袭和迁移的影响及作用机制尚不清楚,本实验就此进行了探究。
本实验以结直肠癌SW620细胞为研究对象,在SW620细胞中转染ECT2特异性siRNA,结果显示ECT2 siRNA能有效干扰SW620细胞中ECT2基因的表达。Transwell侵袭实验和划痕愈合实验结果显示,转染ECT2 siRNA能明显减少SW620细胞的穿膜细胞数量并降低划痕愈合率。结果提示干扰ECT2基因的表达可抑制SW620细胞的侵袭和迁移能力,该结论与乳腺癌、肺癌相关研究的结论相似[17-18]。
MMP是一类可降解细胞外基质中多种成分的蛋白酶家族,其主要功能是破坏肿瘤侵袭的组织学屏障,在肿瘤侵袭和转移中发挥了关键作用[19]。MMP-2和MMP-9是MMP家族的重要成员,在肿瘤侵袭和迁移方面被研究得较多。研究显示,MMP-2和MMP-9在结直肠癌中呈高表达,可增强结直肠癌的迁移、侵袭能力[20]。本实验采用Western blotting法检测SW620细胞中MMP-2和MMP-9蛋白表达水平,结果显示干扰ECT2基因的表达能够下调MMP-2和MMP-9蛋白的表达,这提示干扰ECT2基因的表达可能通过下调MMP-2和MMP-9的表达抑制SW620细胞的侵袭和迁移能力。
综上所述,本实验结果证实了ECT2基因参与了结直肠癌的发生和发展,通过转染特异性siRNA干扰ECT2基因的表达能够抑制SW620细胞的侵袭和迁移能力,作用机制可能与调控MMP-2和MMP-9的蛋白表达有关。本实验初步探究了ECT2基因对结直肠癌细胞侵袭和迁移的影响及可能的作用机制,后续将深入探究具体的作用机制。本研究尚存在不足之处,ECT2上游可能相关的miRNA和下游相关信号通路有待后续实验探究。本实验结果提示ECT2基因可能在结直肠癌靶向治疗中具有一定的临床价值。

