电针对肥胖胰岛素抵抗大鼠胰岛素敏感性及脂肪组织脂联素、抵抗素基因表达的影响❋
王雅媛, 梁凤霞△, 卢 威, 宋燕娟, 任加凤, 周钰点, 黄湘茜, 杨姝瑞
(1.湖北中医药大学针灸骨伤学院,武汉 430061;2.针灸治未病湖北省协同创新中心, 武汉 430061)
肥胖是由于长期的能量摄入与消耗不平衡导致过多脂肪堆积的结果。白色脂肪组织(white adipose tissue,WAT)作为能量存储器官,在维持代谢稳态方面起着至关重要的作用[1]。当机体处于肥胖状态时,WAT会产生过多的非酯化脂肪酸、炎症前因子、脂肪因子等,诱导胰岛素抵抗(insulin resistance,IR)发生[2],提示脂肪因子的分泌失调可能是促使肥胖IR发生的驱动力之一。这些因子以自分泌、旁分泌以及内分泌机制影响机体新陈代谢和炎症反应。如脂联素(adiponectin,ADPN)被认为是与肥胖表型相关的重要基因,与体质量指数和其他肥胖指标呈负相关,同时ADPN还是胰岛素的增敏剂,可提高机体的胰岛素敏感性[3,4]。抵抗素(Resistin)的作用则与之相反,它可降低胰岛素的作用,促使IR发生。研究显示,血清Resistin含量升高会提升肥胖、IR及2型糖尿病的发生风险[5],它被视为代谢综合征的潜在危险因素[6],可见二者在肥胖和IR的发展进程中极为重要[7]。
值得注意的是,肥胖引起的IR是2型糖尿病、心血管疾病和非酒精性脂肪肝的共同危险因素[8,9]。但IR状态并非是不可逆的,当肥胖患者体质量减轻时,血清胰岛素(Insulin,INS)含量下降,胰岛素敏感性随之升高,也降低了代谢综合征的发生几率[10]。因此及时改善IR状态,既可减少肥胖带来的疾病负担,还能提升人们的健康水平和生活质量。目前针对肥胖的药物治疗应用广泛,但其产生的副作用往往不可忽视且价格昂贵,影响临床使用。而针灸因其安全有效越来越广泛地应用于肥胖IR及相关性代谢性疾病的防治中[11,12]。故本实验以胰岛素敏感性及白色脂肪组织ADPN、Resistin的基因表达为切入点,观察电针改善肥胖IR的可能作用机制,为其临床应用提供更多的实验依据。本研究经湖北中医药大学实验动物伦理委员会批准。
1 材料与方法
1.1 动物
SPF级Wistar健康雄性8周龄大鼠40只,体质量(180±20) g,购于武汉春玉红有限公司。饲养于湖北中医药大学实验动物中心SPF级动物房,实验动物许可证号SCXK(鄂)2015-0018,温度(22±2) ℃,相对湿度(50±10)%,12 h明暗周期、自由进食饮水。
1.2 模型的制备与评价
1.2.1 肥胖胰岛素抵抗大鼠模型制备 所有大鼠采用耳标进行标号,标准饮食(总热量3.8 kcal/g)适应性喂养1周后,随机选取10只为正常组,继续标准饮食喂养,余下30只大鼠采用高脂饮食(high-fat diet,HFD)(总热量5.4 kcal/g)喂养。喂饲8周后,最终有23只大鼠符合肥胖胰岛素抵抗(obesity with insulin resistance,OIR)模型标准,从中随机选出20只分为模型组、电针组各10只。所有饲料由武汉春玉红有限公司提供,高脂饲料配方参考文献制作[13]。
1.2.2 评价标准 (1)肥胖标准:HFD喂养大鼠体质量高于标准饮食喂养大鼠体质量平均值的20% 以上[14];(2)IR标准:在正常组及HFD喂养大鼠中各随机挑选3只,行尾部动静脉高胰岛素:正葡萄糖钳夹术检测,计算葡萄糖输注速率(glucose Infusion Rate,GIR)。IR标准为HFD大鼠的GIR值低于正常组大鼠GIR平均值20%以上[15]。
1.3 主要试剂及仪器
大鼠抵抗素酶联免疫吸附测定试剂盒(CSB-E06885r),美国CUSBIO公司;大鼠脂联素酶联免疫吸附测定试剂盒、大鼠胰岛素酶联免疫吸附测定试剂盒(E-EL-R0329c、E-EL-R2466c),武汉伊莱瑞特公司;RNA提取试剂盒 ( 北京Takara公司);RNA逆转录试剂盒、荧光定量试剂盒(740900、QRT-201),上海Toyobo公司;胰岛素,天津诺和诺德公司;葡萄糖溶液,湖南科伦制药有限公司;盐酸利多卡因,山东鲁抗辰欣公司;静脉留置针(26 G),丹麦古氏公司;双通道微量注射泵(WZ-50C6),上海软隆科技发展有限公司;血糖仪(580),江苏鱼跃公司;精密电子秤(SF-400A),上海志荣电子科技公司;针灸针(0.25×25 mm),北京中研太和医疗器械有限公司;韩式电针仪(2000HANS),北京华威科技有限公司;微型高速离心机(C2500-R-230V),美国Labnet公司;电热恒温培养箱(ICV-450),日本ASONE公司;FlexStation 3多功能酶标仪(Flexstation3),美国Molecular Devices公司;实时荧光定量PCR仪(CFX96),美国Bio-Rad公司。
1.4 干预方法
OIR模型大鼠造模成功后,正常组继续给予标准饮食喂养,余下组别继续给予HFD喂养,共饲喂8周。此外,电针组还给予电针同步干预。
电针干预:抓取大鼠穿上自制鼠衣,暴露腹部及下肢部皮肤,待大鼠平静后,选取“关元”“中脘”、同侧“足三里”和“丰隆”进行针刺,穴位的定位及针刺深度依据《实验针灸学》[16]。将“中脘”和“关元”连接一组电针,同侧“足三里”及“丰隆”穴连接一组电针(两穴左右两侧交替使用),连接韩式电针仪,频率2 Hz,强度1 mA,连续波,刺激强度根据局部肌肉收缩情况决定,每次留针20 min,隔日干预1次,每周3次,连续8周。以上电针参数皆参考文献[17]及课题组前期多次实验后决定。正常组和模型组大鼠在电针干预期间同样抓取固定但不干预。
1.5 标本取材
新鲜组织在取材前禁食不禁水12 h,采用10%水合氯醛(3 mL/kg)腹腔注射麻醉,待大鼠麻醉完全后心尖取血获取血液样本,将血液样本迅速转入4 ℃冰箱保存。取血后处死,快速剪取腹部WAT分装至EP管中,并迅速放入液氮中速冻,再转至-80 ℃冰箱中保存备用。
灌注取材前准备同上。待大鼠麻醉完全后,打开胸腔暴露心脏,用12号灌胃针插入大鼠左心室到达主动脉,用血管夹夹住灌注生理盐水,直至大鼠双肺双眼快速变白后停止输注生理盐水,转接4%多聚甲醛直至鼠尾变硬停止灌注。剪取腹部周围的WAT放置于装有4%多聚甲醛的标本瓶中。
1.6 检测指标
1.6.1 体质量、Lee’s指数检测 在干预前0周、干预后2、4、6、8周的最后1 d的同一时间段(上午8∶30)检测各组大鼠体质量和肛鼻长。Lee’s指数=(体质量×1000)1/3/肛鼻长。
1.6.2 GIR检测 干预8周后每组随机选取3只大鼠行钳夹术(提前禁食8 h)。首先用自制鼠套固定大鼠并暴露鼠尾,在尾部皮下环形注射2%的利多卡因进行麻醉,待麻醉完全后分别挑出动脉及静脉,插入静脉留置针(规格:26 G),动脉所插留置针头连接装有50 μ/mL的肝素注射器,静脉所插留置针头的一个通道连接胰岛素注射液(浓度50 mU/mL),另一通道连接30%葡萄糖溶液,并将这2个通道连接微量注射泵的2个通道,插管完成后静置30 min(缓解插管导致的应激反应)。然后取动脉血测定基础血糖值,紧接着以0.25 μ/kg·h的恒定速度输入胰岛素溶液,5 min后再次测量血糖值,若血糖值≤基础血糖的0.5 mmol/L开始泵入葡萄糖注射液,每隔5 min检测1次血糖,通过不断调整GIR,使血糖保持在基础血糖±0.5 mmol/L范围以内,若连续3次所测值均在上述范围内则血糖趋于稳态,计算达到稳态后60~120 min的GIR的平均值。
1.6.3 空腹血糖、餐后血糖、腹腔糖耐量(introperitoneal glucose tolerance test,IPGTT)及腹腔胰岛素耐量(introperitoneal insulin tolerance test,IPITT)检测 所有血糖值均由专人用快速血糖仪检测。在干预前后的同一时间段(上午8∶30),分别检测空腹血糖(禁食不禁水12 h)及餐后血糖(不禁食不禁水)。IPGTT在干预后的第6周检测,先测得空腹血糖即为0 min血糖值,然后根据大鼠体质量腹腔注射50%葡萄糖(剂量2 g/Kg),在注射后的第30、60、90、120小时测量血糖并记录。IPITT则是根据大鼠体质量腹腔注射胰岛素(剂量:1U/Kg),其余检测步骤同IPGTT。并采用近似梯形法[18]计算IPGTT和IPITT的曲线下面积(area under the curve,AUC) :AUC=30 min×[1/2×( BG0 +BG120) + 1×( BG30 + BG60 + BG90)]。
1.6.4 血清INS、ADPN、Resistin含量检测 各组大鼠处死前心尖取血获取血液样本。按试剂盒说明书操作,采用 ELISA 法测血清INS、ADPN、Resistin含量。
1.6.5 WAT中ADPN、Resistin的mRNA水平检测 采用RT-PCR法检测,剪取100 mg WAT提取总RNA,其中2 μl作为RNA浓度测定,纯度OD260/OD280值在1.9~2.2时浓度为可取值。依次配制热变性体系、逆转录体系,在PCR 仪中进行逆转录获取cDNA,保存在-20 ℃冰箱中。按照扩增体系配方进行DNA扩增,每组样本3个复孔,并以β-Actin 作为内参引物,通过2-ΔΔCt法计算 ADPN、Resistin mRNA的相对表达水平。引物由武汉巴菲尔公司设计合成,序列如下。

表1 PCR引物序列
1.6.6 WAT形态学观察 采用HE染色,将取材备用的WAT固定并切取平整,经过脱水、透明、包埋、切片、烤片、脱蜡、水化、苏木素染色、脱水、透明、封片后,于200倍视野的电镜下观察并拍照,数出视野中的脂肪细胞个数,然后在同一视野中挑选10个相对较大的脂肪细胞,测量其直径并取平均值。
1.7 统计学方法
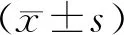
2 结果
2.1 各组大鼠体质量、Lee’s指数比较
图1A与1B示,在干预前0周,模型组及电针组的体质量、Lee’s指数均显著高于正常组(P<0.01) ,模型组与电针组比较差异无统计学意义(P>0.05) ,表明二者具有同质性,可进行统计学比较。在干预期间,各组大鼠的体质量均逐步增加,从第6周开始电针组大鼠体质量显著低于模型组(P<0.01),Lee’s指数在第8周显著低于模型组(P<0.01)。
注:与同时段正常组比较:*P<0.01;与同时段模型组比较:#P<0.05,##P<0.01
2.2 各组大鼠GIR 、空腹血糖、餐后血糖、血清INS含量比较
图 2A示,HFD喂养大鼠的GIR水平显著低于标准饮食喂养的正常组大鼠(P<0. 01),说明OIR大鼠全身胰岛素敏感性降低。治疗后,电针组GIR数值较模型组升高(P<0. 01),且较干预前也升高(P<0. 05),说明电针可改善OIR大鼠全身胰岛素敏感性。图2B示,各组大鼠干预前后的空腹血糖比较差异无统计学意义(P>0. 05)。图2C和2D示,干预前模型组及电针组大鼠餐后血糖含量均较正常组升高(P<0. 05),干预后模型组大鼠餐后血糖、血清INS含量(图2D)仍显著高于正常组(P<0. 01),而与模型组比较,电针组还可以降低餐后血糖值(P<0. 05)以及血清INS含量(P<0.01)。

注:与同时段正常组比较:*P<0.05,**P<0.01;与同时段模型组比较:#P<0.05,##p<0.01;与干预前比较:△P<0.05
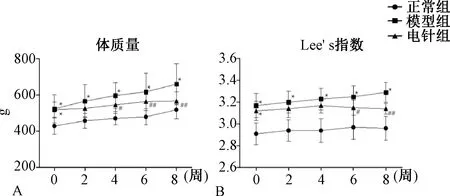
2.3 各组大鼠IPGTT、IPITT比较
图3A与3C示,各组大鼠腹腔注射葡萄糖30 min后,血糖水平迅速升高达到峰值,然后逐渐降低。模型组大鼠IPGTT水平在第30~120分钟血糖均显著高于正常组(P<0. 01),且IPGTT-AUC也较正常组显著增加(P<0. 01);而经过电针干预后,第30~120分钟 IPGTT水平、IPGTT-AUC低于模型组(P<0. 05)。图3B与3D示,各组大鼠腹腔注射胰岛素后血糖逐渐下降,在第60分钟达到最低值随后开始回升。与正常组比较,模型组大鼠IPITT水平在第30~120分钟血糖值均显著升高(P<0. 01),且IPGTT-AUC也表现出升高趋势(P<0. 01);与模型组比较,电针组可降低第30~120分钟血糖水平(P<0.05)以及IPITT-AUC(P<0. 01),提示电针能够调节OIR大鼠的IPGTT和IPITT水平,增强外周胰岛素敏感性。
注:与同时段正常组比较:**P<0.01;与同时段模型组比较:#P<0.05,##P<0.01
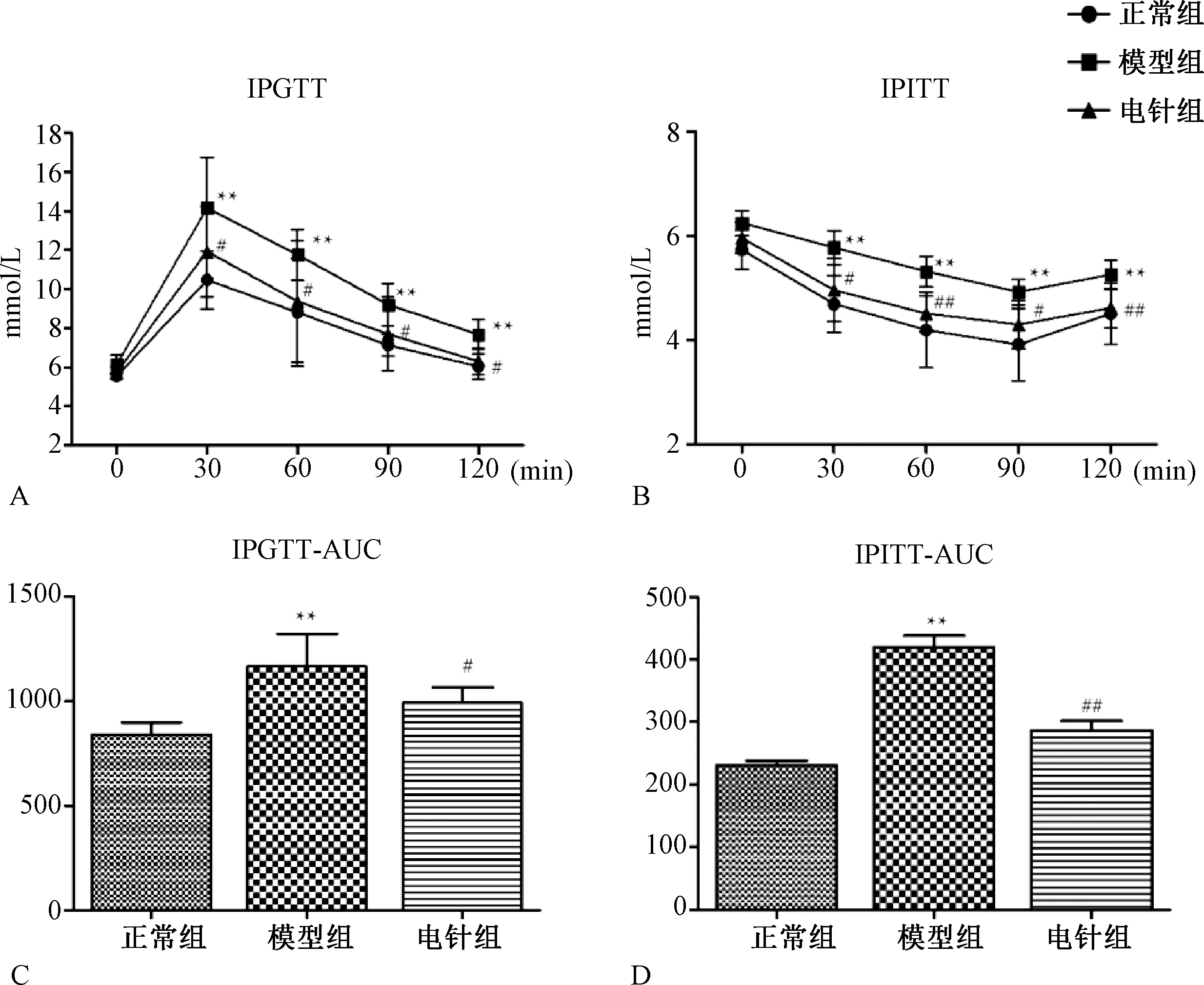
2.4 各组大鼠血清ADPN、Resistin含量比较
图4A与4B示,与正常组比较,模型组血清ADPN水平出现明显下降(P<0.01) ,而Resistin水平显著上升(P<0.01)。与模型组比较,电针干预后大鼠的血清ADPN水平出现回升(P<0.01) ,Resistin水平下降显著(P<0.01)。
注:与正常组比较,**P<0.01;与模型组相比,#P<0.05,##P<0.01
2.5 各组大鼠WAT中ADPN、Resistin mRNA相对表达水平比较
图4C示,模型组大鼠WAT中ADPN mRNA较正常组减少(P<0.01),Resistin mRNA增多(P<0.01);与模型组比较,电针组可以上调ADPN的基因表达(P<0.01),下调Resistin表达(P<0.05),表明电针刺激可以有效调节WAT中ADPN、Resistin的基因表达。
2.6 各组大鼠WAT形态学比较
图5示,正常组大鼠白色脂肪细胞大小均匀,呈蜂窝状圆形,结构较完整。与正常组比较,模型组细胞个数减少(P<0.01),细胞直径显著增加(P<0.01);电针治疗后,其细胞个数显著增加(P<0.01),细胞直径减小(P<0.05),提示电针具有减小肥大脂肪细胞体积的作用。

注:与正常组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
3 讨论
IR是肥胖发展成2型糖尿病的关键病理基础[19],早期干预肥胖IR状态,可有效预防2型糖尿病等疾病的发生发展,防患于未然。在本实验中笔者发现,与模型组比较电针干预后OIR大鼠体质量、Lee’s指数显著降低,提示电针可有效减轻体质量,改善肥胖表型。且大鼠餐后血糖、IPITT、IPGTT水平也低于模型组,GIR显著升高,说明电针刺激还能增强OIR大鼠的胰岛素敏感性。脂肪组织是胰岛素的重要靶器官,与肥胖IR状态密切相关。其中WAT可通过将具有生物活性的脂肪因子释放到血液中,调节各种代谢过程,包括新陈代谢和葡萄糖稳态[20]。如Resistin是调节葡萄糖稳态的重要脂肪因子,研究发现肥胖小鼠循环Resistin含量明显升高,且与胰岛素、血糖水平呈正相关[21]。这可能与Resistin降低胰岛素受体及受体底物-1 (Insulin receptor substrate, IRS-1)的磷酸化水平,从而减弱磷脂酰肌醇-3激酶 (phosphatidylinositol-3-kinase, PI3K)的激活,诱使IR发生有关[22]。且Resistin还可导致胰岛素信号抑制剂细胞因子信号传导抑制剂3(suppressor of cytokine signaling 3, SOCS-3)的基因表达增加[23]。
ADPN则是由WAT产生的有益脂肪因子,它可调节胰岛素靶组织中碳水化合物和脂肪代谢[24],包括减少肝脏中葡萄糖的合成,增加肌肉中葡萄糖的摄取及脂肪酸的氧化[25]。其作用的发挥与ADPN受体(adiponectin receptor,AdipoR)密不可分。如AdipoR2可诱导过氧化物酶体增殖物激活受体 α(peroxisome proliferators activated receptor-α,PPARα),从而增加葡萄糖摄取和脂肪酸氧化,减轻炎症和氧化应激反应[26]。在肥胖和胰岛素抵抗人体内,ADPN循环水平和分泌率显著降低[27]。而低水平的ADPN还可激活下丘脑-垂体-性腺激素轴(hypothalamic pituitary gonadal,HPG),促使肥胖的早期发作[28]。本实验发现,与HFD诱导的OIR模型大鼠比较,电针组可增加WAT中ADPN mRNA表达,降低Resistin mRNA水平,且血清ADPN、Resistin含量也随之变化。提示电针对WAT中脂肪因子ADPN、Resistin的调节作用可能是有效改善肥胖IR的机制之一。
同时实验表明,在HFD的诱导下,模型组大鼠WAT细胞直径显著大于正常组,这是由于WAT在能量存储中起着至关重要的作用。当机体摄取能量过多时,体内脂肪细胞会出现增生和肥大。而肥大脂肪细胞还可导致脂肪细胞因子分泌失调,进一步加速肥胖IR的发展。已有研究表明,血浆中的脂肪细胞因子水平随着脂肪组织与脂肪细胞体积的增加而升高[29]。在本实验中,模型组大鼠WAT细胞直径增加,WAT中Resistin mRNA随之上升,与前期报道一致[29]。但ADPN水平却表现出相反趋势,这可能是由于脂肪细胞肥大时会释放出更多的游离脂肪酸与巨噬细胞toll样受体4结合,加重慢性炎症反应,表现出高水平的循环炎症细胞因子(如TNF-α和IL-6),而IL-6抑制ADPN的表达[29],导致WAT中ADPN基因表达减少。还有研究表明,当脂肪细胞膨胀时血流灌注不足,随之而来的局部组织缺氧致使脂肪细胞中的纤维化和内质网应激反应,与ADPN基因的下调也具有相关性[30],可见WAT细胞大小可能是脂肪因子分泌的重要因素之一。在经过电针治疗后,WAT细胞直径较模型组明显减小,且WAT及血清中Resistin及ADPN含量均趋向正常化也印证了这一点。
综上所述,电针可减轻HFD诱导的OIR大鼠体质量,增强胰岛素敏感性,改善IR状态,其可能机制与电针减小肥大脂肪细胞体积,调节WAT中Resistin及ADPN的分泌水平相关。

