基于网络药理学可视化及实验验证益肾补血中药治疗前列腺癌的作用机制研究❋
刘 伟, 刘平安, 杨 磊, 郭 璇△, 李 媛, 唐旖雯, 刘德果
(1.湖南中医药大学,长沙 410208;2.湖南中医药大学第一附属医院,长沙 410000)
据世界卫生组织(worldhealth organization,WHO)公布的流行病学最新数据显示,前列腺癌(prostate cancer,PCa)发病率高居男性恶性肿瘤的第二位,病死率位居第三位,而多数患者发病年龄在55~80周岁之间[1]。在我国,2007年男性PCa的发病率为8.31/10万,至2017年其发病率上升至17.63/10万,10年间每年增长幅度为21.22%[2],提示中国该病的发病率正持续快速增长,而中老年人群(55~80周岁)的年均增长幅度高达26.38%[3],但目前尚无确切有效的治疗手段[4]。诸多研究表明,中医药在改善PCa患者具体症状、调控其精神心理状态等方面具有明显的疗效[5]。胡杨等[6]研究表明,中药可能是通过多靶点、多通路调控细胞周期,促进细胞凋亡治疗恶性肿瘤,采用网络药理学方法可将中药治疗疾病的数据进行可视化分析。
中医古籍并无本病的记载,但根据其临床表现及病机属于中医学“癥瘕”“癃闭”“尿血”等范畴[6]。中医学认为PCa病在男性之精窍,与肾、脾、肝等脏密切相关。安婉丽[7]等借助关联规则分析、复杂系统熵聚类分析等数据挖掘方法,对治疗PCa的方剂进行挖掘,其中益肾补血类药物出现频次占总药物频次的76%,其中尤以淫羊藿、三七、当归等药物为最。淫羊藿可益精气、补命门之火,为温阳补肾之要药;三七可活血祛瘀、益气通络;当归可补血活血,三药合用温阳活血、扶正祛邪,治疗PCa符合《难经·五十五难》:“积者,阴气也”[9],以及《素问·调经论》:“血气者,喜温而恶寒,寒则泣而不能流,温则消而去之”对恶性肿瘤的论述。前期临床研究表明,以益肾补血中药为主要药物的方剂,可有效抑制PCa进展及转移,但其具体作用机制尚未明确[10]。为明确益肾补血中药治疗PCa的生物学机制,本文基于网络药理学研究方法,对益肾补血中药治疗PCa的的生物学物质基础及药效机制进行预测,并借助细胞实验进行验证,以期对益肾补血中药治疗PCa的科学内涵进行探讨,同时为阐明益肾补血中药治疗PCa的具体机制提供新思路及新方法。
1 材料与方法
1.1 网络药理学预测部分
1.1.1 筛选益肾补血中药有效活性成分与药物靶点基因 本研究借助中药系统药理学分析平台(TCMSP)(http://tcmspw.com/)及中医药综合数据库(TCMID)(http://www.megabionet.org/tcmid/)等检索3味经典益肾补血中药(淫羊藿、三七、当归)的药物有效活性成分与药物靶点基因。TCMID数据库作为备用数据库,若药物未收录在TCMSP数据库时采用此数据库进行筛选[11]。筛选标准为OB>30%,DL>0.18,HL>4 h。之后选择TCMSP数据库的“Related Targets”模块,得到上述药物的所有药物靶点基因。
1.1.2 获取PCa疾病靶点基因 以“Prostate cancer”为关键词,在GeneCards数据库(https://www.genecards.org)以及在线人类孟德尔遗传数据库(OMIM)(https://omim.org/)中进行检索。在完成关键词检索后将上述2个数据库获得的PCa相关基因进行合并,剔除重复项后建立“PCa疾病靶点基因数据库”备用。将上述药物的靶点基因与PCa疾病靶点基因进行映射,获得益肾补血中药治疗PCa的靶点基因。
1.1.3 “药物-疾病-靶点”网络构建与分析 借助Cytoscape 3.6.1软件将益肾补血中药治疗PCa的靶点基因和步骤1.1.2筛选获得的药物活性成分进行映射,构建“成分-靶点”网络;借助STRING平台(https://string-db.org)及CentiScape插件对蛋白质-蛋白质间的关系进行分析,构建蛋白-蛋白相互作用(PPI)网络,展示其中的关键靶基因。
1.1.4 基因功能注释(gene ontology,GO) 和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)富集分析 借助Enrichr数据库,经校正后P值(Adjusted P-value)<0.01、关联度(Degree)>15的作用进行GO富集分析及KEGG富集分析,进而预测益肾补血中药治疗PCa的可能药效机制。
1.2 细胞实验验证部分
1.2.1 细胞系与细胞培养 人PCa LNCaP细胞购自中国科学院细胞库(目录号:TCHu173)。LNCaP细胞于37 ℃、5% CO2培养箱环境中用含10%胎牛血清的McCoy's5A培养基进行培养。
1.2.2 药物制备与给药 本研究所使用的益肾补血中药(淫羊藿、三七、当归)全部购于湖南中医药大学第一附属医院中药房,均为道地药材,按1∶1∶1的比例分别取15 g,将所有中药加入10倍量的水煎煮2次,每次1.5 h。过滤,滤液旋转蒸发浓缩,按照生药剂量使终末浓度为1.5 g/ml(1倍等效人体剂量),调整pH7.2,过0.22 μm滤膜除菌,-20 ℃冰箱保存。实验前加入McCoy's5A培养基中,稀释至所需要浓度。研究组将人PCa LNCaP细胞共设置4组,分别为模型组、中药高剂量组、中药中剂量组、中药低剂量组,其中模型组为PCa LNCaP细胞给予等浓度的McCoy's5A培养基,中药高、中、低剂量组分别为PCa LNCaP细胞给予3.0 g/ml/d(2倍等效人体剂量)、1.5 g/ml/d(1倍等效人体剂量)、0.75 g/ml/d(0.5倍等效人体剂量)的益肾补血中药培养基。各组细胞均于干预72 h后进行检测。
1.2.3 细胞增殖测定 利用Kit-8 细胞计数试剂(cell counting kit-8,CCK8)[12]测定益肾补血中药对LNCaP细胞增殖及活力的影响。具体步骤为:将LNCaP细胞悬浮于含10%胎牛血清的培养基中,接种于96孔板(2000细胞每孔)中,进行培养24 h(37 ℃,5% CO2)后,加入10 μl不同浓度的益肾补血中药培养基,同时添加10 μl CCK8溶液。孵育4 h后利用Spectra Max吸光度读取器检测在450 nm处的吸光度。
1.2.4 细胞周期测定(PI法[13]) 各组细胞在干预72 h后采集LNCaP细胞,以800 r/min离心5 min,采集沉淀物弃上清液,洗涤后加入预冷75%乙醇进行固定,之后添加400 μl溴化乙锭(PI,50 μg/mL),100 μl RNase A(100 μg/mL),4 ℃避光孵育30 min。以标准程序用流式细胞仪检测,结果用细胞周期拟和软件ModFit分析。
1.2.5 细胞凋亡测定(Annexin V&PI双染色法[14]) 各组细胞在干预72 h后采集LNCaP细胞,洗涤后用100 ul的标记溶液重悬细胞,室温下避光孵育10~15 min。再次离心后取沉淀细胞加入荧光(SA-FLOUS)溶液4 ℃下孵育20 min,避光并不时振动。以标准程序用流式细胞仪检测,结果用细胞周期拟和软件ModFit分析。
1.2.6 Western blotting 从各组的人PCa LNCaP细胞中提取蛋白裂解物,利用放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)蛋白裂解液进行裂解、高速(12000 r/min)离心15 min,用移液器抽取上清液,以蛋白质定量(bicinchoninic acid,BCA)法对蛋白浓度进行测定。完成上样步骤后进行电泳(浓缩胶电压设置80V,跑至分离胶时更换为120V,条带进行至尾部时停止)。5%胎牛血清白蛋白37 ℃封闭1.5 h,洗膜后滴加蛋白依赖性激酶-4(cyclin-dependent kinases-4,CDK4)、CDK6、BCL2-Associated X的蛋白质(Bax)、B淋巴细胞瘤-2基因(Bcl-2)以及间接靶点蛋白依赖性激酶-2(cyclin-dependent kinases-2,CDK2)、细胞周期蛋白D1(cycline D1)及细胞周期蛋白E1(cycline E1),一抗4 ℃孵育过夜,二抗37 ℃孵育1.5 h最后显影,显影结果用Image Lab软件进行灰度值分析。
1.3 统计学方法
2 结果
2.1 益肾补血中药治疗PCa靶点的预测结果
2.1.1 药物筛选结果 表1示,获取益肾补血中药共374个化合物成分,其中淫羊藿130个,三七119个,当归125个。以OB>30%,DL>0.18,HL>4 h为条件进行筛选,去重后共获得24个益肾补血中药主要活性成分。选取“Related Targets”模块,获得1620个淫羊藿、716个三七、865个当归的活性成分对应的靶点基因,结合相关文献报道筛选后获得益肾补血中药药物靶点共198个。
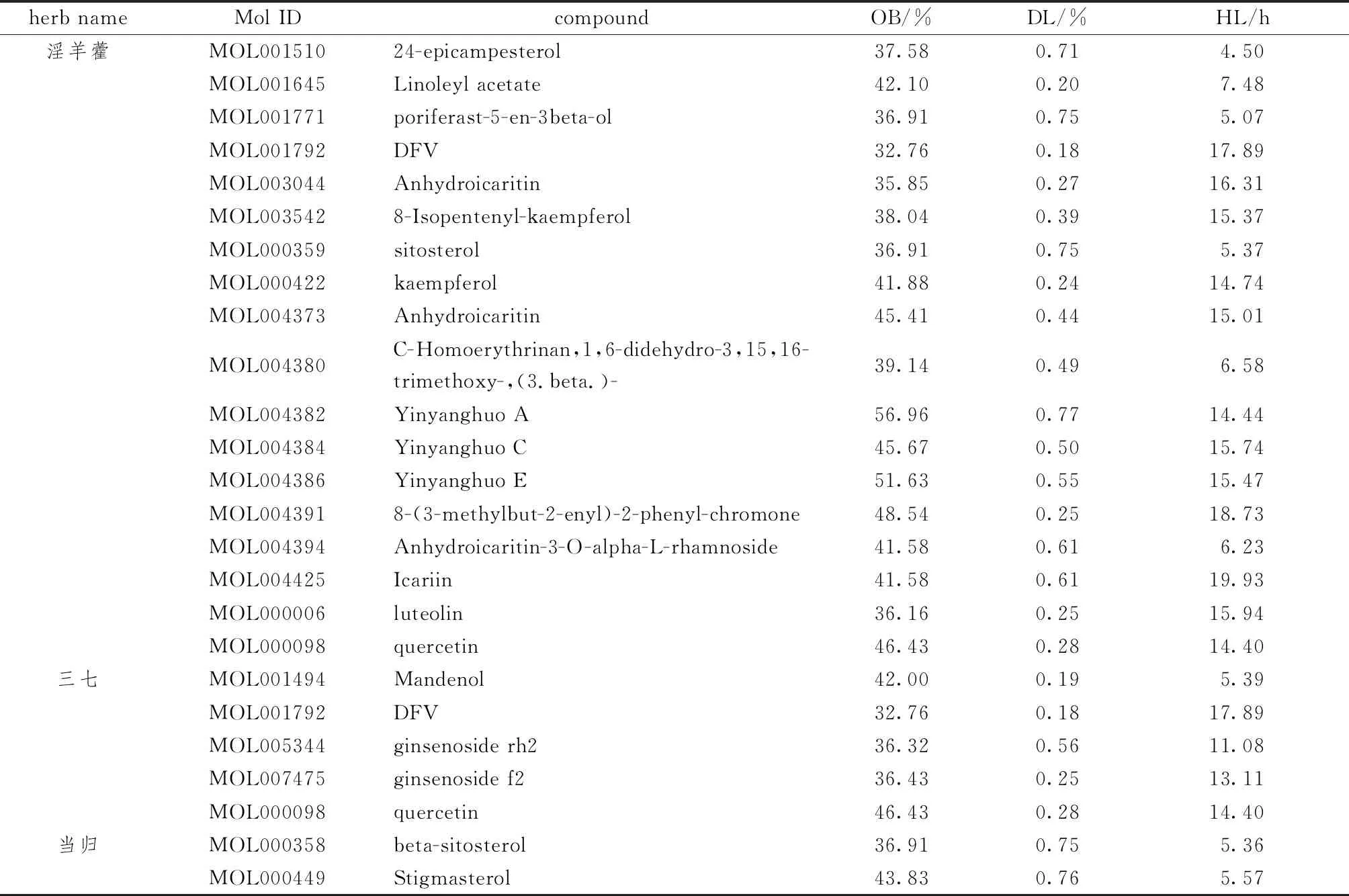
表1 益肾补血中药的主要有效活性成分
2.2 PCa 疾病靶点基因获取
图1示,在GeneCards及OMIM数据库检索关键词“Prostate cancer”,结合相关文献报道共筛选出2829个PCa疾病靶点基因。将益肾补血中药的药物靶点基因与 PCa 疾病靶点基因进行映射,共获得148个益肾补血中药治疗PCa的靶点基因。
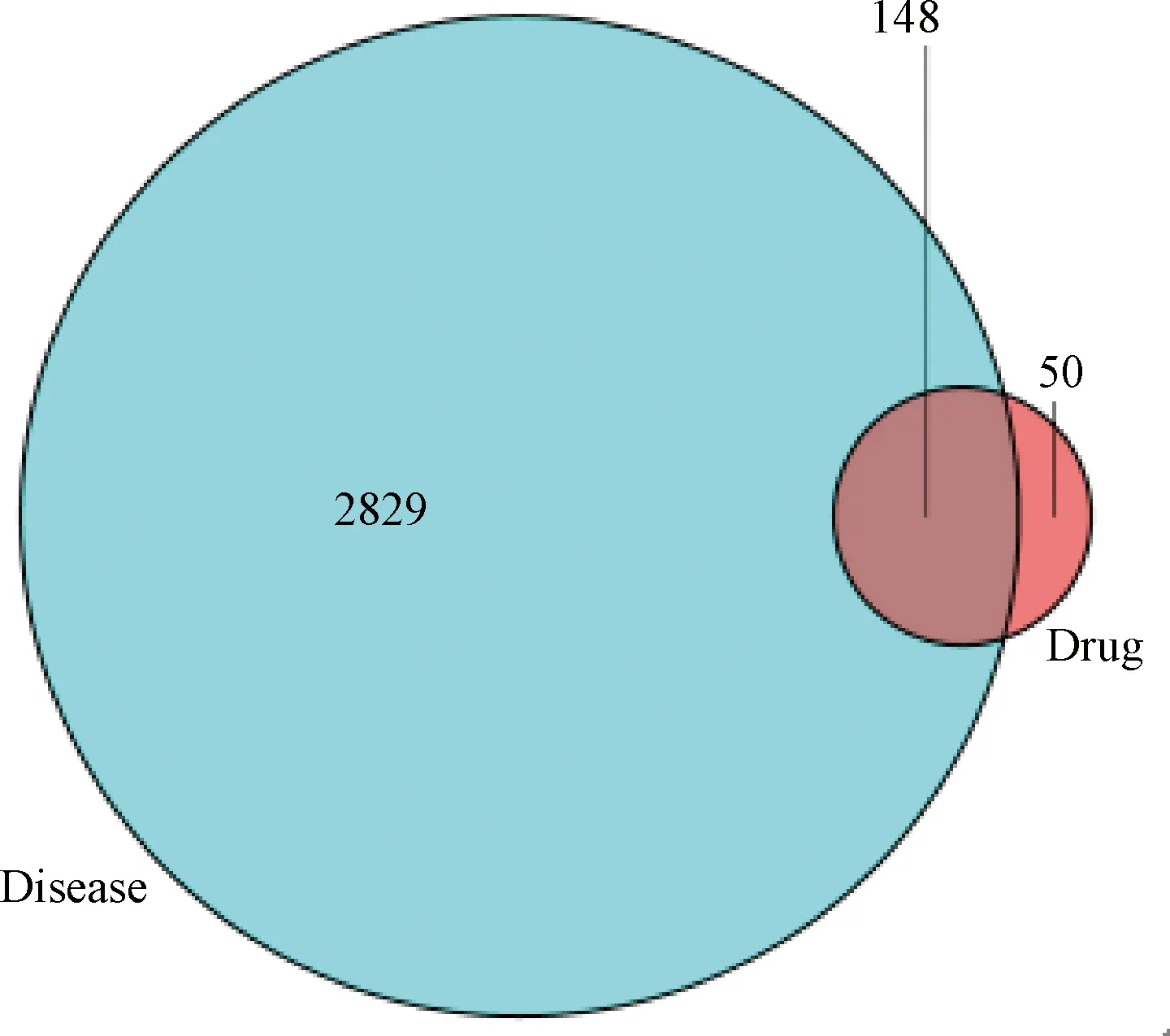
注:益肾补血中药活性成分对应的靶点基因与 PCa 相关基因有148个共同靶基因
2.3 “药物-疾病-靶点”网络与PPI网络构建
图2示,将益肾补血中药与对应活性成分(Ingredient_Drug)、活性成分与关键靶基因(Ingredient_Target)、关键靶基因与疾病靶点对应关系(Disease_Target)及属性导入到Cytoscape,构建“药物-疾病-靶点”网络。使用CentiScape插件计算药物活性成分DC,节点的DC越大提示该节点在网络中权重越大。其中Quercetin(槲皮素)为71,luteolin(木犀草素)为47,keampferol(山奈酚)为31,Anhydroicaritin(脱水淫羊藿素)为27,8-Isopentenyl-kaempferol为12,位于前五位,提示益肾补血中药具有较显著的抗氧化应激、调控细胞周期、促进细胞凋亡以及调节免疫功能作用,与相关文献报道一致[17,18]。
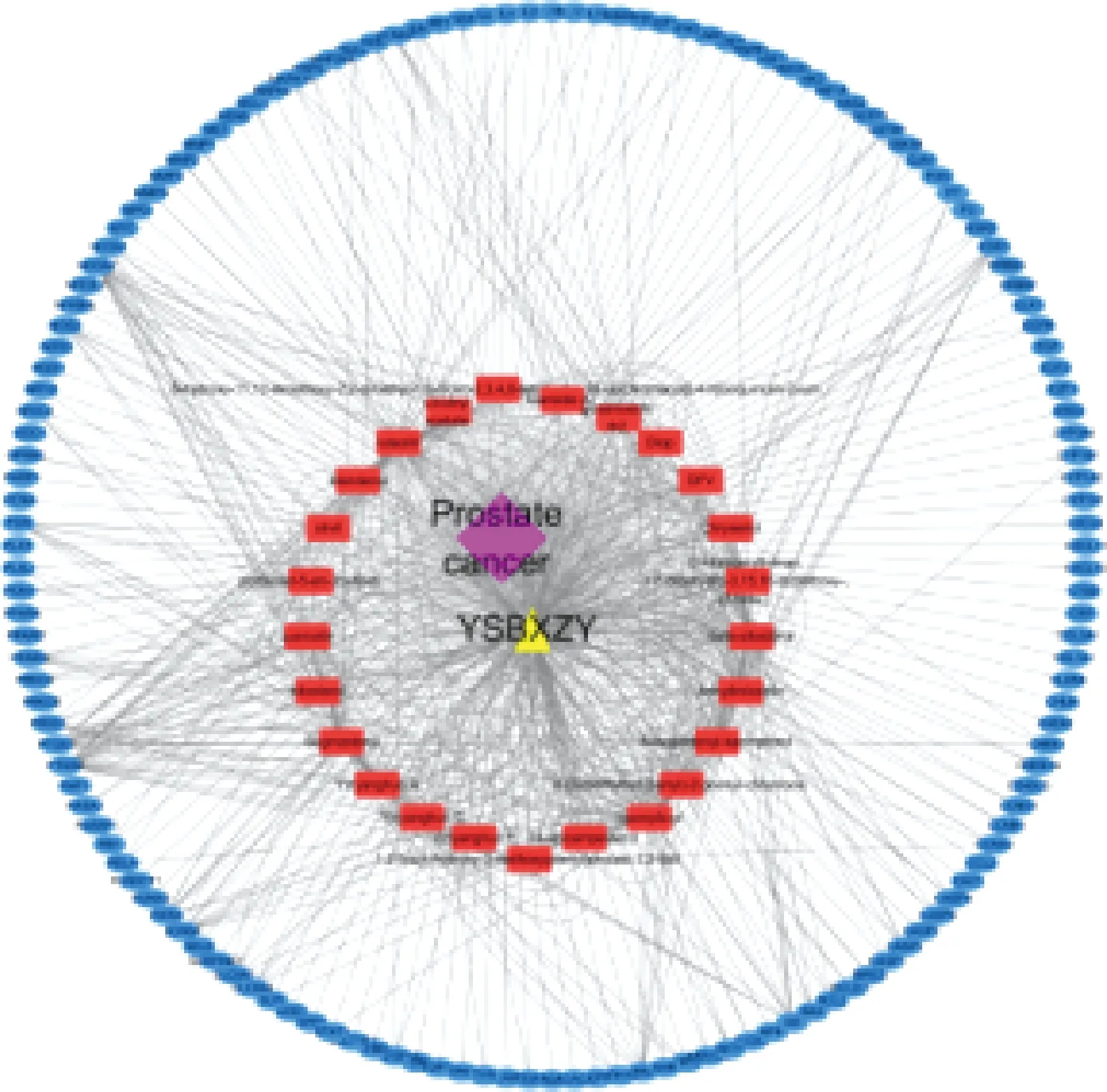
注:粉红色菱形为疾病,黄色三角形为益肾补血中药,红色长方形为益肾补血中药活性成分,蓝色椭圆形为关键靶基因,灰色连线代表各节点间相互关系
图3示,基于PPI关系,研究构建了益肾补血中药潜在靶点的PPI网络,得到Degree≥50的蛋白有40个,包括AKT1、IL6、VEGFA、CASP3、JUN、EGFR、MAPK1、MYC、MAPK8、CDK2、Bax、ESR1、CCND1、MMP9、CXCL8、IL1B、FOS、CDK4、CCL2、MMP2、IL10、MAPK14、RELA、AR、BCL2(Bcl-2)、CASP8、CyclinD1、ICAM1、IL4、SERPINE1、STAT1、HMOX1、IL2、SPP1、CDKN1A、HIF1A、NOS3、KDR、MDM2、VCAM1。

图3 PPI网络图
2.4 GO生物过程与KEGG通路富集分析
图4示,为更进一步研究益肾补血中药治疗 PCa 的作用机制,笔者对前述步骤筛取的核心靶点进行GO功能富集分析。通过GO功能富集分析笔者共富集到包括“regulation of apoptotic process”“cyclin-dependent protein serine/threonine kinase regulator activity”“regulation of cell proliferation”在内的涉及细胞周期、凋亡、增殖等生物学过程的114个GO条目,经校正排序后对位于前20的生物过程进行条形图展示。

图4 关键靶点基因GO功能富集分析
图5示,基于KEGG富集结果,剔除重复数据及与 PCa 无关的信号通路,最终确定34条信号通路,经校正排序后对位于前20的生物过程进行条形图展示。
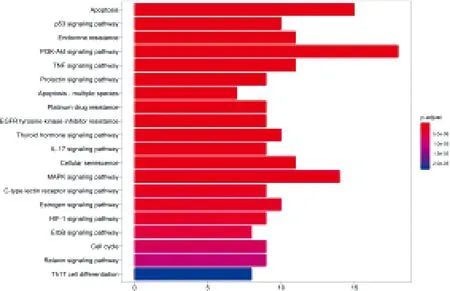
图5 关键靶点基因 KEGG通路富集分析
2.5 益肾补血中药干预人PCa LNCaP细胞增殖、凋亡及周期情况
为进一步评估益肾补血中药对人PCa LNCaP细胞增殖、凋亡及周期的具体作用,笔者设置不同剂量的益肾补血中药干预人PCa LNCaP细胞。药物干预72 h后结果表明,益肾补血中药能有效抑制人PCa LNCaP细胞的增殖并促进PCa LNCaP细胞凋亡(图6 A,B)。益肾补血中药诱导的人PCa LNCaP细胞凋亡率(坏死细胞+凋亡细胞/细胞总数)在不同剂量的培养下呈现累积趋势,在益肾活血中药分别处于低、中、高剂量时,分别为模型组LNCaP细胞凋亡(9.88%)的1.50倍(14.82%)、1.62倍(16.05%)以及2.18倍(21.56%)(P<0.01)(具体见图6C、D)。同时随着药物浓度上升,LNCaP细胞周期阻滞及细胞凋亡高峰随之上升,经干预后各组LNCaP细胞的周期分布存在显著差异(P<0.05),在益肾活血中药分别处于低、中、高剂量时,较模型组LNCaP细胞在G0/G1段分别增加11.63%、17.99%和26.32%,S段减少9.36%、12.80%、16.59%,G2/M段减少2.27%、5.19%、9.73%(具体见图6E、F)。

注:A.各组PCa LNCaP细胞增殖情况;B.与模型组比较:*P<0.05;与中药低剂量组比较:**P<0.05;与中药中剂量组比较:***P<0.05;C.各组PCa LNCaP细胞凋亡情况;D.与模型组比较:*P<0.05;与中药低剂量组比较:**P<0.05;与中药中剂量组比较:***P<0.05;E.各组PCa LNCaP细胞周期测定;F.与模型组比较:*P<0.05;与中药低剂量组比较:**P<0.05;与中药中剂量组比较:***P<0.05
2.5 益肾补血中药对人PCa LNCaP细胞增殖、凋亡及周期相关蛋白表达的抑制作用呈剂量依赖性
图7示,为验证上述网络药理学结果,通过Western blot法对调控人PCa LNCaP细胞周期及凋亡相关蛋白进行验证,包括细胞周期及凋亡直接靶点Bax、Bcl-2、CDK2、CDK4、CDK6、Cyclin D1及Cycline E1,笔者设置不同剂量的益肾补血中药干预人 PCa LNCaP细胞72 h后,观察调控人 PCa LNCaP细胞周期及凋亡相关蛋白表达水平的动态变化。结果提示,CDK2、CDK4、CDK6、Bax、Bcl-2、Cycline E1等蛋白随益肾补血中药剂量而出现不同程度的降低,但cycline D1蛋白呈相反趋势改变,提示益肾补血中药对人 PCa LNCaP细胞周期及凋亡相关蛋白表达的抑制作用呈剂量依赖性。
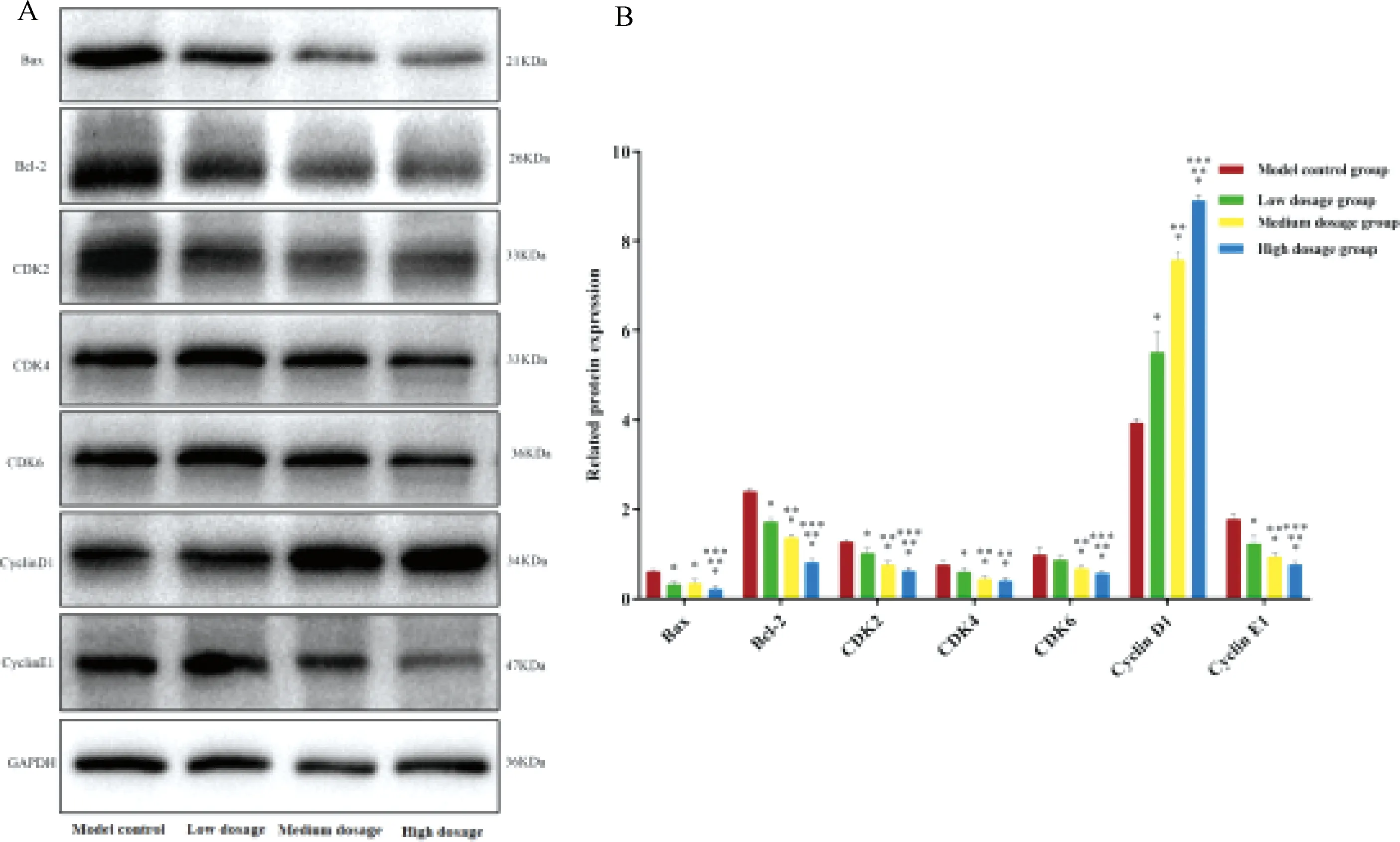
注:A.Western blot结果;B.与模型组比较:*P<0.05;与中药低剂量组比较:**P<0.05;与中药中剂量组比较:***P<0.05
3 讨论
现阶段随着对PCa的研究不断取得进展,其庞杂的发病及治疗机制逐渐被揭示,PCa的发生机制主要包括肿瘤雄激素受体机制、干细胞形成机制、细胞周期调控以及炎性刺激相关机制等[15]。但在 PCa 的治疗上,针对本病的靶点药物仍处于探索阶段,较长时间的去势治疗易致本病转化为激素非依赖性PCa,同时易出现各类临床不良反应且易复发[16]。中医药在改善PCa患者具体症状、调控其精神心理状态等方面具有明显的疗效,运用中药治疗PCa在某些方面具有一定优势[17,18]。然而,中药存在多有效成分、多靶点的特征,各药物活性成分间相互交集及作用形成了庞杂的相互作用网络,所以给研究者探究其治疗有效成分及相关机制造成了较大困难。
在本研究中,选取临床治疗PCa较常用3味药物淫羊藿、三七、当归。何华琼等[19]研究表明,淫羊藿能够有效抑制PCa细胞增殖,其机制可能为淫羊藿可抑制雄激素受体信号通路中的雄激素受体(AR)磷酸化,同时促进蛋白酪氨酸磷酸酶基因(PTEN)表达,将PCa细胞的增殖阻滞于S期。倪晓辰等[20]研究证实,三七总皂苷可显著抑制PCa细胞增殖及迁移,同时可下调基质金属蛋白酶2(MMP2)、血管细胞黏附分子-1(VCAM-1)等因子表达。胡杨等[6]研究结果显示,当归提取物可有效提升机体免疫力,抑制PCa细胞增殖,促进PCa细胞凋亡,抑制其迁移等多方面起到抗肿瘤治疗效果。借助网络药理学分析,构建益肾补血中药治疗PCa的“药物-疾病-靶点”网络,结果显示益肾补血中药存在多有效成分、多靶点、多通路以及整体调控效应,能够介由调控细胞凋亡信号通路、P53信号通路、PI3K/Akt信号通路、肿瘤坏死(TNF)信号通路等发挥对PCa的治疗效应,而上述信号通路对调控细胞周期、凋亡有着重要作用,与GO富集分析结果一致。
正常的细胞均有一定的生命周期,而细胞凋亡是正常细胞出现程序性死亡的过程,其对生物的正常新陈代谢起到至关重要的作用,如果细胞周期及凋亡程序发生异常,将造成机体细胞新陈代谢紊乱,最终可能导致发生癌变[21]。基于KEGG通路富集分析结果表明,益肾补血中药能够介由多条信号通路调控细胞周期及其凋亡。其中细胞凋亡信号通路可激活肿瘤坏死因子α(TNFα)因子,经端激酶(JUK)磷酸化后与游离的组织蛋白酶(Cathepsin)、Bcl-2或Bcl-xl特异性结合,从而抑制细胞凋亡;肿瘤坏死(TNF)信号通路又称为肿瘤坏死信号通路,与PCa的发生发展有紧密关联,其可经由级联反应激活半胱天冬酶-8(Caspase-8),Caspase-8又被称为细胞生命周期的“开关”,在细胞周期及凋亡中扮演着关键角色[22];磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)通路AKT,可磷酸化细胞程序性死亡蛋白(Bad),进而抑制Bad结合Bcl-2最终抑制细胞凋亡。此外,其亦可经由磷酸化P21及P27调节细胞周期Cyclin及CDK家族蛋白[23];P53是PI3K/AKT信号通路的下游蛋白,其可调控Bax、Bcl-2等蛋白的表达并诱导细胞凋亡,最终阻断肿瘤的发生[24]。由上述可知,益肾补血中药可通过多条通路对细胞周期及凋亡进行调控,最终发挥对PCa的治疗效应。同时本研究结果表明,益肾补血中药可促进PCa LNCaP细胞在DNA合成前期(G1期)-DNA合成期(S期)细胞周期停滞,最终阻断或减慢细胞LNCaP增殖,显示出其在LNCaP细胞周期进程中的抗增殖作用,但其具体机制仍需进一步证实。
为进一步明确益肾补血中药治疗PCa的关键靶点,笔者对获得的有效成分-疾病靶点进行PPI分析,得到Degree≥50的关键蛋白有40个,其中调控细胞周期及凋亡的蛋白,包括CDK2、CDK4、CDK6、Bax、Bcl-2、cycline D1及cycline E1等。CDK家族蛋白即细胞周期蛋白依赖性激酶蛋白的简称,Cyclin家族蛋白为细胞周期调控蛋白,其准确调节着细胞周期,维持细胞更新换代的正常运行[21]。CDK可特异性结合cyclin产生异二聚体,形成cyclin-CDK聚合体,借助CDK的活化作用,发挥对不同细胞周期的推进及转化功能,而其中cycline D与cycline E家族蛋白作用恰恰相反[21,22]。如CyclinE-CDK2为生物细胞自G1期进入S期不可替代的激酶聚合体,其经由对下游众多底物的磷酸化机制使细胞启动DNA合成程序,最终推进细胞进入S期。本研究亦证实,益肾补血中药可随剂量增加下降人PCa LNCaP细胞中CDK2、CDK4、CDK6及Cycline E1的蛋白表达,cycline D1蛋白呈相反趋势改变,与其调控细胞周期特性一致。Bcl-2蛋白对调控生物细胞凋亡至关重要,其通过改变细胞线粒体包膜的通过率进而调控细胞凋亡,一旦Bcl-2蛋白过度表达,激活细胞程序性死亡程序,同时拮抗抑癌基因最终阻断细胞凋亡[25]。Chandrasekar等[26]研究结果显示,PCa患者的肿瘤组织及癌旁组织中的Bcl-2蛋白及相关mRNA表达异常,同时伴随疾病分期进展其含量上升,Bcl-2调控的细胞凋亡机制在PCa发生发展中扮演着重要角色。Bax为Bcl-2蛋白家族里促进细胞凋亡的关键蛋白,能够使细胞内线粒体包膜通透率改变,并促进产生相关凋亡因子,造成肿瘤细胞凋亡[27]。现阶段,已有学者在研究通过激活Bax途径进而治疗肿瘤,其可能成为治疗肿瘤重要的新靶点[28]。笔者在使用益肾补血中药干预人PCa LNCaP细胞过程中,Bcl-2、Bax蛋白的表达随中药剂量增加而下降,表明益肾补血中药能够促进LNCaP细胞凋亡,从而治疗PCa。结合网络药理学结果,益肾活血中药的有效成分,能够特异性作用在调控细胞增殖、凋亡及周期相关蛋白上。如益肾补血中药的有效成分Quercetin(槲皮素),在“药物-疾病-靶点”网络的预测结果中,显示Quercetin能够和CDK2、CDK4、CDK6、Bax、Bcl-2、cycline D1及cycline E1等靶点存在关联。同时乔慧敏等[29]研究结果显示,Quercetin可明显下调Bcl-2、CDK6、cycline D等蛋白抑制肿瘤细胞增殖,调控肿瘤细胞周期,促进肿瘤细胞凋亡。luteolin(木犀草素)主要以糖苷的形式存在于多种中药中,网络药理学结果表明,其与cycline E、Bax等存在关联。易均路等[30]研究证实,luteolin可显著阻滞细胞周期抑制肿瘤细胞生长,并促进肿瘤细胞凋亡。由此可见,益肾补血中药中的有效成分能够作用于调控细胞周期及凋亡的上游相关信号通路,某些有效成分甚至能够直接作用于细胞周期及凋亡相关靶点,最终发挥抑制 PCa 细胞增殖、促进细胞凋亡的作用。
本研究基于网络药理学及细胞实验对益肾补血中药治疗PCa进行初步研究,益肾补血中药可有效抑制PCa进展及转移。但受中药多有效成分、多靶点的特点限制,其更进一步的药效机制仍需更进一步的研究探讨。网络药理学是基于系统生物学理论,通过虚拟计算、分子组学分析等研究方法,对“药物-疾病-靶点”进行网络构建及机制整合,将中药信息和知识进行可视化,具备系统性及整体性的显著特征,与中医学的整体观念以及辨证论治基本原则存在诸多类似之处[10]。本研究通过网络药理学对益肾补血中药治疗PCa的作用机制进行预测,并借助细胞实验进行验证,明确益肾补血中药治疗PCa具有多有效成分、多通路、多靶点协同作用机制的特点,其能够经由调控多条信号通路,调控肿瘤细胞周期及凋亡,这对逆转PCa病理、防治PCa具有较重要的意义。

