甜玉米小斑病抗性主效QTL挖掘
蒋 锋 陈 趣 陈青春 张姿丽 孙 伟 王晓明 刘鹏飞*
(1.仲恺农业工程学院 农业与生物学院,广州 510225 2.湛江市霞山区农业技术推广中心,广东 湛江 524000)
玉米小斑病(Bipolarismaydis)是国内外玉米种植区普遍的真菌病害之一[1]。在我国,玉米小斑病主要发生于气候温暖潮湿的夏玉米种植区,病害爆发时轻者减产15%~20%,重灾区减产可达50%以上[2]。种植密度与施肥量的增多,加重了玉米小斑病的发生[3]。此外,各玉米种植区缺乏高抗小斑病的品种也是小斑病为害的主要原因之一。目前,化学防治是降低玉米小斑病危害的主要措施。但是长期使用化学杀菌剂会引起生态环境污染、食品安全和耐药性等问题[4]。合理的种植密度和施肥方案、恰当的耕作制度也可有效降低玉米小斑病的危害[5-6]。但是应用玉米抗小斑病种质资源,挖掘其抗性基因和QTL,培育抗病品种是玉米小斑病防治最经济有效的方法。
由于所用的抗性种质材料的来源和遗传背景不同,导致各研究者得出的玉米小斑病抗性遗传模式及抗病基因的数量和位置不尽相同。目前,已有多种玉米小斑病抗性模式的研究报道,Faluyi等[7]、Cai等[8]、Gao等[9]和Zhao等[10]认为玉米小斑病抗性遗传受隐性单基因控制;Smith等[11]首次在尼日利亚玉米自交系中鉴定出玉米小斑病的隐性抗性单基因,并命名为rhm1;随后,rhm1被转入许多玉米自交系中,成为玉米小斑病的主要抗源。Thompson等[12]和Chang等[13]认为受2个隐性主基因控制。一些研究认为,玉米小斑病抗性受数量性状基因和QTL控制。Carson等[14]用‘Mo17’בB73’组合的重组自交系,在第1、2、3、4、7和10染色体上定位到来源于Mo17的10个抗性QTL,可共同解释45.8% 的表型变异。Balint等[15-18]用不同的重组自交系在不同的环境下同时定位小斑病抗性QTL,得出在bin 3.04区域存在主效抗性QTL,贡献率均>10%。Zwonitzer等[19]用2个近等基因系,在bin 3.03、bin 6.01和bin 9.02上均同时检测到主效抗小斑病QTLs。Lennon等[20]和Liu等[21]分别用近等基因系和F2群体在bin 3.04区域内同时定位到2个玉米抗小斑病主效QTL。Li等[22]应用全基因组关联分析的方法在bin 5.04上定位到1个玉米抗小斑病主效QTL。上述研究中,小斑病抗性表型数据的获取均采用先目测估算病斑面积的比例然后进行定级的方法。这一方法简单便捷,但主观影响较大,不同调查者得出的同一植株的病级可能不同;同时得出的病级为间断型数据,不能显示同一病级内各单株的抗病性差异。
目前,基于图像识别的玉米小斑病抗性QTL定位的研究未见报道。本研究以2个小斑病抗性差异显著的甜玉米自交系‘T8’和‘T33’为亲本配制杂交组合,以‘T8’בT33’组合的200个F2单株作为遗传作图群体,构建遗传连锁图谱,对各单株叶片进行图像扫描获得叶片的总像素值和小斑病病斑的像素值,以病斑像素值占叶片总像素值的百分比作为小斑病抗性指标值,旨在对玉米小斑病抗性进行QTL定位,以期为抗小斑病基因的精细定位、主效基因克隆和抗小斑病甜玉米新品种选育提供理论依据。
1 材料与方法
1.1 试验材料
亲本材料‘T8’(母本)和‘T33’(父本)由广东省鲜食玉米遗传育种工程技术研究中心提供。根据刘纪麟[1]的七级分级法,经多年田间试验鉴定,‘T8’的平均病级为3.62±0.44,‘T33’的平均病级为1.33±0.32,应用假设检验检测两亲本小斑病抗性差异(P<0.01)。
1.2 田间试验设计
试验材料种植在仲恺农业工程学院番禺实践基地。以抗病自交系‘T33’为父本,感病自交系‘T8’为母本配制杂交组合。F1严格套袋自交收获F2代种子;种植F2,于4叶期剪取各单株嫩叶提取基因组DNA,于拔节期和喇叭口期分2次接种O小种小斑病菌。鲜穗采收期收集各单株全部叶片,进行叶片图像扫描,确定各单株病情水平。
1.3 抗病表型数据获取
于鲜穗采收期摘取各F2单株所有叶片,用微型扫描仪获取叶片图像,用Photoshop CS5图像处理软件进行小斑病病斑识别和病斑面积分割(图1)。
以每一F2单株的整株叶片的病斑面积比、穗三叶病斑面积比和穗位叶病斑面积比3个指标作为各个单株小斑病抗性表型值。

比例尺为1 cm。The scale bar is 1 cm.图1 Photoshop CS5软件进行玉米叶片小斑病病斑识别前(a)和识别后(b)图像Fig.1 Images of corn leaf infected by southern leaf blight before (a) and after (b) identification by Photoshop CS5 software
全株叶片的病斑面积比=全株叶片上的病斑像素之和/全株叶片的像素之和×100%;
穗三叶病斑面积比=穗三叶上的病斑像素之和/穗三叶的像素之和×100%;
穗位叶病斑面积比=穗位叶上的病斑像素/穗位叶的像素×100%。
1.4 DNA分子标记分析
采用 CTAB 法[23]提取两亲本和各F2单株 DNA。根据赵茂俊等[24]、Wang等[25]、于永涛等[26]、刘宗华等[27]和李永祥等[28]的玉米连锁遗传图谱设计引物,结合玉米基因组数据库www.maizegdb.org,选用分布于玉米10 个连锁群上的 800 对 SSR引物对两亲本和200个F2单株进行标记基因型分析。
SSR 引物由北京鼎国昌盛生物技术有限责任公司合成。参照张军等[29]的方法进行PCR 反应体系、聚丙烯酰胺凝胶电泳和硝酸银染色。
1.5 连锁群构建及QTL定位
采用JoinMap 3.0软件对200个F2单株的多态标记基因型进行连锁关系分析,构建分子标记连锁遗传图谱[30]。采用WinQTLCart 2.5软件,复合区间作图法检测小斑病抗性QTL。LOD(likelihood of odd)阈值由1 000次随机抽样产生。
按照“q+性状+染色体号+QTL数目”命名QTL。性状以英文缩写表示,如病斑面积比相关QTL以LBC(Leaf blight coefficient)表示。性状缩写后“1”、“2”和“3”分别表示全株、穗三叶、穗位叶。同一条染色体上的各QTL以数字表示。
2 结果与分析
2.1 抗性性状统计
对两亲本进行小斑病抗性鉴定,得出‘T8’全株、穗三叶和穗位叶的病斑面积比分别为(48.51±2.01)%、(59.52±2.11)%和(75.69±3.42)%,‘T33’全株、穗三叶和穗位叶的病斑面积比分别为(22.31±1.52)%、(26.69±2.03)%和(34.37±2.29)%,经假设检验分析表明,两亲本在病斑面积比上差异极显著(P<0.01)。
由表1可知,F2单株的全株、穗三叶和穗位叶病斑面积比的变异系数较大,且显著大于两亲本的变异系数,表明有显著的遗传方差,适合作QTL定位分析。
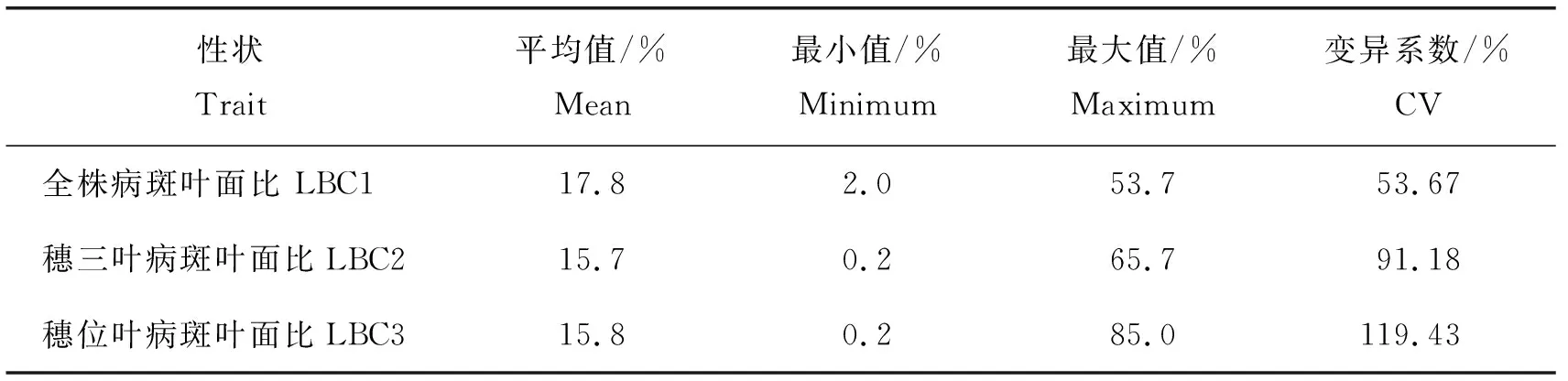
表1 F2单株表型性状统计Table 1 Statistics of phenotypic traits of F2 individuals
2.2 遗传连锁图谱的构建
从800对SSR引物中筛选出253对在‘T8’和‘T33’之间有多态性的引物。对多态标记在各F2单株上的基因型进行卡方测验,获得231个未偏分离的分子标记。用Joinmap 3.0软件分析,获得214个SSR位点的连锁遗传图谱,图谱全长1 270.2 cM,平均间距5.9 cM(图2)。
2.3 小斑病抗性QTL定位分析
2.3.1全株病斑面积比相关QTL定位
由表2和图2 可知,共检测到4个病斑面积比相关QTLs,其中,qLBC1-chr3-1和qLBC1-chr3-2,位于第3染色体phi453121~umc1746和umc1746~bnlg1523,LOD值分别为6.33和6.06,加性效应为5.71和5.62,显性效应为-2.41和-2.11,贡献率为11.17%和11.32%。qLBC1-chr5-1位于第5染色体bnlg603~mmc0081,LOD值为5.28,加性和显性效应分别为4.90和-1.81,贡献率为10.23%。qLBC1-chr6-1位于第6染色体bnlg2097~umc1133,LOD值为5.61,加性效应和显性效应分别为4.83和-1.55,贡献率为8.95%。
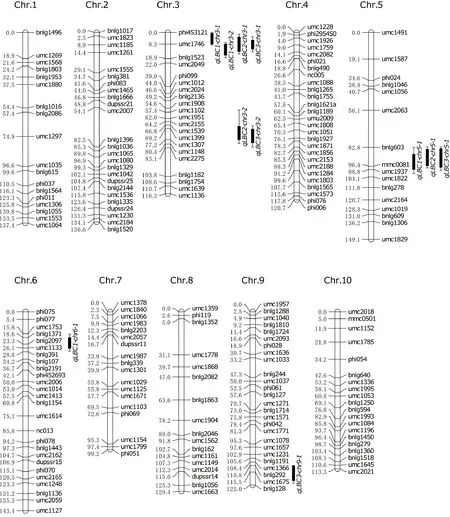
和 分别代表1-LOD置信区间和2-LOD置信区间。 and indicate 1-LOD and 2-LOD QTL likelihood intervals, respectively.图2 连锁遗传图谱及抗小斑病相关QTL定位Fig.2 Genetic linkage map and QTL mapping for southern leaf blight resistance
2.3.2穗三叶病斑面积比相关QTL定位
由表2和图2可知,共检测到3个穗三叶病斑面积比相关QTL。在第3染色体上检测到2个QTL(qLBC2-chr3-1和qLBC2-chr3-2),分别位于标记umc1746~bnlg1523和umc1399~umc1307,LOD为12.00和3.29,加性效应值为7.58和5.52,显性效应为-1.66和-1.84,分别可解释19.60%和5.08%的表型变异。在第5染色体上检测到1个QTL(qLBC2-chr5-1),LOD为8.32,加性效应和显性效应分别为7.91和-2.73,可解释14.98%的表型变异。
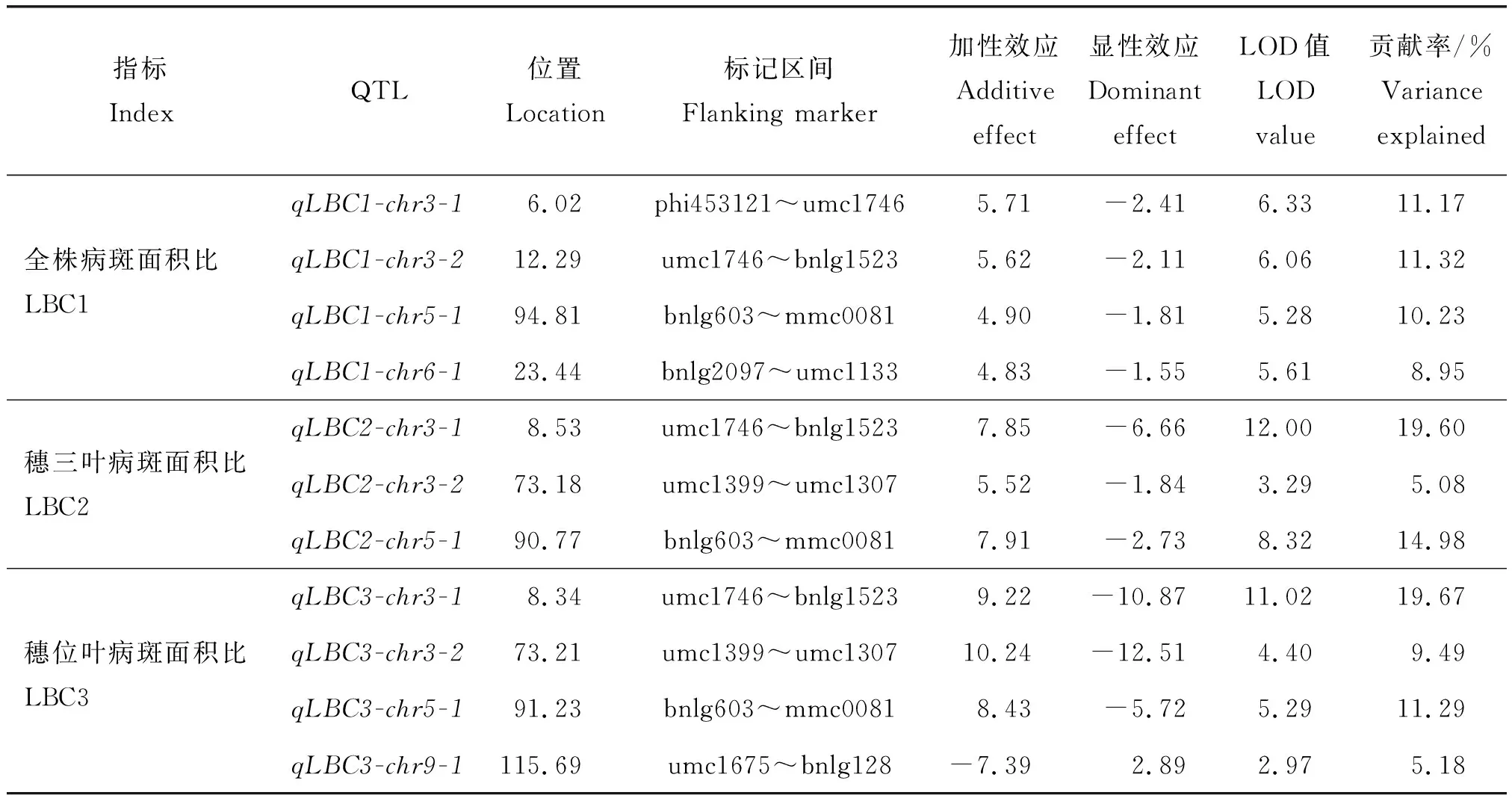
表2 复合区间作图检测到的小斑病抗性相关QTLTable 2 QTL for southern leaf blight with the method of CIM
2.3.3穗位叶病斑面积比相关QTL定位
由表2和图2可知,共检测到4个穗位叶病斑面积比相关QTL。qLBC3-chr3-1和qLBC3-chr3-2分别位于第3染色体umc1746~bnlg1523和umc1339~umc1307,LOD为11.02和4.40,加性效应为9.22和10.24,显性效应为-10.87和-12.51,对表型的贡献率分别为19.67%和9.49%。在第5染色体bnlg603~mmc0081检测到1个QTL(qLBC3-chr5-1),LOD为5.29,加性效应和显性效应分别为8.43和-5.72,贡献率为11.29%。在第9号染色体上检测到1个QTL(qLBC3-chr9-1),LOD为2.97,加性效应为-7.39,显性效应为2.89,贡献率为5.18%。
3 讨 论
3.1 小斑病抗病数据量化
玉米小斑病抗病数据量化指标经历了从病级到单位叶面积病斑数目再到病斑面积比例的发展过程。刘纪麟[1]最早提出玉米单株小斑病七级分级法,进而由单株病级算得各玉米群体的病情指数,这一方法被后来的研究者广泛运用。蒋锋等[31]采用单位叶面积病斑数目作为抗性指标对小斑病抗病性进行了遗传模型分析。随着数据算法的发展进步,近年来研究者采用图像自动分类处理技术获得病菌为害叶片的量化数据[32]。本试验采用Photoshop CS5图像处理软件对病叶进行病斑识别和面积分割,以病斑像素值占叶片总像素值的比例作为抗性指标进行QTL定位,抗性指标值为连续性数据,减少了主观判断影响,降低了试验误差,增强了试验结果的可靠性。
3.2 小斑病抗性主效QTL挖掘
Carson等[14]用‘Mo17’בB73’组合的重组自交系,在第1、2、3、4、7和10染色体定位到来源于‘Mo17’的10个抗性QTL,可共同解释45.8%的表型变异。Balint等[15-18]用不同的重组自交系在不同的环境下同时定位小斑病抗性QTL,得出在bin 3.04区域存在主效抗性QTL,贡献率均>10.00%。Zwonitzer等[19]用2个近等基因系,在bin 3.03、bin 6.01和bin 9.02上均同时检测到抗小斑病主效QTL。由于各研究者所用的亲本材料和作图群体不同,加之使用的分子标记也不同,很难找到共同的分子标记,难以进行QTL定位结果的比较,不能确定已发表的QTL之间的关系。
为提高QTL检索的可靠性和稳定性,本试验分别以全株、穗三叶和穗位叶的病斑面积比作为各F2单株小斑病抗性表型值。Tanksley[33]指出,贡献率>10.00%的QTL可视为主效QTL。本研究结果表明,3个抗性指标所检索到的抗性QTL染色体定位不尽相同,但存在2个稳定的主效QTL区间。在第3染色体的umc1746~bnlg1523,同时检测到3个抗性指标的QTL,LOD在6.06~12.00,贡献率为11.32%~19.67%,表明在此标记区间内存在稳定的甜玉米小斑病抗性主效QTL。在第5染色体的bnlg603~mmc0081,也检测到3个抗性指标的QTL,LOD在5.28~8.39,贡献率为10.23%~14.98%,表明在第5染色体bnlg603~mmc0081也存在稳定的甜玉米小斑病抗性主效QTL。另外,穗三叶和穗位叶病斑面积比2个指标在第3染色体umc1399~umc1307同时检测到抗性QTLs(图1和图2)。后期应通过进一步精细定位验证主效抗性QTL,找到可供育种利用的分子标记,力图实现玉米小斑病抗性QTL的分子标记辅助选择。
4 结 论
本研究以甜玉米杂交组合‘T8’בT33’的F2群体为遗传作图群体,应用复合区间作图法,在第3染色体umc1746~bnlg1523和第5染色体bnlg603~mmc0081同时检测到3个甜玉米小斑病抗性指标(全株、穗三叶和穗位叶的病斑面积比)相关的主效QTL,各主效QTL的贡献率均>10.00%。