丛枝菌根真菌侵染指标与植物促生效应相关性分析
李 侠 叶诚诚 张俊伶 李海港 王幼珊
(1.山西大同大学 生命科学学院,山西 大同 0370090;2.中国农业大学 资源与环境学院,北京 100193;3.温州市优质农产品开发服务中心,浙江 温州 325000;4.内蒙古农业大学 草原与资源环境学院/内蒙古自治区土壤质量与养分资源重点实验室/草地资源教育部重点实验室,呼和浩特 010018;5.北京市农林科学院 植物营养与资源研究所,北京 100097)
丛枝菌根的形成对植物营养元素(尤其是磷和锌)的吸收具有促进或抑制作用[1]。这种相互作用的方向和程度受宿主植物和丛枝菌根真菌(Arbuscular mycorrhizal fungi, AMF)种类的共同影响[2-4]。同一种AMF对不同宿主植物生长和养分吸收的效应不同。例如,Tran等[1]发现接种异形根孢囊霉Rhizophagusirregularis对15 种农作物(包括谷物、豆类和蔬菜)的效应不同,其中菌根对韭菜生长和矿质元素吸收的促进作用最大,而对三叶草却表现抑制效应。不同AMF种类对同一宿主植物的生长效应也有差异。贫瘠土壤接种Funneliformismosseae后,小麦生物量及根系AMF侵染率等指标均高于接种R.fasciculatus和易误巨孢囊霉Gigasporadecipiens[5]。
植物对AMF的功能响应差异可能与AMF的生存策略有关。根外菌丝在AMF吸收和运输养分中非常重要,丛枝(Arbuscule)则是AMF与宿主植物细胞进行养分交换的场所[6]。关于不同AMF生长策略的研究表明,AMF的生长具有高度谱系保守性[7-8]。球囊霉科Glomeraceae具有较高的根系侵染率,因此可以减少病原菌,例如:尖孢镰孢Fusariumoxysporum和腐霉Pythiumsp.对宿主植物根系的感染;巨孢囊霉科Gigasporaceae具有较高的根外菌丝密度,接种后增加了长叶车前植株地上部的磷含量;无梗囊霉科Acaulosporaceae的AMF根内侵染率和根外菌丝密度均较低[7]。因此,AMF生长特性不同导致其功能存在差异。此外,也有研究发现AMF生长在遗传水平上具有高度变异,且AMF与宿主植物共生关系具有不对称性,即AMF的生长难以用来预测宿主植物的生长[3,9]。目前已发现并报道的AMF形态分类大约有300 种。我国的AMF物种资源十分丰富且广泛分布,发现并报道的AMF有147 种[10],保存在我国“丛枝菌根真菌种质资源库”的丛枝菌根真菌有40 种190 株,然而关于我国AMF不同菌种间生长特性的研究较少,缺乏对其功能的深入研究[11]。
传统研究AMF的方法主要基于显微观察菌根侵染率[12]、菌丝密度[13]和孢子数[14]等。20世纪90年代以来,分子生物学技术被逐渐应用到AMF的研究中[15]。利用特异性较强的水解探针(TaqMan)可定量检测根内和土壤中特定的AMF[16-19]。然而,定量PCR与显微方法测定的结果不一,二者之间具有一定相关性[17,20-21]或者不相关[22-24]。菌根真菌对宿主植物基因(如营养代谢相关的基因等)表达也具有调控作用[25]。AMF专性诱导型磷转运蛋白基因如玉米ZmPht1;6基因在玉米根系显著上调[26],但其与菌根侵染特征的关系还不清楚。因此,本研究拟以7 种AMF为研究对象,以玉米和紫花苜蓿作为宿主植物进行温室盆栽试验,测定菌根侵染率、根外菌丝密度、植物地上部生物量、磷/锌吸收量、植物根系AMF gDNA丰度以及玉米根系ZmPht1;6的相对表达量。探究AMF生长特性及其与功能之间的关系,以期揭示菌根指标之间的关系及其对功能的影响。
1 材料与方法
1.1 试验材料
试验于2017-04-22—06-04在中国农业大学资源与环境学院温室进行。供试土壤取自中国农业大学北京上庄试验站长期定位试验地,为砂壤土。土壤基本理化性质如下:有效磷4.18 mg/kg、硝态氮17.07 mg/kg、铵态氮2.83 mg/kg、速效钾82.4 mg/kg、pH 8.19(m(水)∶m(土)=2.5∶1)、有机碳11.5 g/kg。风干土壤过2 mm筛后与河沙混合作为培养基质,m(土)∶m(河沙)=2.5∶1。用γ射线(25 KGray)对土壤基质进行灭菌。土壤基质中供应200 mg/kg氮((NH4)2SO4),20 mg/kg磷(KH2PO4),200 mg/kg钾(K2SO4)作为底肥。同时按照氮供应量的1%加入硝化抑制剂(DMPP: 3,4-Dimethylpyrazole phosphate)。
供试玉米(ZeamaysL.)品种为郑单958,紫花苜蓿(MedicagosativaL.)品种为中牧168。玉米种子在10% H2O2中浸泡 10 min(紫花苜蓿3 min)进行表面消毒,用蒸馏水洗涤数次后,在饱和CaSO4溶液中进行种子吸胀7 h(紫花苜蓿3 h),而后将种子平铺置于湿润的滤纸上在黑暗中催芽用于播种。
供试菌种由北京市农林科学院丛枝菌根真菌种质资源库(BGC)提供,选取7 种AMF:摩西斗管囊霉F.mosseae(HK01)、变形球囊霉Glomusversiforme(NM04B)、根内根孢囊霉R.intraradices(HEB07D)、幼套近明球囊霉Claroideoglomusetunicatum(XZ03B)、近明球囊霉C.claroideum(XJ06F)、细凹无梗囊霉Acaulosporascrobiculata(HK02A)、黏屑多样孢囊霉Diversisporaspurca(SD03A)。每克菌剂的孢子数约为40~200个。
为了区分植物根系和AMF菌丝对宿主植物生长和功能的影响,本试验采用分室的根箱装置(图1),其中根室A的大小:长×宽×高分别为3 cm×8 cm×12 cm,菌丝室B的大小:长×宽×高分别为14 cm×8 cm×12 cm,高度在紫花苜蓿装置中改为6 cm。A与B室之间用30 μm尼龙网隔开,该孔径的网膜仅允许菌丝进入菌丝室。
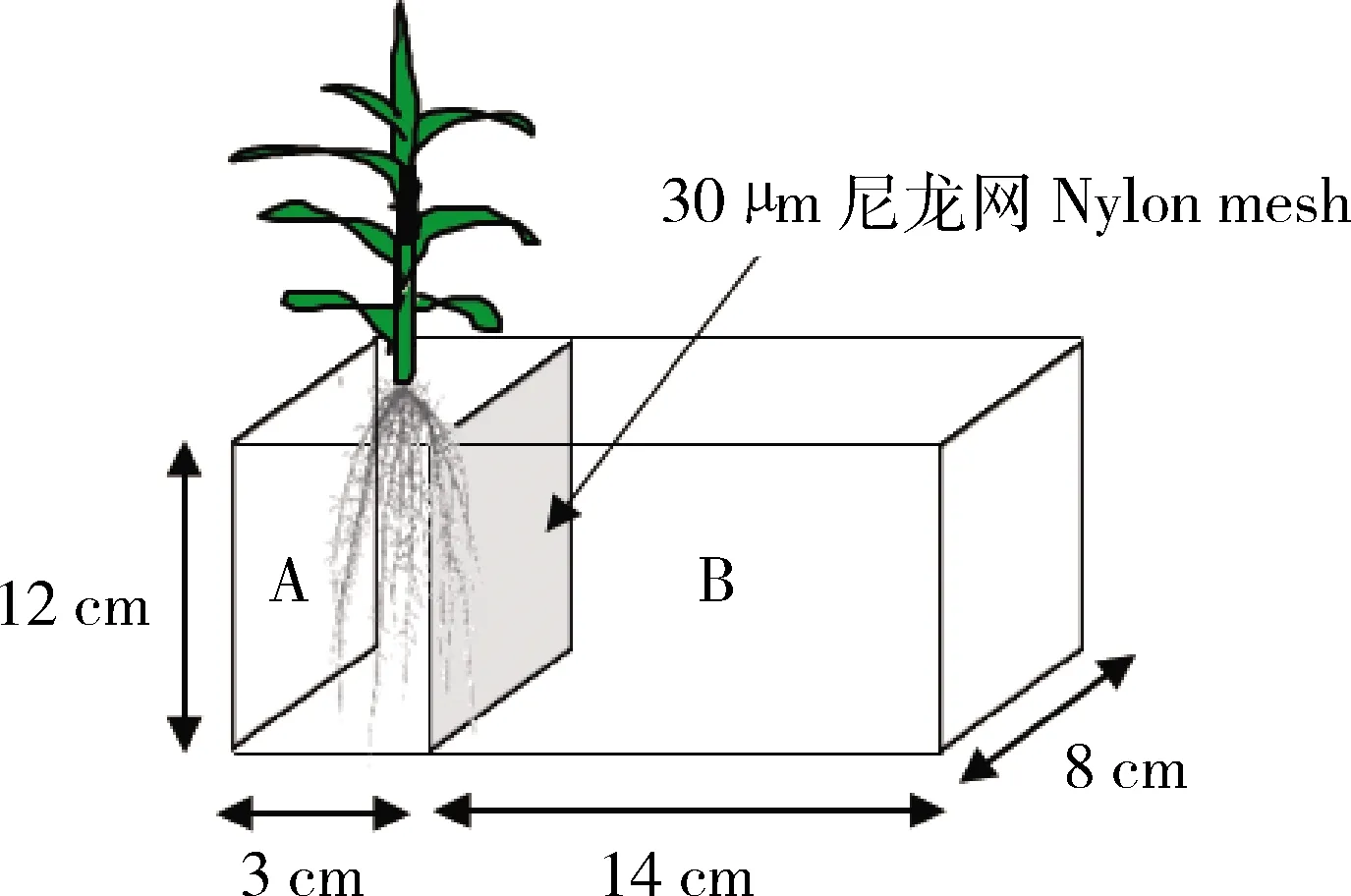
A为根室,B为菌丝室。A is root compartment. B is hyphal compartment.图1 试验装置示意图Fig.1 Schematic of the experimental pots
1.2 试验设计
试验的2种植物分别设8个处理:在根室单独接种7种AMF以及不接种对照CK,每个处理重复4次,完全随机排列。
玉米根室A和菌丝室B分别加入400和1 840 g灭菌基质,紫花苜蓿为250和1 150 g灭菌基质。接种处理在根室土壤中间处分别铺上32 g接种剂(玉米)和20 g(紫花苜蓿)接种剂(8%的接种量),对照则接种等质量的灭菌接种剂和5 mL其他土壤微生物滤液。滤液由5 g接种剂加50 mL蒸馏水混匀后,用孔径为20~25 μm、高压灭菌的双层滤纸过滤形成。根室A保留一株玉米,紫花苜蓿保留7株。生长44 d后收获。
1.3 样品采集与分析
收获时,将植株地上部剪下清洗后装入信封,105 ℃杀青30 min,70 ℃烘干,称重,磨碎。地上部磷和锌含量用HNO3-H2O2微波消解仪(CEM, Matthew, NC, 美国)消解后,采用电感耦合等离子体发射光谱仪(ICP-OES, OPTIMA 3300 DV, Perkins-Elmer, 美国)测定。菌根生长效应是通过植株地上部生物量计算得到[27]。计算公式如下:
菌根生长效应=ln(XAMF/Xnon-AMF)
式中:XAMF为接种AMF后植株地上部生物量,g;Xnon-AMF为不接种AMF的植株地上部平均生物量,g。菌根磷、锌吸收效应计算方法同菌根生长效应。
1.4 菌根侵染率和菌丝密度测定
洗净根系并用去离子水冲洗,用吸水纸吸干水分,取部分用于测定根系AMF侵染率,首先用10% KOH进行透明,之后用1% HCl酸化,再用0.05%曲利苯蓝染色,然后从每个样品中随机抽取30根,置于载玻片上,置于100倍光镜下采用交叉法观察计算根系的丛枝侵染率(AC)、菌丝侵染率(HC)、泡囊侵染率(VC)和总AMF侵染率[12]。取菌丝室过2 mm筛的土壤5 g,采用湿筛抽滤法测定根外菌丝密度,每个样品设3 个平行[13]。
1.5 根系AMF gDNA丰度测定
快速取部分上步骤洗净的细根用锡箔纸包好装入液氮中,带回实验室在-80 ℃冰箱中保存;并取部分根系鲜样称鲜重后在65 ℃下烘干,称取干重后通过鲜重干重的比例计算根系的含水量。AMF根系gDNA丰度测定采用实时定量PCR法(探针法)测定。结合实验室及菌种库的条件,本试验仅对F.mosseae,R.intraradices和C.claroideum3 种AMF的gDNA丰度进行测定。
定量PCR标准物制备:按照植物基因组DNA提取试剂盒(DN14,北京艾德莱生物科技有限公司)说明书提取植物根系总DNA,并用每种AMF的特异性引物进行普通PCR扩增,反应体系为25 μL:2.5 μL 10×PCR Buffer(含Mg2+),2.0 μL dNTP,各0.3 μL的上下游引物(10 μmol/L),0.3 μLTaq酶(全式金),1 μL DNA模板和18.6 μL ddH2O。反应条件为:94 ℃预变性5 min,40个循环94 ℃变性30 s,X ℃退火1 min,72 ℃延伸30 s,72 ℃延伸5 min,引物序列和退火温度见表1[19]。用PCR产物纯化回收试剂盒(DR02,北京艾德莱生物科技有限公司)对普通PCR产物进行纯化。纯化后的PCR产物按照pMD19-T Vector (TaKaRa)试剂盒说明书的方法进行连接,用感受态细胞E.coilJM109(TaKaRa)进行转化与克隆,将成功克隆的单菌落置于加有Amp/IPTG/X-Gal的LB液体培养基中过夜振荡培养。过夜培养后的菌液分别用各自的AMF引物(表1)进行PCR扩增,挑选目的条带明亮样品送测序并返回质粒。用Nano drop测定质粒DNA浓度(ng/L)。每μL的拷贝数浓度(NC)计算公式如下:
式中:660为DNA的分子量,u/bp;K为 DNA浓度,ng/μL;L为真菌DNA目的片段长度和质粒片段长度之和(F.mosseae,R.intraradices,C.claroideum和质粒片段长度分别为122、250、177 和2 692 bp);Na为阿伏伽德罗常数6.022×1023。
用ddH2O对质粒进行一系列稀释,使获得拷贝数范围为102~109,用作标准曲线。
定量PCR:采用TaqMan探针法进行根系AMF gDNA丰度的绝对定量。将上述步骤提取的植物样品DNA稀释10倍作为模板,系列浓度稀释后的质粒作为标准曲线,然后用每种AMF的特异性引物以及探针进行PCR定量,具体引物、探针序列及退火温度见表1[19]。探针两端修饰物分别为5′(FAM);3′(BHQ-1),纯化方法为PAGE(生工生物(上海)工程有限公司)。反应体系为25 μL: 2.5 μL 10×PCR Buffer(含Mg2+),2.0 μL dNTP,各0.3 μL的上下游引物(10 μmol/L),0.15 μL的水解探针(10 μmol/L),0.3 μL Taq酶(全式金)和1 μL DNA模板,并加入18.45 μL ddH2O补足至25 μL。反应条件为:94 ℃预变性5 min,40 个循环94 ℃变性30 s,X ℃退火1 min,72 ℃延伸30 s,并在每次循环结束后收集荧光信号。每个样品反应设置3 个平行,所有反应均在qTOWER 2.2仪器上完成,反应结束后输入标准曲线的拷贝数浓度,通过qPCRsoft 3.0.29.0版本软件计算出未知样品的拷贝数浓度。将未知样品的拷贝数换算成浓度(ng/μL),根系AMF gDNA丰度的计算公式如下[19]:
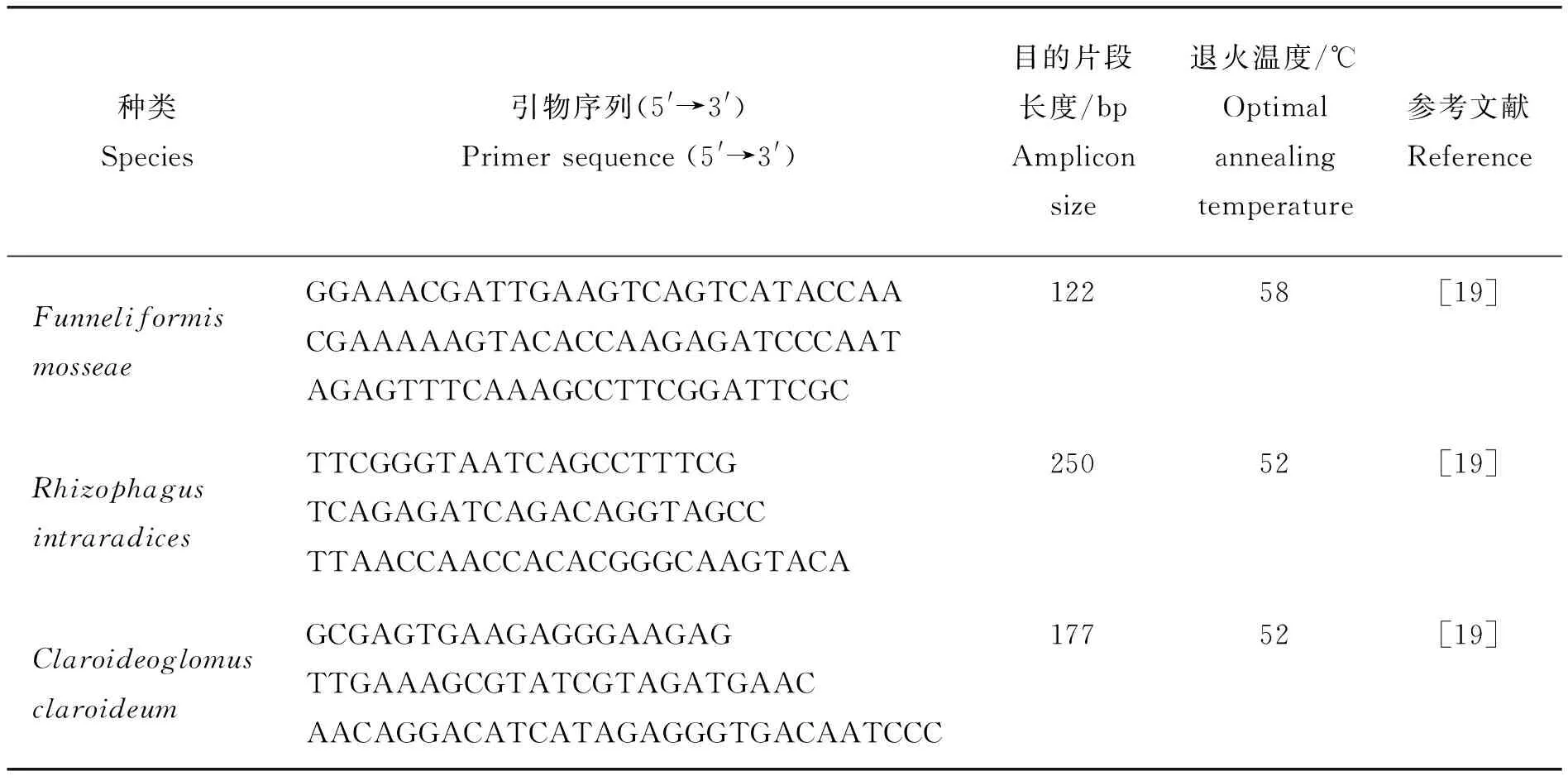
表1 定量PCR的AMF引物、探针序列及退火温度Table 1 Sequences of primers, hydrolysis probes and optimal annealing temperature used for the quantitative real-time PCR quantification of LSU gene copies of different AMF species
根系AMF gDNA丰度=
式中:根系AMF gDNA丰度,ng/mg;根系AMF gDNA浓度,ng/μL;根系干重,mg,EV为洗脱体积,μL。
1.6 ZmPht1;6相对表达量测定
采用实时定量PCR法测定,取用部分保存于-80 ℃ 冰箱的玉米根系,采用Trizol试剂(RNAiso Plus, Takara)进行植物总RNA提取,按照反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)的说明进行RNA反转录,使用 SYBR Premix EXTaqTM(Tli RNaseH Plus, Takara)试剂盒进行荧光定量PCR反应。反应体系为25 μL,反应体系如下:12.5 μL SYBR Green PCR mix,各0.5 μmol/L正向和反向引物,1 μL 稀释10倍的cDNA模板以及10.5 μL ddH2O。反应程序为:95 ℃预变性2 min,40 个循环95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸20 s。溶解曲线数据收集在反应结束后温度从55 ℃升到95 ℃时,每L高0.5 ℃收集1 次荧光信号。每个样品设3 个平行。PCR 反应中使用α-Tubulin4为内参基因,内参基因及目标基因引物序列引用参考文献[28]。用2-ΔΔCt法计算相对表达量,计算公式如下[29]:
ΔCt=ΔCt对照-ΔCt内参
2-ΔΔCt=2-(ΔCt试验-ΔCt平均)
式中:ΔCt对照为不接种对照处理目的基因的Ct值;ΔCt内参为内参基因的Ct值;ΔCt试验为接种处理的Ct值;ΔCt平均为ΔCt值的平均值。
1.7 统计分析
所有数据采用Shapiro-Wilk检测正态性、Levene’s检测方差齐性。其中菌根侵染率、根系AMF gDNA丰度以及ZmPht1;6相对表达量的数据结果进行lg(x)转化使其符合正态分布和方差齐性。采用单因素方差分析(One-way ANOVA)检验不同接种处理对根外菌丝密度、菌根侵染率、菌根生长效应、菌根磷、锌吸收效应、根系AMF gDNA丰度(紫花苜蓿)、ZmPht1;6相对表达量等指标的影响,方差分析显著后,采用Duncan’s多重比较检验各菌种处理间差异的显著性,采用单样本t检验(One samplet-test)比较菌根生长效应、菌根磷、锌吸收效应与零的差异。采用独立样本t检验(Independent samplet-test)比较玉米根系AMF gDNA丰度在2种菌种间的差异。相关分析采用Pearson法,回归分析采用逐步回归法。所有统计均用IBM SPSS Statistics 25.0分析,采用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 玉米和紫花苜蓿根系AMF侵染率
接种F.mosseae、R.intraradices、G.versiforme以及C.etunicatum,对植株根系均有良好的侵染;而接种C.claroideum(仅玉米根系)、A.scrobiculata和D.spurca的玉米和紫花苜蓿根系几乎无丛枝和泡囊的侵染。接种F.mosseae和R.intraradices的玉米和紫花苜蓿的根系AMF总侵染率显著高于其他处理;接种G.versiforme、C.etunicatum次之,显著高于接种C.claroideum、A.scrobiculata和D.spurca;根系菌丝侵染率、丛枝侵染率和泡囊侵染率在不同接种处理间的表现与根系总侵染率基本一致(表2)。
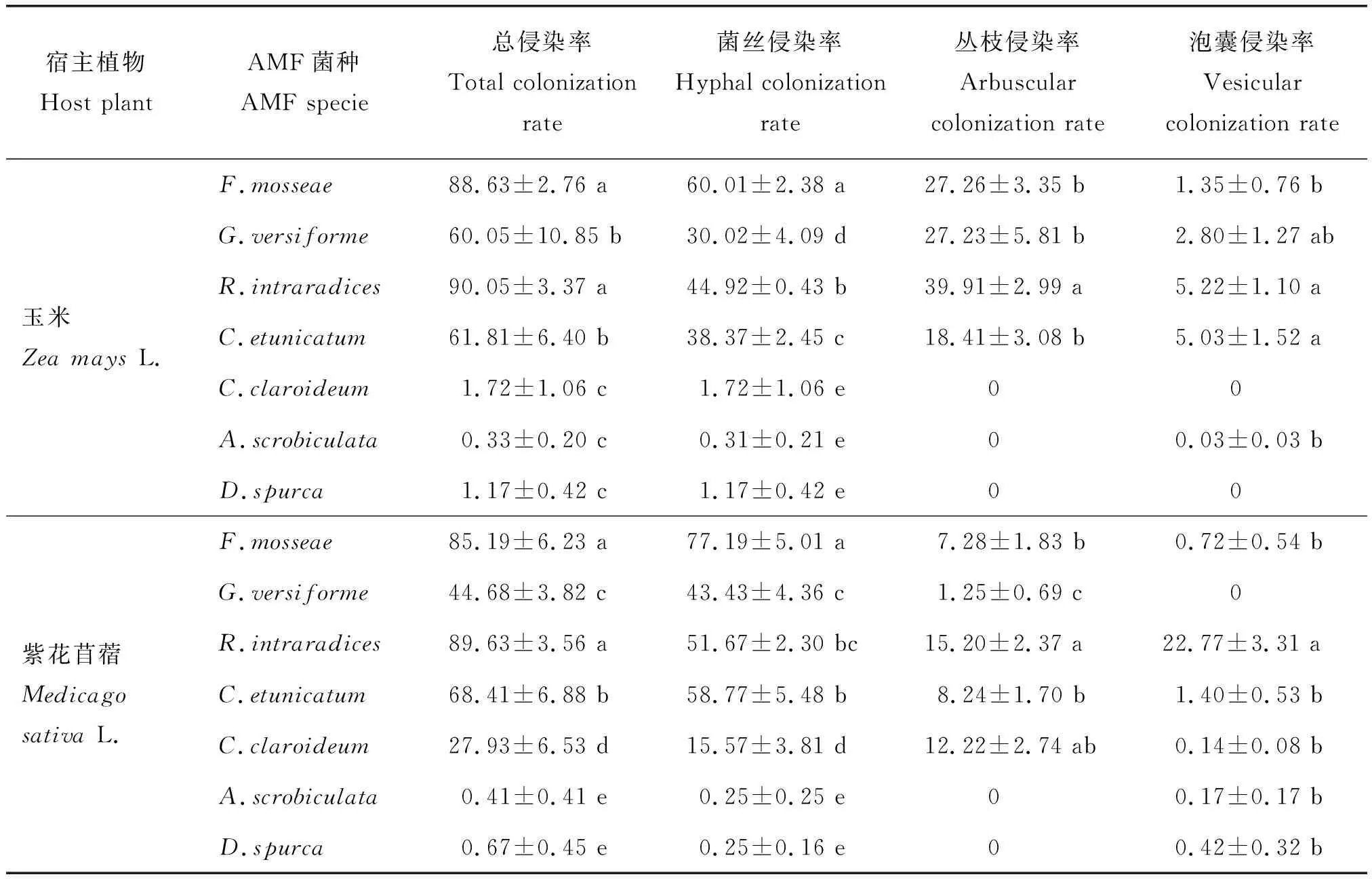
表2 玉米和紫花苜蓿根系AMF侵染率Table 2 AMF colonization rate in maize and alfalfa roots inoculated with different AMF species %
2.2 玉米和紫花苜蓿根外菌丝密度
测定菌丝室的根外菌丝密度发现(图2):接种F.mosseae玉米根外菌丝密度最高,显著高于其他处理,接种R.intraradices次之,显著高于G.versiforme;接种C.etunicatum与接种R.intraradices、G.versiforme无显著差异;接种C.claroideum、A.scrobiculata、D.spurca玉米根外菌丝密度最低,显著低于其他接种处理,且三者间差异不显著(图2(a))。接种F.mosseae、R.intraradices紫花苜蓿根外菌丝密度最高,显著高于其他接种处理,接种G.versiforme次之,显著高于接种D.spurca、A.scrobiculata,接种C.etunicatum、C.claroideum与接种G.versiforme、D.spurca、A.scrobiculata间差异不显著(图2(b))。
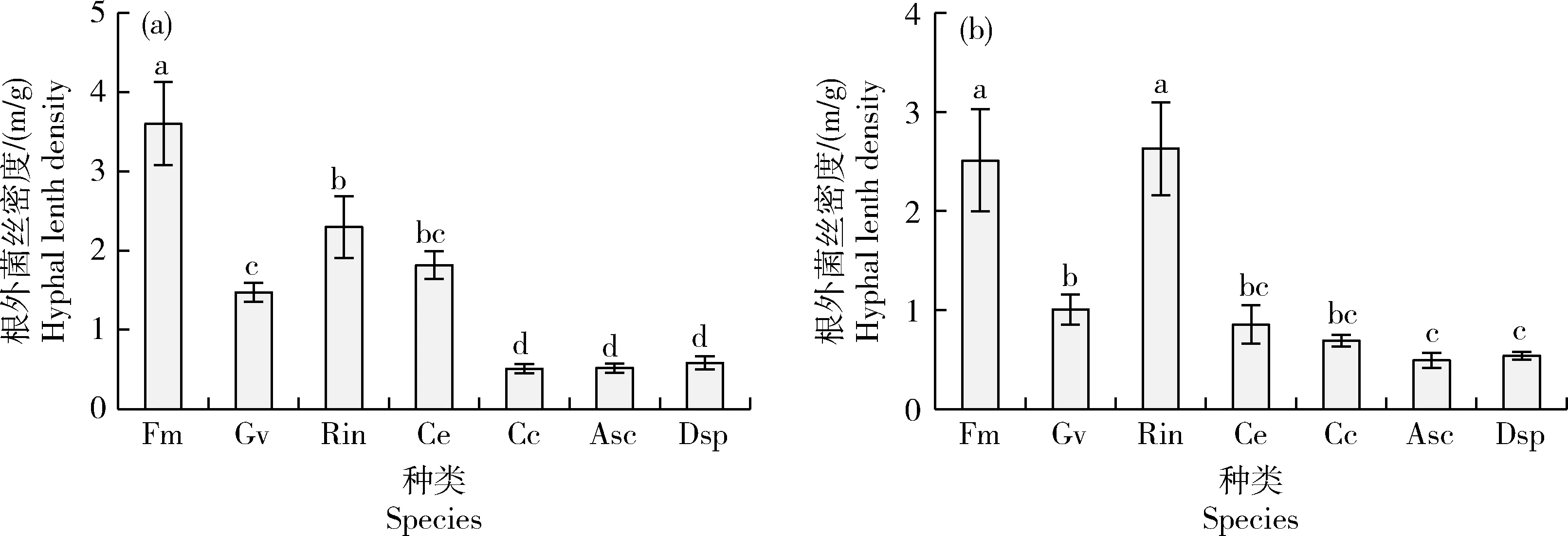
Fm, Funneliformis mosseae; Gv, Glomus versiforme; Rin, Rhizophagus intraradices; Ce, Claroideoglomus etunicatum; Cc, Claroideoglomus claroideum; Asc, Acaulospora scrobiculata; Dsp, Diversispora spurca。不同接种处理间差异采用Duncan’s多重比较进行分析,不同小写字母表示不同接种处理间存在显著差异(P<0.05)。下同。Significant differences among different inoculation treatments were tested by Duncan’s significant difference test (P<0.05). The same below.图2 不同AMF接种处理下玉米(a)和紫花苜蓿(b)的根外菌丝密度Fig.2 Hyphal length density in the rhizosphere of maize (a) and alfalfa (b) plants inoculated with different AMF species
2.3 玉米和紫花苜蓿菌根生长效应
通过计算不同接种处理玉米和紫花苜蓿地上部的菌根生长效应后发现(图3):接种F.mosseae、G.versiforme、R.intraradices、C.etunicatum均显著促进玉米和苜蓿地上部生长,且菌根生长效应显著高于其他接种处理;接种C.claroideum、A.scrobiculata显著抑制玉米地上部生长;接种C.claroideum却显著促进苜蓿地上部的生长;接种A.scrobiculata(仅苜蓿)、D.spurca对玉米和苜蓿地上部生长无显著影响;接种A.scrobiculata、D.spurca玉米菌根生长效应显著高于接种C.claroideum,而苜蓿菌根生长效应却表现出相反趋势。
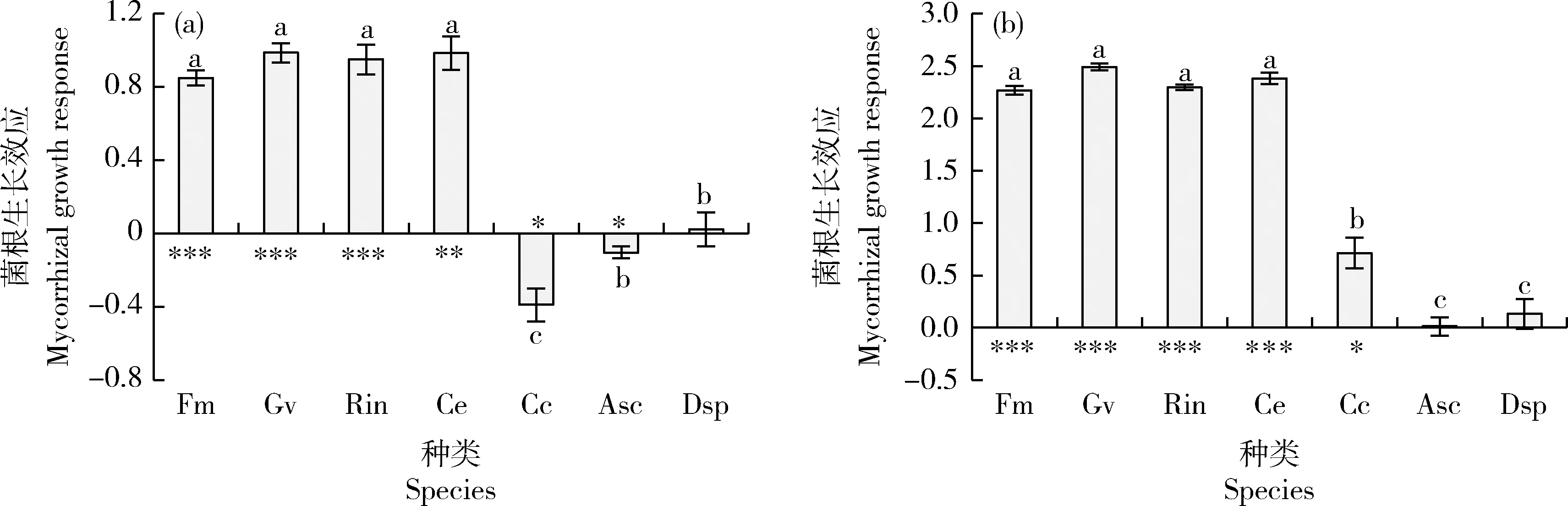
*表示菌根效应大小与零的显著性差异(*P<0.05, **P<0.01, ***P<0.001)。下同。* indicates that the effect is significantly different from zero (* P<0.05, ** P<0.01, *** P<0.001). The same below.图3 不同AMF接种处理下玉米(a)和紫花苜蓿(b)的菌根生长效应Fig.3 Mycorrhizal growth response of maize plants (a) and alfalfa plants (b) inoculated with different AMF species
2.4 不同接种处理下玉米和紫花苜蓿菌根磷和锌吸收效应
通过计算不同接种处理玉米和紫花苜蓿地上部的菌根磷/锌吸收效应后发现(图4):接种F.mosseae、G.versiforme、R.intraradices、C.etunicatum均显著促进玉米和紫花苜蓿地上部磷、锌的吸收,且菌根磷、锌吸收效应显著高于其他接种处理(图4);接种C.claroideum、A.scrobiculata(仅菌根磷吸收效应)显著抑制玉米地上部磷、锌的吸收;接种A.scrobiculata(仅菌根锌吸收效应)和D.spurca对玉米地上部磷、锌吸收均无显著影响。接种A.scrobiculata、D.spurca玉米菌根磷(图4(a))、锌(图4(c))吸收效应显著高于接种C.claroideum;除C.claroideum显著促进紫花苜蓿地上部磷吸收和A.scrobiculata显著抑制紫花苜蓿地上部锌吸收外,接种C.claroideum、A.scrobiculata和D.spurca对紫花苜蓿地上部磷、锌吸收无显著影响;紫花苜蓿菌根磷(图4(b))、锌(图4(d))吸收效应表现为接种C.claroideum>接种D.spurca>接种A.scrobiculata。

图4 不同AMF接种处理下玉米菌根磷(a)、锌(c)吸收效应与紫花苜蓿菌根磷(b)、锌(d)吸收效应Fig.4 Mycorrhizal phosphorus (a) and zinc (c) uptake response of maize shoot and mycorrhizal phosphorus (b) and zinc (d) uptake response of alfalfa shoot inoculated with different AMF species
2.5 玉米和紫花苜蓿根系AMF gDNA丰度及其与根系总侵染率的相关分析
接种F.mosseae玉米根系AMF gDNA丰度显著高于接种R.intraradices,而接种C.claroideum玉米根系中未检测到C.claroideumgDNA(图5(a));接种F.mosseae紫花苜蓿根系AMF gDNA丰度显著高于接种R.intraradices,后者又显著高于接种C.claroideum(图5(b))。
紫花苜蓿根系AMF gDNA丰度的lg值与根系总侵染率(图5(d))呈极显著相关(r=0.83,P<0.001)。而玉米根系两者不显著(图5(c))。

图5 不同AMF接种处理玉米根系AMF gDNA丰度(a)及其与根系总侵染率的相关性(c),紫花苜蓿根系AMF gDNA丰度(b)及其与根系总侵染率的相关性(d)Fig.5 Abundance of mycorrhizal gDNA inoculated with different AMF species (a) and its correlation analysis with total colonization rate (c) in maize root, and Abundance of mycorrhizal gDNA inoculated with different AMF species (b) and its correlation analysis with total colonization rate (d) in alfalfa roots
2.6 玉米根系ZmPht1;6相对表达量及其与菌根磷吸收效应的相关分析
不同AMF菌种显著影响玉米根系ZmPht1;6基因的相对表达量。接种F.mosseae玉米根系ZmPht1;6的相对表达量远高于其他接种处理,接种G.versiforme和C.etunicatum次之,显著高于接种R.intraradices和D.spurca,后两者玉米根系ZmPht1;6的相对表达量又显著高于接种A.scrobiculata和C.claroideum(图6(a))
玉米根系ZmPht1;6基因的相对表达量的lg值与地上部菌根磷吸收(图6(b))呈极显著相关(r=0.88,P<0.001)。

图6 不同接种处理玉米根系ZmPht1;6基因的相对表达量(a)及其与菌根磷吸收效应的相关性(b)Fig.6 Relative expression of ZmPht1;6 inoculated with different AMF species in maize roots (a) and its correlation analysis with mycorrhizal P uptake response (b)
2.7 AMF生长与功能的相关分析和多元回归分析
将植株根系AMF总侵染率和根外菌丝密度分别与菌根生长效应和磷、锌吸收效应进行Pearson相关性分析,结果显示玉米和紫花苜蓿根系AMF总侵染率及根外菌丝密度均与其菌根生长效应和磷、锌吸收效应具有较高的正相关性,相关系数达0.58~0.90(表3)。

表3 AMF生长与植株菌根生长效应和磷、锌吸收效应的相关性分析Table 3 Correlation analysis between AMF growth indices with mycorrhizal growth,>phosphorus and zinc uptake response of host plants
用根系菌丝侵染率、丛枝侵染率、泡囊侵染率、总侵染率及根外菌丝密度作为自变量,菌根生长效应和磷、锌吸收效应分别作为因变量进行逐步回归分析。结果发现,对玉米而言,仅根系AMF总侵染率进入回归方程,回归方程分别为:菌根生长效应=总侵染率×0.012-0.066;菌根磷吸收效应=总侵染率×0.017+0.009;菌根锌吸收效应=总侵染率×0.016-0.007。在此模型中根系AMF总侵染率分别解释了79.0%的玉米菌根生长效应变异、77.6% 的菌根磷吸收效应变异以及74.1%的菌根锌吸收效应变异。对紫花苜蓿而言,仅根系AMF菌丝侵染率均进入回归方程,回归方程分别为:菌根生长效应=菌丝侵染率×0.03+0.413;菌根磷吸收效应=菌丝侵染率×0.038+0.651;菌根锌吸收效应=总侵染率×0.033+0.102。在此模型中根系AMF菌丝侵染率分别解释了76.5%的菌根生长效应变异、72.6%的菌根磷吸收效应变异以及74.0%的菌根锌吸收效应变异。
3 讨 论
AMF生长具有高度谱系保守性,并表现出一定程度的菌株特异性[8-9]。本试验也得出了相似结果,球囊霉科表现出高度谱系保守性:接种F.mosseae、R.intraradices和G.versiforme的侵染率均较高;近明球囊霉科则表现出一定的菌株特异性:接种C.etunicatum的侵染率较高,但接种C.claroideum的侵染率较低,在玉米根系中几乎无侵染(表2,图2)。由于菌种库菌种的限制,本试验同一科仅比较了球囊霉科和近明球囊霉科科内菌种间的差异,对于其他科AMF的研究还需进一步探索。
AMF对植物的生长和营养吸收表现出正效应[30-31]、负效应[31-32]或无效应[1]。Meta分析发现AMF促进了谷物的产量[33]和锌含量[34],且其对植物磷的贡献最高可达到90%[35]。本研究中发现接种F.mosseae、R.intraradices、G.versiforme、C.etunicatum对玉米和紫花苜蓿生长和磷、锌吸收均表现为正的促进效应,A.scrobiculata、D.spurca对玉米和紫花苜蓿生长和磷、锌吸收表现为无显著影响或抑制作用,C.claroideum对紫花苜蓿生长和磷吸收为促进效应,而对玉米生长和磷、锌吸收却表现出抑制效应(图3,图4)。Wagg等[36]的研究结果也发现,接种C.claroideum提高了红车轴草地上部生物量,却抑制了多花黑麦草的生长,这可能是与植物根系形态特征有关[37]。本研究中植株的菌根生长效应、磷锌吸收效应与菌根侵染率及根外菌丝密度均表现出显著的正相关关系(表3),且回归分析发现菌丝侵染率或总侵染率能解释植株菌根生长和磷、锌吸收效应的72.6%~79.0%变异,表明AMF在根系的侵染指标(菌丝侵染率和总侵染率)是影响宿主植物地上部生物量和磷、锌吸收量的主要因子。
本试验中紫花苜蓿根系AMF gDNA丰度与根系总侵染率的趋势具有较高的相关性(图5(d)),该结果与已有研究结果类似[17, 20-21]。玉米根系F.mosseae的gDNA丰度显著高于接种R.intraradices(图5(a)),但在紫花苜蓿中则呈相反的趋势(图5(b))。然而,显微观察法测定的侵染率结果显示,玉米和紫花苜蓿根系2 种AMF的总侵染率并未出现显著差异(表2)。产生这些差异的原因可能是基于DNA的定量PCR测定方法比传统显微观察法更灵敏。已有研究报道Funneliformismosseae、Rhizophagusintraradices、Claroideoglomusclaroideum、Gigasporamargarita、Scutellosporapellucida等5 种AMF的定量PCR方法测定gDNA丰度。结合当时实验室及菌种库的条件,本试验仅对其中3 种菌种的gDNA进行测定,对于其他AMF菌种的测定还需进一步探索。
不同AMF诱导蒺藜苜蓿和番茄等植物中磷转运蛋白的表达能力不同[38-39]。本试验中接种F.mosseae玉米根系ZmPht1;6的相对表达量远高于其他接种处理(图6(a)),但接种F.mosseae玉米地上部菌根磷吸收效应显著低于接种G.versiforme,且与接种R.intraradices差异不显著(图4(a))。可能原因是F.mosseae菌丝吸收磷的效率较低[40]。已有研究结果表明受AMF诱导的磷转运蛋白ZmPht1;6表达能力与玉米地上部磷吸收量具有极显著的正相关关系[41],然而近期研究却发现ZmPht1;6表达能力与磷吸收相关性不确定[42]。本试验中接种球囊霉科AMF玉米根系ZmPht1;6基因的相对表达量与菌根磷吸收效应差异趋势并不完全一致,但不同AMF对玉米地上部菌根磷吸收效应和ZmPht1;6基因相对表达量的影响趋势基本一致,相关系数达0.88(图6(b))。因此,在一定程度上,ZmPht1;6的相对表达能力可反映AMF的吸磷能力[43]。
4 结 论
AMF的生长特性(总侵染率和根外菌丝密度)与其功能(宿主植物地上部生物量、养分(磷和锌)菌根吸收效应)之间均具有较高的正相关性;多元回归分析表明根系AMF侵染率能够较好地解释植株地上部生长和菌根磷、锌吸收效应的差异;实时定量PCR能很好地反映紫花苜蓿根系AMF侵染;玉米根系ZmPht1;6的相对表达量在一定程度上可以反映AMF的吸磷能力。由于本试验采用的AMF种类有限,测定的功能也仅限于植物生长和养分吸收两方面,今后仍需要进行大范围菌种和多功能的验证,为开发AMF资源提供科学依据。