维生素D在子痫前期氧化应激中的作用研究
刘艳清,石琪
子痫前期(preeclamsia,PE)是发生在妊娠20周以后的妊娠期特有疾病,是妊娠期高血压疾病组的一个分类,发病率3%~8%,其临床表现主要为高血压和蛋白尿,严重者可引起胎盘早剥、HELLP综合征以及全身多器官功能受损或衰竭,甚至造成孕产妇或胎儿死亡。目前有证据支持PE可预防,如服用小剂量阿司匹林[1],但由于PE是多机制致病,有必要进一步寻找具有预防作用的干预手段,协同防控PE发生。研究指出氧化应激在PE的病理机制中起重要作用,维生素D具有抗氧化应激作用[2-3]。故本文就维生素D与PE的氧化应激机制加以综述,探讨补充维生素D对PE患者氧化应激状态的影响,为PE的预防和临床治疗提供新途径。
1 子痫前期与氧化应激
1.1 氧化应激与妊娠
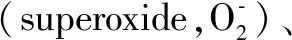
在正常妊娠孕妇血清中,ROS的生成会生理性增加,这是一种孕期特有的全身炎性反应,是正常的生理现象,与胚胎发育和妊娠维持有关[4]。随着妊娠的进展,如果机体的氧化/抗氧化平衡被打破,就会产生过多的ROS,从而发生氧化应激。氧化应激不仅与病理性炎症、细胞组织凋亡和坏死有关,还与子痫前期密切相关。研究表明子痫前期患者血清中ROS含量明显高于健康孕妇,而抗氧化物质SOD、CAT、GSH等低于健康孕妇[5]。总之,子痫前期患者体内因活性氧物质产生过多,抗氧化物质不足,而产生氧化应激。
1.2 子痫前期胎盘氧化应激
为了阐明氧化应激的起源,人们对滋养细胞,特别是暴露于缺氧/复氧的HTR8/SVneo细胞(HTR-8/SVneo细胞系由感染了SV40大T抗原的3个月前绒毛外滋养细胞发育而成)进行了许多研究。在该细胞模型中,氧化应激反应可诱导特殊富含AT序列结合蛋白1(special AT-rich sequence binding protein 1,SATB1)的异常调节。SATB1定位于滋养细胞,异常调节的SATB1会抑制滋养细胞的迁移和侵袭[6]。滋养细胞的侵润能力受损会使胎盘着床浅以及子宫螺旋动脉重塑不足,血管阻力增大,胎盘灌注不足,引起胎盘低氧分压。低氧分压会引起氧化应激,氧化应激可致胎盘的滋养细胞系凋亡、老化,进一步影响其合体化、浸润性分化和子宫螺旋动脉重塑,使已经发生缺氧的胎盘缺氧情况更加严重,如此形成恶性循环,导致子痫前期[7-8]。氧化应激除了发生于胎盘滋养细胞外,还发生在胎盘巨噬细胞系的胎儿胎盘Hofbauer细胞。子痫前期时,胎儿Hofbauer细胞数量下降,CD74表达下调和白细胞介素(interleukin,IL)-10分泌减少,从而发生氧化应激和炎性反应[9]。
1.3 子痫前期血管内皮氧化应激
子痫前期不仅是由胎盘氧化应激引起的,而且还由血管内皮功能障碍引起。血管内皮损伤使血管通透性增加导致毛细血管静水压力降低,血液粘度增加,胶体渗透压增加,改变毛细血管灌注,导致缺氧而诱发氧化应激[8,10]。内皮系统功能障碍主要是因为血管内皮细胞(endothelial cells,ECs)被激活,激活的ECs可促进白细胞黏附和通透性紊乱,导致全身炎症和水肿。ECs表面表达白细胞黏附分子如细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管细胞黏附分-1(vascular cell adhesion molecule-1,VCAM-1)、E-选择素、P-选择素。白细胞通过这些表面分子黏附在内皮细胞上,产生ROS和蛋白酶,导致内皮细胞损伤[11]。ICAM-1、VCAM-1和趋化蛋白-1(chemoattractant protein-1,MCP-1)的表达由肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)诱导,并由ROS依赖机制控制[12]。TNF-α在PE血浆中含量较高,通过NOX直接诱导氧化损伤,氧化损伤后产生O2-,通过清除NO来损害内皮依赖性扩张,而发生氧化应激[13]。PE患者分泌的许多循环因子(细胞因子、活化的中性粒细胞、过氧化物脂质、XO、胎儿血红蛋白等)能够活化NOX,NOX活化会导致ROS产生增加,ROS生成增加刺激线粒体发生氧化应激反应[14-15]。
综上可知,氧化应激不仅发生于胎盘组织还发生于血管内皮系统,是导致PE发生的重要因素。PE发病机制很复杂,氧化应激只是其中一个致病机制,目前对PE氧化应激的了解仍不透彻,需要继续探索,以寻找抗氧化应激的更多途径,指导今后的临床工作。
2 维生素D与子痫前期
2.1 维生素D与妊娠
维生素D是一种脂溶性维生素,负责钙和磷在小肠黏膜细胞的吸收,维持人体骨骼健康,大多数生物作用是由其受体(vitamin dreceptor,VDR)的激活而开始的。维生素D活性形式包括25-羟维生素D3[25-(OH)D3]和1,25-二羟维生素D3[1,25-(OH)2D3]。1,25-(OH)2D3是维生素D最主要的活性表现形式,活性度比25-(OH)D3高出500~1 000倍,25-(OH)D3是维生素D在体内的主要表现形式,代表人体内维生素D的储藏水平,与维生素D缺乏的临床症状有关。研究表明维生素D缺乏的孕妇患PE的风险增加,孕期补充维生素D可以降低PE的发生率,与安慰剂相比,降低PE的风险约为57%[16]。
2.2 维生素D维持子痫前期胎盘功能
妊娠期维生素D主要在胎盘部位代谢,胎盘组织中的维生素D及VDR在维持胎盘功能方面起重要作用。维生素D及VDR会影响胎盘滋养细胞存活能力,参与胎盘滋养层的抗氧化应激及抗炎作用,并且维持妊娠相关激素的合成[17-18]。动物模型研究中,1,25(OH)2D3改善子宫胎盘灌注压降低大鼠的胎盘滋养细胞的氧化应激水平,抑制凋亡,上调自噬,最终改善PE大鼠母儿结局[19]。
2.3 维生素D改善子痫前期血管内皮功能
维生素D还参与血管内皮生长因子(vascular endothelial growth factor,VEGF)生成。研究发现在人脐静脉内皮细胞培养基中添加1,25(OH)2D3不仅可使VDR的表达增加,而且使VEGF及其受体表达上调[20]。VEGF可改善ECs的血管生成特性,促进其增殖和迁移。内皮祖细胞(endothelial progenitor cells,EPCs)是ECs的前体细胞,被认为在维持血管稳态、修复受损的新生血管和血管内皮等方面起重要作用[21]。晚期生长EPCs被称为内皮集落形成细胞(endothelial colony-forming cells,ECFCs),维生素D在VEGF作用下有促进其增殖和促血管生成的作用[22]。母体循环中造血EPCs细胞数量减少被认为是子痫前期内皮修复能力受损的潜在迹象[23]。孕期补充维生素D能促进VEGF生成,改善因EPCs数量减少引起的血管内皮受损,达到预防子痫前期的作用。内皮微粒(endothelial microparticles,MPs)是ECs脱落的囊泡结构,在生理条件下,对维持血管稳态起积极作用,氧化应激条件下,通过损害乙酰胆碱诱导的血管舒张和NO的产生来促进血小板聚集,损害血管生成,并影响血管张力,产生超氧自由基[24]。研究证实MPs在子痫前期中升高[25],维生素D能抑制MPs释放和超氧化物生成[26],从而预防子痫前期的发生。
综上,维生素D对PE具有抗氧化应激及改善血管内皮功能的作用,主要表现在以下几方面:① 调节胎盘滋养细胞活力,促进滋养细胞侵袭,防止胎盘浅作床,预防PE发生;② 促进VEGF生成新生毛细血管,改善血管内皮功能,降低PE危险因素的负面作用;③ 增加ECFCs的数量,改善血管内皮修复能力,抑制PE的发生。④ 抑制MPs脱落,减少超氧化物产生,改善PE的氧化应激状态。众所周知,维生素D与钙密切相关,孕期维生素D联合钙剂补充对PE的预防是否优于单独服用维生素D呢?据2017年的一项荟萃分析得出,与安慰剂相比,孕期补充维生素D和钙对子痫前期的预防作用,维生素D是第一名,其次是钙,然后是维生素D加钙[16]。该研究表明单独服用维生素D优于维生素D加钙剂联合服用。产生这种结果的原因,尚不是很清楚,可能与体内维生素D对子痫前期的作用机制有关,需要进一步研究。
3 维生素D在子痫前期氧化应激中的作用
3.1 维生素D缺乏增强子痫前期氧化应激
氧化应激与血管内皮损害、病理性炎症有关,会引起孕早期流产、早产、胎儿宫内发育迟缓、PE等。而维生素D的缺乏与上述病理过程也相关。维生素D缺乏会增强氧化应激,促使大量炎症因子释放,减少机体VDR和1-α-羟化酶合成,造成内皮功能障碍,使机体抗氧化能力减弱[27]。
近年来,研究指出维生素D与PE氧化应激密切相关。当血浆1,25(OH)2D3低于50 nmol/L时,妊娠期间的氧化应激水平会升高[28]。维生素D与PE的预防和治疗成正相关,对胎盘和血管内皮有益。维生素D可作为胎盘细胞色素P450scc的竞争性抑制剂防止丙二醛(malondialdehyde,MDA)的产生,能够抑制COX-2上调和滋养细胞产生血栓素,减轻PE的氧化应激反应[29-31]。维生素D起抗氧化作用,保护PE患者细胞内蛋白质和细胞膜不受氧化损伤,保护血管内皮不受氧化应激反应的损害,增加血管内皮和细胞的抗氧化能力,增加细胞内的SOD与CAT的活性[32]。
3.2 维生素D抗子痫前期氧化应激机制
目前,维生素D和PE氧化应激之间的作用机制尚未完全清楚,笔者认为可能与两个方面相关:① VDR基因多态性。1,25(OH)2D3通过VDR发挥生物学效应。VDR基因会影响生物学效应的发挥,因为VDR基因调控着两百多个基因,通过与类视黄醇x受体结合形成异二聚体,介导维生素D的作用。人VDR基因位于12号染色体长臂,是由8个内含子和9个外显子组成,包含有多个单核苷酸多态性位点,常见的为BsmI(rsl544410)、ApalI(rs7975232)、 TaqI(rs731236)以及FokI(rs2228570)等。马亚楠等[33]在2015年通过检测163例子痫前期患者和213例正常孕妇的VDR基因rs2228570位点的多态性发现VDR基因rs2228570位点多态性与PE的遗传易感性相关,GG基因型者发病风险较高[33]。Rezavand等[34]在2019年研究发现VDR FokI多态性与产妇高收缩压和舒张压有关,VDR FokI C等位基因与PE有关联,体内1,25(OH)2D3及VDR影响孕前BMI、孕周以及孕期血压。研究发现,在严重PE中,VDR表达降低会导致氧化应激,损伤血管内皮,使其保护血管内皮细胞和平滑肌细胞的能力下降[35]。VDR FokI位点的多态性与氧化应激有关[36],VDR FokI基因多态性参与PE氧化应激,影响PE血压,增加PE易感性。② 炎症反应。维生素D与炎症密切相关,维生素D缺乏患者血清中促炎因子含量较高。维生素D能够抑制核转录因子的活性,减少IL-6、IL-1、TNF-α的产生。TNF-α等炎性因子入血能诱导NOX引起氧化损伤,同时导致ROS生成增加刺激线粒体氧化应激[15],而ROS与炎症反应有关,在体外培养颗粒细胞中添加炎性因子IL-1、IL-6、TNF-α后,结果显示经炎性因子处理过的颗粒细胞中的ROS水平明显升高[37]。维生素D能促进机体单核细胞分化为淋巴细胞、巨噬细胞以及树突状细胞,在炎症反应中起重要作用。Vishnyakova等[9]认为氧化应激反应可发生于PE胎盘巨噬细胞系,引起CD74表达下调和IL-10分泌减少,促进氧化应激和炎性反应。
综上,VDR FokI 基因多态性参与氧化应激反应,维生素D缺乏使机体发生炎症反应,产生过多ROS,产生氧化应激损伤,引发PE。可设想在今后的临床工作中是否通过控制维生素D的水平来调节人体的氧化应激水平,从而达到预防和治疗PE的目的,这需要更多的实验研究来证明。
4 结语
PE作为一种临床常见的妊娠合并症,发病机制复杂。目前病因尚不明确,临床尚未发现有效的治愈方案,终止妊娠为唯一有效治疗方法。PE的日常管理不仅需要关注母儿健康,也需要随访观察产后母儿的远期并发症,建立长期的临床监管策略,做到疾病及并发症的防、治相结合。PE患者体内有较高水平的氧化应激,并且通常存在维生素D水平的不足。补充维生素D不仅可以改善胎盘功能,还能减轻母体血管内皮损伤,达到减轻氧化应激水平的作用,更可能通过VDR激动减轻母体炎症反应,调节机体氧化/抗氧化体系的生理动态平衡,从而对PE及其并发症的防与治产生影响,而且有很好的药物依从性。故孕期补充维生素D来预防和治疗PE引起更多临床医生的关注。先前关于维生素D在PE氧化应激中的作用研究甚少。那么,接下来可以关注维生素D预防PE氧化应激的最小临床有效剂量、每日最佳推荐剂量以及维生素D与其他干预措施协同作用,减少氧化应激的发生,达到最大程度预防PE的发生,为PE的防治提供新途径。

