CSF1R基因突变致遗传性弥漫性球体细胞脑白质脑病1例报告
马伟锋, 张弥兰, 张 涛, 蒋玙姝, 张梦歌, 贾琳琳, 周珂珂, 贾亚珍, 金 珂, 王晓娟, 陈 敬, 赵真珍, 李 玮
遗传性弥漫性球体细胞脑白质脑病(hereditary diffuse leukoencephalopathy with spheroids,HDLS)是一种罕见的成人发病的常染色体显性遗传脑白质病,外显率较高,临床以运动障碍、进行性认知功能障碍和精神行为异常为主要表现[1]。据相关文献报道,集落刺激因子1受体(colony-stimulating factor 1 receptor,CSF1R)基因是目前确定的唯一致病基因[2]。现将我院首诊的1 例 HDLS 报告如下,以增加临床医生对本病的认识。
1 临床资料
1.1 发病情况 先证者:男性,48岁,主因“肢体麻木1 y余,肢体无力伴智能减退10 m,加重4 m”于2020年1月6日收入河南省人民医院神经内科。现病史:入院1 y余前出现左侧肢体麻木,以肘关节以远、膝关节以远明显,有压迫感、针刺感,就诊于当地医院,行头部MRI检查后诊断为“脑梗死”,具体治疗不详,症状无好转;10 m前出现左侧肢体无力,上肢持物费力,行走拖步,并出现性格改变、智能减退,表现为强哭强笑,易发脾气,容易忘记刚发生的事情,计算能力下降,伴头晕、头昏,偶有小便失禁;4 m前左侧肢体无力较前稍加重,伴言语不利、吞咽困难、咽喉部堵塞感;3 m前行走时向前摔倒1次,后出现左上肢不自主抖动,自己不能控制姿势,就诊于我院,行头部MRI(见图1),示颈椎、胸椎磁共振无明显异常,诊断为“腔隙性脑梗死、脑白质病变、多发性硬化待排”,2020年1月6日来我院复查。发病来神志清,精神欠佳,饮食差,睡眠正常,大小便正常,体重无明显变化。
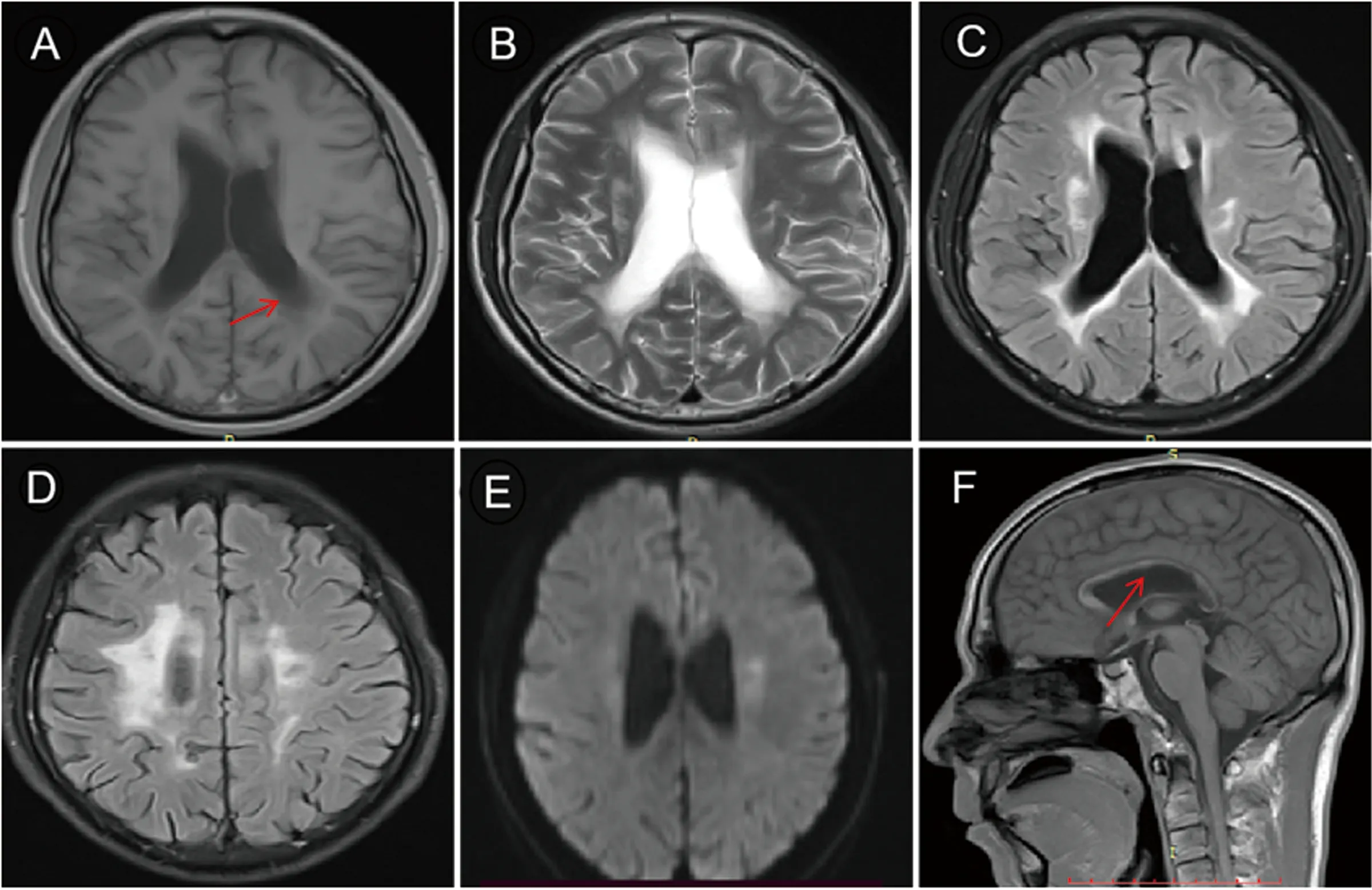
图1 头部MRI(2019年9月20日)A~F:显示胼胝体、双侧放射冠、基底节区、双侧脑室旁白质、双侧额顶叶皮质下及双侧半卵圆中心斑片状、斑点状异常信号,T1WI(A)呈低信号,T2WI(B)及T2-FALIR(C、D)呈高信号,DWI(E)呈等或稍高信号,矢状位(F)显示胼胝体体积缩小
1.2 既往史、个人史及家族史 3 m前发现乙肝小三阳,口服抗病毒药物治疗;无高血压、糖尿病及冠心病病史,无手术、外伤史。无化学、放射性和有毒物质接触史。吸烟史30 y,每天20支;饮酒史10 y,每次100 ml,已戒酒20 y。父母、姐妹及子女均体键,家族中无类似病史,无其他遗传病史。
1.3 体格检查 体温36.2 ℃,脉搏78 次/min,呼吸19 次/min,血压128/86 mmHg,(1 mmHg=0.133 kPa)。心肺腹检查无异常。神经系统查体:神清,精神差,记忆力、计算力减退,轻度构音障碍,双侧咽反射迟钝,余颅神经(-)。左下肢肌容积减少,左侧肢体肌力4级,右侧肢体肌力5级,肌张力正常,四肢腱反射亢进,双侧踝阵挛阳性,双侧Hoffman征阳性,双侧Babinski征阳性。左侧指鼻试验欠稳准,左手轮替试验笨拙,左上肢意向性震颤,右侧共济运动协调。跛行步态,向左偏斜。左侧浅感觉减退,深感觉正常,右侧肢体深浅感觉正常;脑膜刺激征阴性。
1.4 辅助检查 乙肝五项:乙肝病毒表面抗原(HBsAg)阳性,乙肝病毒表面抗体(HBsAb)阴性,乙肝病毒e抗原(HBeAg)阴性,乙肝病毒e抗体(HBeAb)阳性。血常规、尿常规、肝功能、肾功能、血脂、血糖、电解质、心肌酶谱、同型半胱氨酸、凝血功能、D-二聚体、叶酸、维生素B12、甲状腺功能三项、风湿三项、免疫全套、肿瘤标志物、ANCA、ANA及ENA化验无异常。腰椎穿刺术:脑脊液压力30 mmH2O,压颈后60 mmH2O,脑脊液常规、生化正常,细胞学、IgG型-副肿瘤抗体(抗-CV2、抗-PNMA2、抗-Ri、抗-Hu)、寡克隆条带、IGM型-神经节苷脂抗体谱、TAM血清肿瘤相关物质检测、水通道蛋白4(AQP4)抗体及自身免疫性脑炎(NMDAR、LGI1)抗体均阴性。头部MRI显示(见图2):胼胝体、双侧放射冠、基底节区、双侧脑室旁白质、双侧额顶叶皮质下及双侧半卵圆中心斑片状、斑点状异常信号。颈椎、胸椎磁共振提示髓内未见明显异常。神经测评:简易智力量表评分21分,缺血指数量表3分,Rosen指数2分。Hamilton抑郁量表:22分;吞咽障碍筛查:EAT-10评分:5分,反复唾液试验不通过,洼田饮水试验Ⅱ级。脑电图未见明显异常。脑白质病相关基因检测(北京金准基因科技有限责任公司,2020年2月15日,见图3)示该患者在第5号染色体CSF1R基因第18号外显子区域(chr5:149435843)存在一处杂合突变:c. 2381T>C(胸腺嘧啶>胞嘧啶),导致氨基酸改变p. I794T(异亮氨酸>苏氨酸)。后期对其家属进行基因检测验证,显示其妹妹及儿子存在相同的杂合突变(见图4、图5),先证者父亲未见此突变,其母亲由于特殊原因未进行基因检测,并绘制遗传家系图(见图6)。

图2 头部MRI(A:2019年2月7日 B:2020年1月7日 C:2020年7月14日)A~C:显示双侧脑室旁白质DWI呈等或稍高信号

图3 先证者(Ⅱ2)在第5号染色体CSF1R基因第18号外显子区域(chr5:149435843)存在一处杂合突变:c. 2381T>C(胸腺嘧啶>胞嘧啶)
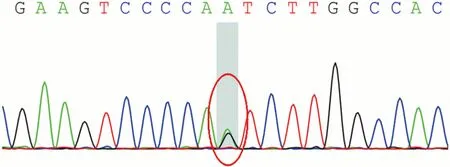
图4 先证者妹妹(Ⅱ4)CSF1R基因c. 2381T>C chr5:149435843杂合突变

图5 先证者儿子(Ⅲ2)CSF1R基因c. 2381T>C chr5:149435843杂合突变
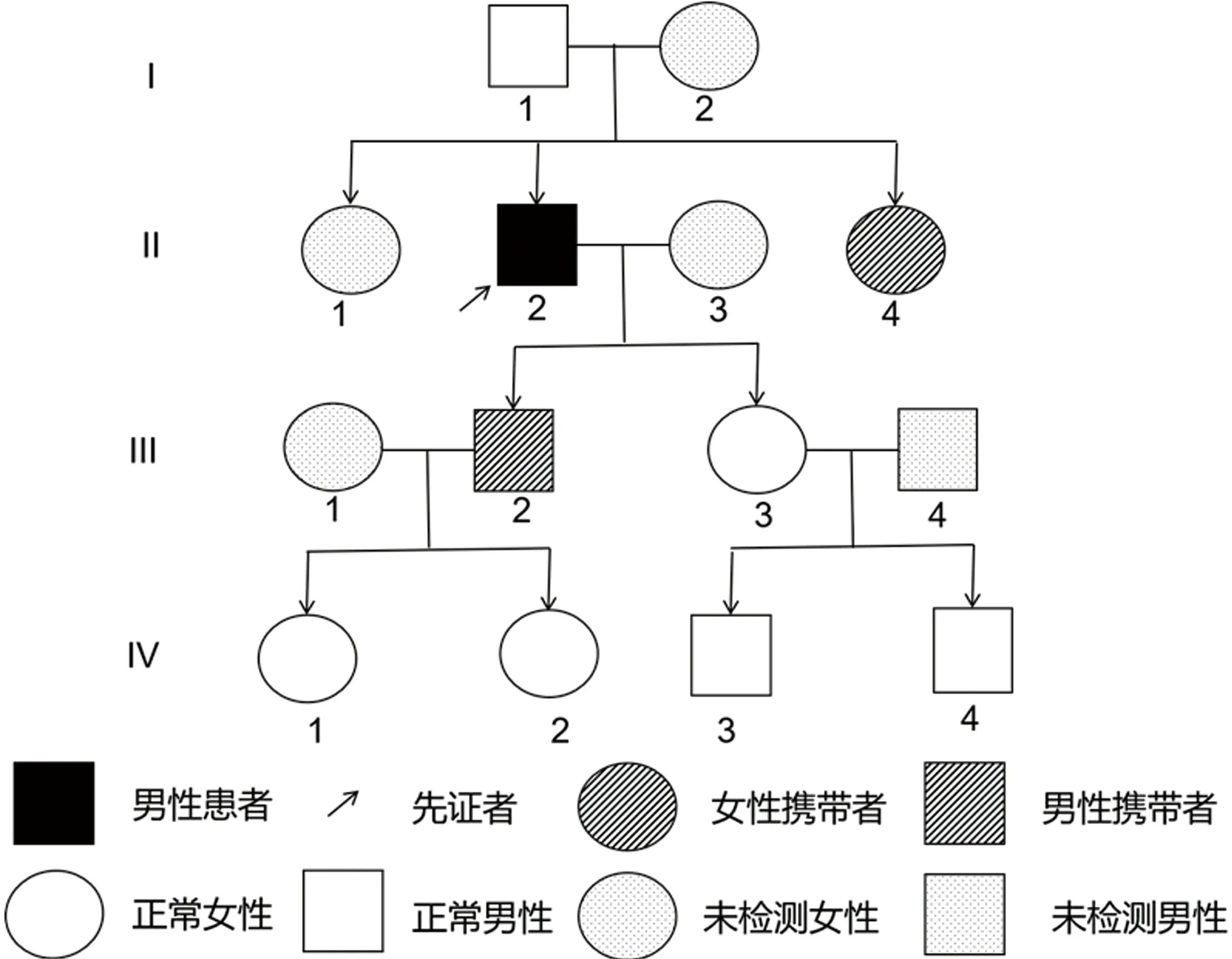
图6 HDLS患者家系图
1.5 诊断、治疗经过及病情转归 2019年9月18日就诊于我院神经内科,给予阿司匹林片抗血小板聚集、瑞舒伐他汀钙片降脂稳定斑块、丁苯酞改善循环、甲钴胺营养神经、天智颗粒及美金刚片改善智能、氟西汀片调节情绪、多巴丝肼片改善运动症状、“甲泼尼龙琥珀酸钠 500 mg qd 5 d”以及补钾补钙护胃等对症支持治疗。住院14 d后出院,患者头晕较前好转,仍有肢体麻木无力。2020年1月6日复查,经脑白质病基因检测结果回示,最终确诊为:遗传性弥漫性球体细胞脑白质脑病。2020年7月左侧肢体无力加重,行走需搀扶。后续随访发现患者于2021年1月出现吞咽困难加重,小便失禁,在上述治疗的基础上添加盐酸甲氯酚酯胶囊改善小便障碍及增稠剂改善吞咽功能治疗。
2 讨 论
HDLS是一种罕见的常染色体显性遗传性中枢神经系统脑白质脑病,属于神经系统退行性疾病。瑞典医生Axelsson于1984 年首次报道该疾病,HDLS临床表现多样,包括人格改变、认知障碍及帕金森综合征等[1]。2011年Rademakers等确定位于5q32染色体的CSF1R基因为该病致病基因,含22个外显子,其编码的CSF1R蛋白为含972个氨基酸的多肽,是Ⅲ型酪氨酸激酶受体,属于血小板衍生生长因子受体家族,主要影响单核巨噬细胞、神经胶质细胞的增值和分化[2]。目前有研究表明,CSF1R是小胶质细胞的关键调节剂,通过斑马鱼的实验,证明了CSF1R主要调节小胶质细胞的密度,而小胶质细胞的早期丢失可能加速了HDLS的发病[3]。HDLS最重要的病理特点是脑白质病变,在半卵圆中心和脑室周围白质广泛受累,主要表现为髓鞘的疏松及空泡化、有髓鞘纤维丢失、神经胶质增生、富脂蛋白的巨噬细胞和小胶质细胞活化,其中球索轴样变是其特征性的病理改变[4,5]。
HDLS以常染色体显性遗传多见,但仍有36%的HDLS病例是明显的散发性病例。本例患者的父亲无杂合基因突变,母亲由于其他原因没有进行基因检测,其妹妹和儿子均出现相同的杂合突变。目前其他家属均未出现相应的临床症状,但对其仍应定期随访。因此,这些零星病例是否反映了表型不完全或不外露,或者是由CSF1R基因的从头突变引起的,目前尚不清楚。
HDLS患者发病年龄从10岁到71岁不等,平均发病年龄为43岁[6]。最常见的临床特征是认知障碍,其次是精神症状、帕金森综合征、步态障碍和吞咽困难。其临床表现主要分为两组症状:神经精神症状和运动症状。神经精神症状包括进行性认知功能下降、抑郁、冷漠、焦虑和其他行为或性格改变。运动症状包括锥体外系症状、肢体无力、构音障碍、吞咽困难和共济失调等[2]。本例患者以肢体麻木无力起病,逐渐出现记忆力减退、性格改变、震颤及共济失调等症状,符合既往HDLS的相关报道病例特征。HDLS常见影像学表现为双侧不对称性深部和皮质下白质受累,主要位于额叶、额顶叶、半卵圆中心、脑室周围、胼胝体或皮质脊髓束等部位,一般皮质下U型纤维、脑干和小脑皮质无明显异常信号[7,8]。典型的MRI表现是持续进展的DWI白质高信号和胼胝体萎缩。矢状位DWI沿大脑皮质的轴突纤维显示出线性高强度信号,在侧脑室前角周围的深部脑白质中可见皮质下钙化提示有髓纤维脱髓鞘、坏死和神经胶质增生[9]。本例患者头部MRI显示明显的胼胝体萎缩、双侧脑室旁白质、双侧额顶叶皮质下及双侧半卵圆中心等部位斑片状、斑点状稍长T1稍长T2信号影,T2-FALIR呈高信号,DWI呈稍高信号,多次MRI随访双侧脑室后角旁脑白质量明显减少,胼胝体体积进一步缩小,结合反复多次DWI持续脑白质高信号(图2),符合以往报道HDLS的征象,临床医生应考虑HDLS的可能,影像学纵向评估对疾病的诊断也有很大帮助[10]。本病尚需与帕金森综合征、多发性硬化、多种其他遗传性脑白质病变[11]或伴脑白质病变的遗传性脑小血管病[12]等相鉴别。Sundal等[13]报道的1例患者,表现为锥体束征、脑干和小脑症状,头部MRI和脑脊液提示为多发性硬化,后期通过基因检测发现先证者和其兄弟姐妹均携带相同的CSF1R突变。
目前,尚无针对该疾病的特定治疗方法,疾病进展后可能会逐渐失去运动功能,导致卧床,最终死于肺部感染或其他继发感染等并发症[14]。国外报道异体造血干细胞移植治疗HDLS患者可以维持病情的稳定[15],但在国内目前未有此种治疗方案,仅对症治疗。我们可更深入地研究HDLS的发病机制,以期找到特异性高的治疗方法。
总而言之,由于HDLS发病年龄的不确定性,加之临床症状的不典型和多样性,造成临床医生对HDLS的误诊率偏高。在临床工作中,对于青年起病,临床症状和影像学检查不能用其他疾病解释的脑白质病变,临床医生应警惕遗传性脑白质病的可能性,尽早完善患者及家属的基因检测,必要时进行产前基因检测,以降低其后代患病风险。

