IL-15对膝关节骨性关节炎患者外周血单个核细胞的影响
汪 昊,徐 斌,魏松松,徐洪港,王 瑞,吴 磊,李 博
骨关节炎(osteoarthritis,OA)是一种慢性退行性关节疾病,OA以滑膜炎症和软骨破坏为特征,OA在早期阶段,其关节内部发生的分解作用和抗炎合成过程也在持续发生,其中关键作用是免疫细胞和细胞因子网络内的相互作用,所以细胞因子在OA的进展中起着重要作用。有研究显示OA患者滑膜中有大量NK细胞浸润,且NK细胞比例随着疾病严重程度的增加而上升,提示了NK细胞确实参与了OA的进展。NK细胞能够通过释放细胞因子如干扰素γ(interferon-γ,IFN-γ)和肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)促进炎症的发生。前期的预实验显示膝骨性关节炎(knee osteoarthritis, KOA)患者外周血中白细胞介素15(interleukin-15,IL-15)水平高于健康对照者。该研究主要分析IL-15对KOA患者和健康对照者外周血中NK细胞受体及单个核细胞(peripheral blood mononuclear cells, PBMCs)的影响。
1 材料与方法
1.1 研究对象
KOA外周血标本取自30例安徽医科大学第一附属医院患有KOA的住院患者,其中男14例,女16例,年龄61~74(66.83±4.07)岁,所有患者均符合KOA诊疗指南(2018年版)中的诊断标准,健康对照(healthycontrol, HC)组外周血来源于35例招募的无KOA病史的志愿者,男20例,女15例,年龄18~49(33.65±7.91)岁,受试者的筛选均经高年资医师确认。排除标准:① 膝关节感染患者;② 类风湿性关节炎患者;③ 红细胞沉降率、类风湿因子升高患者;④ 滑膜炎症患者;⑤ 近期服用非甾体类抗炎药患者。本研究通过本院伦理委员会批准,所有受试者均签署知情同意书。1.2 主要试剂
基因重组人IL-15、BV510标记的CD3单克隆抗体、BV421标记的CD56单克隆抗体、FITC标记的CD69单克隆抗体、PE-CY7标记的CD69单克隆抗体、PE标记的CD94单克隆抗体、APC标记的NKG2D单克隆抗体均购自美国BD公司;淋巴细胞分离液(Ficoll)、磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自美国Sigma公司;RPMI-1640培养液购自美国HyClone公司、胎牛血清(fetal bovine serum,FBS)购自美国HyClone公司;青霉素、链霉素购自杭州市四季青生物技术有限公司;IL-15、TNF-α及IFN-γ的ELISA定量试剂盒购自上海江莱生物技术有限公司。1.3 方法
1
.3
.1
PBMCs的制备和细胞培养 从存放外周血的乙二胺四乙酸(EDTA)管中取出4 ml新鲜外周血,用等体积0.9%氯化钠溶液稀释,并缓慢加入至4 ml Ficoll溶液表面,2 000 r/min离心 30 min,轻轻吸出中间白色薄膜状细胞层,加入PBS重悬,1 800 r/min离心洗2遍后,即可得到高纯度的PBMCs。用0.4%锥虫蓝溶液染色后用细胞计数仪检测细胞总数和活细胞数,并用RPMI-1640完全培养基调整细胞浓度为2.0×10/ml加入到24孔板中,将KOA组分为两组,一是实验组加入IL-15(10 ng/ml),二是不加IL-15作为本组对照组。将HC组也分为两组,一是实验组加入IL-15(10 ng/ml),二是不加IL-15作为本组对照组。将培养板放置于37 ℃、5% CO培养箱中培养24 h。1
.3
.2
CCK-8检测PBMCs增殖能力 取提纯得到的高纯度PBMCs,接种细胞悬液(5 000个/孔)于96孔板中,实验组加入 IL-15(10 ng/ml),对照组加等量完全培养基,放置于37 ℃、5% CO培养箱中培养24 h。在每孔内加入10 μl的CCK-8试剂,培养板放置培养箱内继续培养4 h,用酶标仪测定450 nm处的吸光度值,该实验重复3次。1
.3
.3
流式细胞仪检测外周血NK细胞表面受体的表达情况 培养后的细胞悬液中加入BV510-CD3、BV421-CD56、FITC-CD69、PE-CY7-CD69、PE-CD94、APC-NKG2D避光共孵育30 min,以分析NK细胞表面受体CD69、CD94和NKG2D的表达状况,采用Beckman Coulter流式细胞仪进行检测,用CytExpert软件进行分析。1
.3
.4
细胞因子测定 空腹采集前臂静脉血3 ml,待试管中血液凝血后吸取试管中的上清液,3 000 r/min离心10 min,标本于-80 ℃保存。将PBMCs培养24 h后保留的上清液标本 3 000 r/min离心10 min,标本于-80 ℃保存。两者均应用ELISA法检测,分析方法和操作步骤按说明书进行,最低检测浓度小于 0.1 pg/ml。
2 结果
2.1 KOA组与HC组外周血IL-15的水平
KOA组外周血清中IL-15水平与HC组比明显升高,差异有统计学意义(t
=8.598,P
<0.01)。见图1。
图1 两组外周血中IL-15水平比较与HC组比较:**P<0.01
2.2 IL-15对两组PBMCs增殖能力的影响
结果显示IL-15对KOA组与HC组PBMCs的增殖能力并无影响,说明IL-15对NK细胞表面受体和PBMCs分泌细胞因子的影响并非由细胞增殖引起的,而是IL-15通过对细胞的刺激引起的。见图2。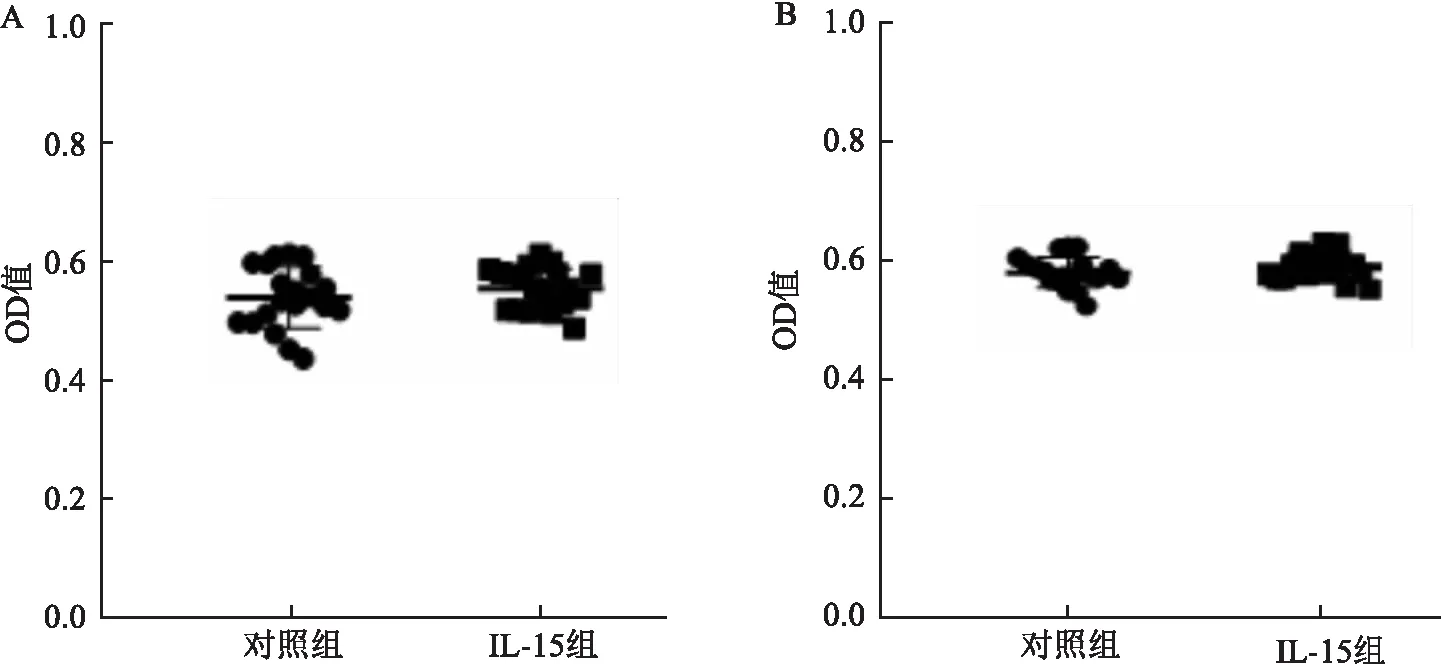
图2 CCK-8实验检测IL-15对两组PBMCs增殖能力的影响A:IL-15对HC组PBMCs增殖能力影响的半定量分析;B:IL-15对KOA组PBMCs增殖能力影响的半定量分析
2.3 IL-15对NK细胞CD69、CD94、NKG2D表达的影响
2
.3
.1
IL-15对NK细胞CD69表达的影响 图3结果显示未加IL-15(10 ng/ml)培养的KOA组与HC组NK细胞表面受体CD69的表达基本没有变化。经IL-15(10 ng/ml)刺激培养后分别增强了HC组NK细胞表面受体CD69的表达(t
=6.181,P
<0.01)和KOA组NK细胞表面受体CD69的表达(t
=7.085,P
<0.01),差异有统计学意义。说明IL-15能够升高NK细胞表面受体CD69的表达。
图3 流式细胞术检测NK细胞表面受体CD69+的表达和CD69+NK细胞半定量分析图与对照组比较:**P<0.01
2
.3
.2
IL-15对NK细胞CD94表达的影响 图4结果显示未加IL-15(10 ng/ml)培养的KOA组与HC组NK细胞表面受体CD94的表达基本没有变化,经IL-15(10 ng/ml)刺激培养后分别增强了HC组NK细胞表面受体CD94的表达(t
=3.033,P
<0.01)和KOA组NK细胞表面受体CD94的表达(t
=2.764,P
<0.01),差异有统计学意义。说明IL-15能够升高NK细胞表面受体CD94的表达。
图4 流式细胞术检测NK细胞表面受体CD94+的表达和CD94+NK细胞半定量分析图与对照组比较:**P<0.01
2
.3
.3
IL-15对NK细胞NKG2D表达的影响 图5结果显示未加IL-15(10 ng/ml)培养的KOA组比HC组NK细胞表面受体NKG2D的表达明显升高(t
=4.007,P
<0.01),经IL-15(10 ng/ml)刺激培养后分别增强了HC组NK细胞表面受体NKG2D的表达(t
=9.752,P
<0.01)和KOA组NK细胞表面受体NKG2D的表达(t
=6.107,P
<0.01),差异有统计学意义。说明IL-15能够升高NK细胞表面受体NKG2D的表达。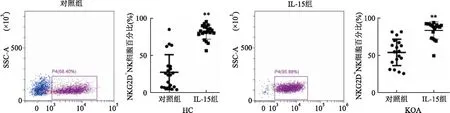
图5 流式细胞术检测NK细胞表面受体NKG2D+的表达和NKG2D+NK细胞半定量分析图与对照组比较:**P<0.01
2.4 加入IL-15(10 ng/ml)培养后两组PBMCs上清液中TNF-α、IFN-γ的表达含量
图6显示KOA患者的PBMCs经培养后上清液中TNF-α和IFN-γ的含量均比HC组升高。图6A和图6C结果显示HC组加入IL-15(10 ng/ml)细胞培养后的上清液中IFN-γ(t
=3.554,P
<0.01)和TNF-α(t
=4.144,P
<0.01)的含量比未加入的HC组明显升高。图6B和图6D结果显示KOA组加入IL-15(10 ng/ml)细胞培养后的上清液IFN-γ(t
=10.19,P
<0.01)和TNF-α(t
=8.177,P
<0.01)的含量比未加入的HC组明显升高,差异有统计学意义。说明IL-15能够提高KOA患者和健康对照者PBMCs产生TNF-α和IFN-γ的能力,且KOA患者的PBMCs对IL-15的刺激反应性更强。
图6 加入IL-15培养后两组PBMCs上清液中TNF-α、IFN-γ的表达含量A:HC组细胞培养后上清液中IFN-γ的半定量分析图;B:KOA组细胞培养后上清液中IFN-γ的半定量分析图;C:HC组细胞培养后上清液中TNF-α的半定量分析图;D:KOA患者细胞培养后上清液中TNF-α的半定量分析图;与对照组比较:**P<0.01
3 讨论
首先通过对KOA组和HC组外周血IL-15的测定来分析两者是否存在差异性,实验结果显示KOA患者外周血IL-15水平明显高于HC组。所以KOA患者外周血中升高的IL-15可能参与疾病的发生与发展。
根据NK细胞表面CD56分子的密度,NK细胞可分为CD56和CD56两个亚群。CD56NK细胞具有细胞毒性作用,CD56NK细胞能够产生丰富的细胞因子,NK细胞可能通过其细胞毒性和释放细胞因子参与OA的进展。然而NK细胞的效应功能受激活和抑制受体信号之间的平衡调节。其中CD69是NK细胞表面一种激活型受体,可在细胞被激活后迅速诱导表达,由于CD69NK细胞能够诱导单核细胞释放TNF-α,因此被认为是促进炎症产生的一种表达受体,并可能同时启动由NK细胞介导的免疫攻击。在加入IL-15(10 ng/ml)培养的情况下KOA组和HC组NK细胞的CD69受体表达均升高。说明在IL-15升高的情况下,NK细胞被激活,其细胞表面的CD69受体迅速表达,进而可能引起NK细胞通过分泌细胞因子来促进或抑制其他免疫细胞的功能。
NKG2D是能识别癌细胞和病毒感染细胞表达的应激诱导配体,对提高NK细胞毒性至关重要。在未加入IL-15(10 ng/ml)培养的情况下KOA组NK细胞表面受体NKG2D的表达与HC组比明显升高,说明KOA组的NK细胞可能已经处于某种激活状态。在加入IL-15(10 ng/ml)后,KOA组和HC组NK细胞表面受体NKG2D的表达均升高,说明IL-15能够升高NK细胞表面受体NKG2D的表达,从而可能提高NK细胞的细胞毒性来参与KOA的免疫应答反应。
CD94是NK细胞上表达的一种抑制性受体,然而在许多情况下抑制信号支配激活信号,因此可能通过CD94抑制受体表达的增多来激活NK细胞增强其对靶细胞的反应。实验结果显示IL-15能够增强KOA组和HC组NK细胞受体CD94的表达,所以IL-15可能通过增加CD94的表达从而调节NK细胞功能进而参与KOA的发生与发展。
实验结果显示加入IL-15(10 ng/ml)细胞培养后上清液中的TNF-α和IFN-γ的水平均显著增高,且KOA组加入或者未加入IL-15的结果均比HC组明显升高,说明KOA患者的PBMCs已经发生某些改变,促使KOA患者的PBMCs对IL-15的刺激敏感性更高,并且分泌细胞因子的能力提高,这可能与KOA的疾病状态有关系。已有研究表明TNF-α在OA的发病机制中起着重要作用,其通过刺激蛋白酶和PGE2的产生,并诱导滑膜细胞和软骨细胞产生其他细胞因子,导致关节组织加速损伤。TNF-α和IFN-γ也可以通过诱导IL-6的产生从而抑制Ⅱ型胶原的产生,并通过增加MMPs组酶的产生促进KOA的发生与发展。由此可以看出TNF-α和IFN-γ对OA的发生发展起着重要作用。而KOA患者本身外周血升高的IL-15可能是疾病发生的一个重要环节,可通过进一步促进TNF-α和IFN-γ炎性细胞因子水平的产生来加速KOA的发生与发展。

