单份非血缘脐血移植后血清生物标志物对移植后早期并发症的预测作用探究
江慧敏,宋闿迪,皖 湘,姚 雯,耿良权,孙光宇,范 倩,周紫微,朱小玉,汤宝林,孙自敏,刘会兰,
造血干细胞移植是治疗血液系统恶性疾病成熟有效的手段,非血缘脐带血移植(umbilical cord blood transplantation, UCBT)作为替代供体之一,为缺乏合适的骨髓或外周血供体的血液病患者带来了转机。UCBT后独特的早期免疫反应——植入前综合征(pre-engraftment syndrome, PES)及急性移植物抗宿主病(acute graft-versus-host disease,aGvHD)、感染等严重早期并发症是构成UCBT术后早期发病率和病死率的重要原因。
近年来,转录组学和蛋白质组学的应用使造血干细胞移植后血清生物标志物的发现和验证取得了重大进展。多个研究中心陆续发现可溶性肿瘤抑制素2(soluble suppressor of tumorigenicity 2,sST2)、再生胰岛衍生蛋白3α(regenerating islet-derived protein 3-alpha,REG3α)和细胞因子肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)对aGvHD具有可靠的诊断、预测或预后价值。但是,目前各中心的检测试剂、标本来源不同,能够最大化体现预测价值的监测时间窗也尚未得到统一。鉴于aGvHD 的中位发病时间大约在移植后1个月,该研究前瞻性检测本中心行单份脐血移植后1个月内固定时间点的患者血清sST2、REG3α、白细胞介素(interleukin,IL)-6、IL-8和TNFR1浓度,评估血清生物标志物水平与以aGvHD为主的移植后早期并发症之间的关系,为对其进行早期识别和预防提供参考。
1 材料与方法
1.1 患者和移植物特征
纳入2019年7—10月于安徽省立医院血液科接受单份UCBT的血液病患者共31例,脐血干细胞来自全国公共脐血库,供-受者间人类白细胞抗原(human leukocyte antigen, HLA)高分辨配型≥5/8(A、B、Cw、DR)个位点相合。本研究经安徽省立医院伦理审查委员会批准,所有患者均签署单份UCBT和血清标本采集书面知情同意书。1.2 预处理方案
31例患者均采用清髓性预处理方案。① 氟达拉滨(fludarabine,Flu)+ 白消安(busulfan,Bu)+ 环磷酰胺 (cyclophosphamide,Cy) 23例:Flu 30 mg/m×4 d+Bu 3.2 mg/kg×4 d(儿童Bu剂量按欧洲标准)+Cy 60 mg/kg×2 d。② 全身照射(total body irradiation,TBI)+Bu+Cy 8例用于再生障碍性贫血/睡眠性阵发性血红蛋白尿(aplastic anemia/paroxysmal nocturnal hemoglobinuria, AA/PNH)患者:Flu 40 mg/m×5 d+Cy 60 mg/kg×2 d+TBI 4 Gy。1.3 aGvHD的预防
使用环孢菌素A(cyclosporine A,CsA)联合霉酚酸酯(mycophenolate mofetil,MMF)用于aGvHD的预防。CsA:3 mg/(kg·d),24 h持续静脉输注,回输前1 d开始,血清CsA平均浓度维持在250~350 mg/L ,至胃肠道功能恢复后,按照静脉剂量的2倍改口服, 根据移植受者是否有aGvHD、血流感染、药物毒性以及血细胞恢复情况等调整免疫抑制剂剂量。无aGvHD发生及无CsA毒副作用的患者,维持谷浓度100 mg/L至40 d左右,以后递减,6~9个月左右停药。MMF:30 mg/(kg·d),分3次静脉滴注或口服,D1至D30,无aGvHD者逐渐减量至停用。1.4 临床指标的定义
以回输脐血日为D0,中性粒细胞植入是指移植后持续3 d外周血中性粒细胞绝对值(absolute neutrophil count, ANC)≥0.5×10/L;血小板植入是指移植后不依赖血小板输注连续7 d后,持续3 d外周血血小板绝对值≥20×10/L。原发植入失败是指存活时间超过28 d中性粒细胞仍未达到植入标准且伴供者嵌合度进行性下降;继发植入失败是指供者细胞植入后ANC再次持续降低<0.5×10/L并且供者细胞比例进行性减少从而最终丧失供者植入。aGvHD的诊断和分级依据国际标准。1.5 血清生物标志物的监测
于移植后第0、7、14、21、28天(D0、D7、D14、D21、D28) 采集患者外周血标本,室温自然凝固10~20 min,以2 000~3 000 r/min离心20 min左右,收集上清液于-20 ℃保存。检测时试剂盒及标本应室温平衡至少60 min。采用高度特异的ELISA定量检测血清sST2、REG3α、IL-6、IL-8和TNFR1浓度,检测由广州博富瑞医学检验实验室有限公司提供技术支持。
2 结果
2.1 患者基本特征和移植结果
如表1所示,31例接受脐血移植患者以儿童为主(中位年龄为12岁),中位体质量为37.9(27.7~53.8)kg,男性和女性分别有19例(61.29%)和12例(38.71%)。8例为AA/PNH,10例为急性髓系白血病,10例为急性淋巴细胞白血病,3例为骨髓增生异常综合征。供受者HLA等位基因以(5~7)/8相合最常见,回输的总有核细胞数和CD34细胞数的中位数分别为3.50(2.50~4.70)×10/kg和2.01(1.39~2.76)×10/kg。中性粒细胞和血小板植入的中位时间分别为18(14~22)d和32(29~39) d,观察期内未发生植入失败或复发。
表1 患者及移植物基本特征[M(IQR)]
2.2 脐血移植后并发症
31例患者中,24(77.42%)例发生PES,中位时间为9(8~13) d,累积发生率为81.85%(95%CI
,57.10%~92.30%)。11例出现aGvHD,5例为Ⅰ度,4例为Ⅲ度,2例为Ⅳ度;其中5例仅有皮肤侵犯,3例仅胃肠道侵犯,3例为皮肤、胃肠道均有侵犯,未观察到肝脏受累,中位发生时间为25(16~63) d,累积发生率为35.48%(95%CI
:16.24%~50.31%)。2例发生aGvHD的AA/PNH患者中,1例为皮肤Ⅰ度,1例为皮肤、胃肠道IV度。无肝窒阻塞综合征发生。移植后D28内被发现细菌、真菌、病毒等感染证据的患者共有19例,其中16例检测出巨细胞病毒核酸阳性,粒缺期发生血流感染7例,其中4例分离培养出缓症链球菌、1例大肠埃希菌、1例阴沟肠杆菌、1例多动物链球菌。2.3 移植后血清生物标志物水平变化
在31名患者中纵向评估了5种血清生物标志物水平的动态变化,观察到脐血移植后患者IL-6、IL-8水平随时间进展逐渐升高,sST2与TNFR1在D7稍有减低,随后逐渐升高,于D21达到高峰后再次减低(图1A)。在各个检测时间点上,PES-和PES+组的血清生物标志物水平差异无统计学意义。按是否发生aGvHD分组,aGvHD+患者的sST2和TNFR1水平在5个时间点上均高于aGvHD-患者(表2),仅D28 sST2水平表现出统计学差异(Z
=2.236,P
=0.036)(图1B),按是否发生皮肤aGvHD分组,皮肤aGvHD+患者较皮肤aGvHD-患者的D28 sST2升高(Z
=2.236,P
=0.036)(图1C)。进一步对sST2与TNFR1的相关性进行分析,二者在D0、D21和D28分别表现为低度相关(r
=0.458,P
=0.019)、中度相关(r
=0.633,P
=0.005)和高度相关(r
=0.821,P
=0.023),均呈现正相关。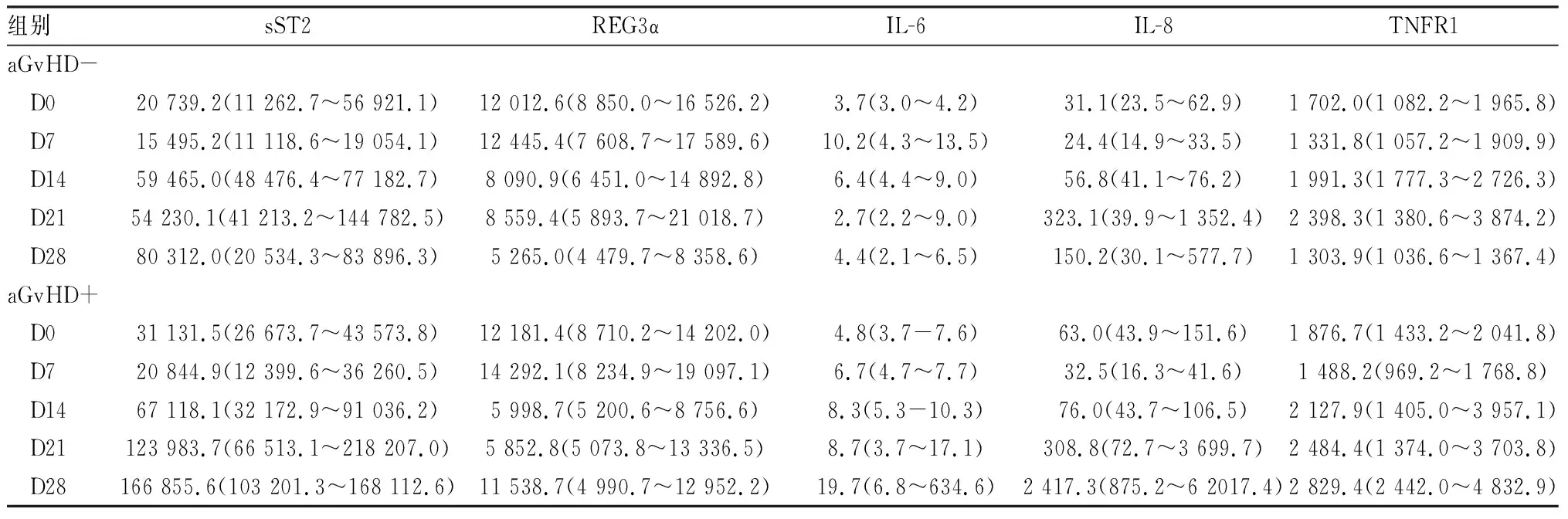
表2 aGvHD-和 aGvHD+组血清生物标志物动态变化(ng/L)
胃肠道受累的aGvHD患者数据较少,无法得出准确结果。为避免血流感染对结果造成影响,以D28内是否发生感染分组,各时间点上两组间血清生物标志物水平差异无统计学意义(图1D)。
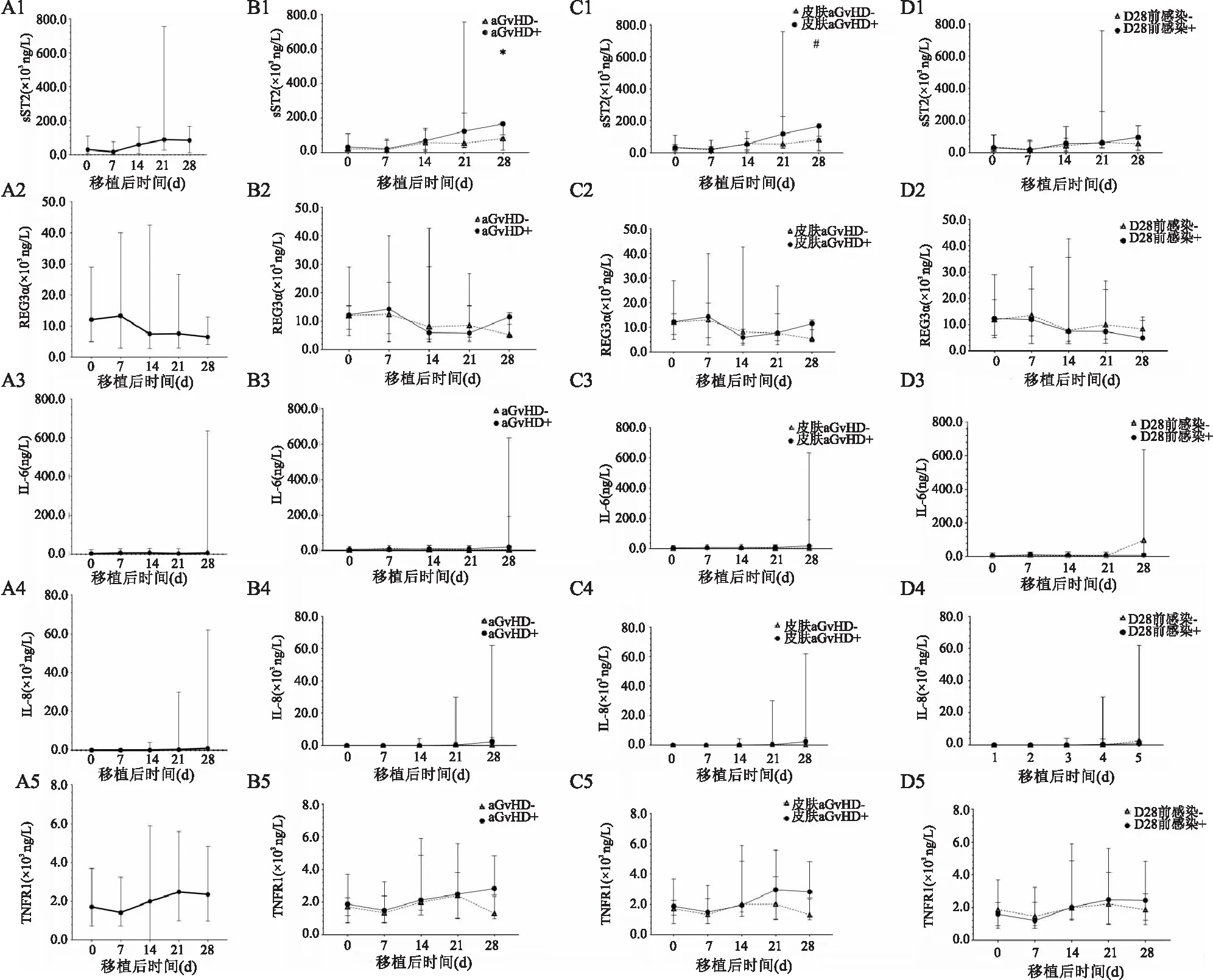
图1 血清生物标志物的动态变化及各列分组比较A:UCBT术后血清生物标志物水平动态变化;B:按有无aGvHD分组,aGvHD+ 和aGvHD-患者血清生物标志物水平;C:按有无皮肤aGvHD分组,皮肤aGvHD+和皮肤aGvHD-患者血清生物标志物水平;D:按D28前是否存在感染分组,D28前感染-和D28前感染+患者组血清生物标志物浓度;1:sST2;2:REG3α;3:IL-6;4:IL-8;5:TNFR1;与aGvHD-组比较:*P<0.05;与皮肤aGvHD-组比较:#P<0.05
3 讨论
本研究为一项前瞻性的单中心研究,结果显示,单份脐血移植后D28 sST2水平在发生aGvHD和皮肤aGvHD患者中均升高,sST2与TNFR1之间呈现高度正相关,未发现细菌和病毒血流感染对此5种血清标志物水平产生影响。
sST2是可溶性IL-33受体,IL-33与膜结合受体、IL-1受体附件蛋白结合形成异三聚体复合物,诱导2型炎症细胞因子和炎症反应的发生,与aGvHD的病理机制有关。sST2作为IL-33的诱饵受体结合并抑制其活性,起负调控作用。本研究表明单份脐带血移植后发生aGvHD的患者在D28 sST2水平增高。多个大样本的研究中均验证了sST2水平是aGvHD的独立预测因子,移植后第28天是最常见的标本采集时间点,与本研究观点一致。针对皮肤aGvHD中sST2升高的表现,尽管IL-33/ST2通路在皮肤炎性疾病中发挥了一定作用,但Paczesny et al在2010年的研究中从66个候选生物标志物蛋白中排除了sST2作为皮肤aGvHD的潜在预测因子的可能,sST2在皮肤aGvHD中的确切作用需要进一步探究。
本研究表明sST2与TNFR1水平在D21和D28均表现出了中高度的正相关性,D28 TNFR1在aGvHD患者血清中的升高并无统计学意义。关于TNFR1本身是否可以作为生物标志物仍存在争议,而包含有TNFR1的几个预测模型均得到了临床的有效验证,这可能因为单独的TNFR1并不适合作为aGvHD的预测因子。
REG3α是区分aGvHD性和非aGvHD性肠炎最有价值的预测因子之一,本研究中REG3α水平在系统性或胃肠道aGvHD中均未呈现出升高趋势,这可能与本研究中aGvHD患者数量较少有关。血清生物标志物浓度变化与细菌、病毒感染无关,但排除感染之后的宿主血清细胞因子和炎性产物水平将会使结果更具有说服力。
本研究结果表明移植后D28sST2水平增高提示aGvHD的发生,与几项大样本的观察结果基本一致,Hartwell et al和Vander Lugt et al的研究也发现了移植后D7和D28 sST2水平升高对aGvHD的预测价值。
单中心、小样本和未能在预处理前测定基线生物标志物浓度作为参考是该研究的不足之处,前瞻性、多中心、大样本的随机对照研究将有助于进一步了解血清生物标志物在预测、诊断和判断移植后早期并发症预后方面的具体机制。此外,排除细菌、真菌、病毒等感染引起的免疫反应可能会使结果更加准确。
该研究通过前瞻性动态监测脐血移植后血清生物标志物浓度,结果显示aGvHD患者的D28 sST2水平升高,与先前的多个中心的观察结果基本一致。进一步找到适用于临床的标本采集时间点、规范化检测方法、试剂来源和标本保存方式将会对临床预防和治疗移植后早期并发症起到指导性作用。

