不同浓度Fe2+与Zn2+对羊草幼苗生长和生理特性的影响
孟令博,赵 曼,亢 燕,祁 智
(内蒙古大学 生命科学学院/牧草与特色作物生物学教育部重点实验室,呼和浩特 010031)
铁(Fe)和锌(Zn)是植物生长和发育需求量最大的两种微量元素,常常是限制农作物产量,影响植物营养价值的主要因素。Fe主要参与植物体内叶绿素的合成、呼吸作用以及光合作用中电子传递的过程[1];Zn 是植物体内众多酶的组成成分,对蛋白质合成、细胞分裂、基因表达等过程具有重要作用[2]。环境中Fe2+或Zn2+缺乏或过量都会对植物的生长和品质造成不利的影响。M’sehli等[3]发现缺Fe会造成紫花苜蓿(MedicagosativaL.)叶片叶绿素含量、光合电子传递速率降低,MDA含量和SOD活性升高,POD、APX活性降低。JIN[4]研究表明较高浓度Fe2+会导致菠菜(SpinaciaoleraceaL.)叶片中可溶性糖和可溶性蛋白质浓度降低,影响菠菜的品质。Gökhan[5]发现缺Zn会造成豆类植物根部伸长率降低、根尖生长减缓、幼叶变黄甚至坏死。另外,据报道过量Zn会造成植物产量下降和生长迟缓,同时干扰Fe、P、Mg和Mn的吸收[6]。同时由于Zn2+和Fe2+在结构上具有相似性,会存在竞争金属离子蛋白结合位点的情况,导致植物体内矿质元素的失衡,对植物造成损伤。已有研究表明环境中过量Zn2+会抑制植物对Fe的吸收积累,而补充Fe又能够减轻锌过量造成的症状,并恢复植物中Fe元素的含量[7]。因此,植物中铁锌的相互作用对铁锌稳态有着重要影响,对铁锌同时研究有助于了解植物铁锌交叉稳态和耐受性。
羊草(Leymuschinensis)又名碱草,是禾本科赖草属植物,主要分布于欧亚草原,对欧亚草原生产力有重要影响,其生长情况是草原生态系统和牧草产量的基础[8]。羊草因其丰富的营养价值而被称为“牲畜细粮”,据刘公社等[9]报道,羊草的粗蛋白质含量能占到干物质的11%以上,在其分蘖期可以高达18.53%,而胡萝卜素含量能达到49.50~85.87 mg/kg。同时,羊草还具有很强的抗逆性,可以生存在含水量低至3.3%的土壤或pH 8.5~11.5的盐碱地环境中,又可以在温度低至-42 ℃的环境下安全越冬[10-11]。羊草是内蒙古天然草原上的主要建群种,草原土壤类型由东向西依次为黑钙土、栗钙土、棕钙土、灰钙土等[12],土壤整体呈碱性,而碱性环境中能直接被植物根部吸收利用的Fe2+、Zn2+含量很低[13-14],同时在草原矿区还存在局部高Fe高Zn的土壤,目前羊草适应草原土壤不同铁锌浓度环境的机制未知,而幼苗阶段是植株对环境较为敏感的时期,幼苗的生长状况直接关系到植物成苗的生长和产量。因此,本试验选择基于培养基的生长体系为研究手段,以幼苗期的羊草为研究对象,初步探究不同浓度Fe2+、Zn2+处理下羊草幼苗生长和矿质元素含量的变化,以及高浓度Fe2+对羊草幼苗抗氧化指标以及相关基因表达量的变化,为探究羊草铁、锌营养机理,提高羊草的铁、锌营养利用奠定基础。
1 材料和方法
1.1 试验材料及处理
参试的羊草种子于2018年9月采集自内蒙古自治区呼和浩特市和林格尔县。本试验的基础培养基为MS培养基改良后的全营养培养基[15],其中Fe2+浓度为0.05 mmol/L,Zn2+浓度为0.015 mmol/L。本研究根据实验目的设计以下两类实验。
首先,为了探究不同浓度Fe2+、Zn2+对羊草幼苗生长的影响共设置如下处理。(1)CK(对照),全营养培养基;(2)Fe0,其中Fe2+浓度为0,Zn2+浓度为0.015 mmol/L;(3)Fe10,其中Fe2+浓度为0.5 mmol/L(为基础培养基10倍,下同),Zn2+浓度为0.015 mmol/L;(4)Fe20,其中Fe2+浓度为1 mmol/L,Zn2+浓度为0.015 mmol/L;(5)Zn0,其中Zn2+浓度为0,Fe2+浓度为0.05 mmol/L;(6)Zn10,其中Zn2+浓度为0.15 mmol/L,Fe2+浓度为0.05 mmol/L;(7)Zn20,其中Zn2+浓度为0.3 mmol/L,Fe2+浓度为0.05 mmol/L。
其次,为了探究在高铁培养基中补加其他元素对羊草幼苗生长的影响,依据以上处理的表现,于基本培养基上补加微量元素Zn和大量元素Ca、Mg、K,设置如下处理。(8)Fe10+Zn10,其中Fe2+浓度为0.5 mmol/L,Zn2+浓度为0.15 mmol/L;(9)CK+ Ca/Mg/K,其中Fe2+浓度为0.05 mmol/L,Ca2+浓度为10 mmol/L,Mg2+浓度为5 mmol/L,K+浓度为20 mmol/L;(10)Fe20+ Ca/Mg/K,其中Fe2+浓度为1 mmol/L,Ca2+浓度为10 mmol/L,Mg2+浓度为5 mmol/L,K+浓度为20 mmol/L。
1.2 羊草幼苗的培养
用纯净水于4 ℃条件下浸泡羊草种子5 d,使用NaClO(西陇科学股份有限公司)与纯净水(1∶1)的溶液,添加0.5% Triton X-100,室温摇晃清洗30 min,超净工作台内使用无菌水洗至清澈,得到无菌羊草种子,以腹线朝上的方式播种到培养基上,22 ℃黑暗处理2 d,竖直光照培养,12 h光照/12 h黑暗,光照强度为220 μmol·m-2·s-1,培养6 d后进行生长指标和矿质元素含量测定。
1.3 测定指标及方法
1.3.1 生长状况在1.2条件下培养6 d后使用直尺和分析天平(Sartorius BSA124S-CW,德国)采集羊草幼苗根长、叶长、鲜重数据,每株幼苗为1次重复,共40次重复。
1.3.2 矿质元素含量收集生长6 d的羊草幼苗,105 ℃杀青30 min,80 ℃烘干至恒重并记录,使用高通量组织研磨器(宁波新芝生物 SCIENTZ-192)研磨后,加入5% HNO3,37 ℃振荡48 h,4 ℃、12 000 r/min离心提取上清液,使用电感耦合等离子体发射光谱仪(ICP-OES,Ananlytikjena-PQ9000,德国)测定Ca、Fe、Zn、Mg、K含量,每种处理5次重复。
1.3.3 抗氧化酶活性和抗氧化物质含量羊草无菌幼苗在CK培养基生长至根长2~3 cm时,分别转移至Fe20和CK培养基处理48 h,收集紧贴培养基生长的根段,转移至充分预冷的研钵中并加入提取液,在冰上充分研磨后,4 ℃高速离心,收集待测液,使用试剂盒(购买自苏州科铭生物技术有限公司)以分光光度法测定根部过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、抗坏血酸过氧化物酶(APX)活性以及丙二醛(MDA)、还原型谷胱甘肽(GSH)、抗坏血酸(AsA)含量,每种指标3次重复。
1.3.4 基因差异表达的分析采用与1.3.3相同处理方法获取根部材料,经液氮充分研磨,TRIzol提取液充分混匀,离心提取上清后加入氯仿,再次离心提取上清后加入等体积异丙醇-20 ℃保存[16]。将RNA提取液干冰打包寄送北京贝瑞和康生物技术有限公司进行转录组学测序,每种处理3次重复。通过MQA-Fe20和MQA-CK测序结果中基因表达量均值的比值(平均变化倍数)来区分上调(比值>1)基因和下调(比值<1)基因,根据T检验结果保留差异显著(P<0.05)的基因,再按照平均变化倍数排序,列出上调、下调前20基因进行分析。
1.4 数据处理
实验数据使用Excel 2010进行统计分析,通过StudentT-test进行差异显著性检测。
2 结果与分析
2.1 不同Fe、Zn浓度条件对羊草幼苗生长的影响
羊草幼苗的根长在缺铁(Fe0)和高浓度铁(Fe10、Fe20)处理下分别比对照(CK)极显著降低17.3%、14.8%、60.8%(P<0.01),而在缺锌(Zn0)和高浓度锌(Zn10、Zn20)处理下均无显著变化(图1,A、D);幼苗叶长在缺铁和缺锌处理下均无显著变化,在高浓度铁处理下分别比对照极显著降低18.5%和33.4%,在缺锌处理下分别极显著升高9.6%、13.9%(图1,B、D);幼苗鲜重也在缺铁和高浓度铁处理下均比对照极显著降低,降幅分别为13.5%、49.4%和58.3%,而在缺锌处理下比对照显著降低10.4%(P<0.05),但在增加锌处理下无显著变化(图1,C)。同时,由图1,E可以看出,缺铁对幼苗的根毛发育无明显影响,而高浓度铁处理(Fe10、Fe20)显著抑制羊草幼苗的根毛发育,同样随浓度的升高抑制作用增强;缺锌和高浓度锌对羊草幼苗根毛发育均无明显影响。可见,羊草幼苗生长发育在缺铁和高浓度铁条件下均受到显著抑制作用,且抑制作用随浓度的升高而增强,而在缺锌和高浓度锌条件下没有受到显著影响。

处理间差异显著性检测采用Student T-test分析,*、**、***分别表示处理与对照间在0.05、0.01和0.001水平存在显著性差异。下图同图1 不同浓度Fe2+、Zn2+培养基中羊草幼苗生长指标和根毛形态The significance analysis between control and treatments conducted by Student T-test, while *, ** and *** indicate significant difference between control and treatment at 0.05, 0.01 and 0.001 levels, respectively. The same as belowFig.1 The growth phenotypes and root hair morphology of L. chinensis seedlings in medium with different concentrations of Fe2+ and Zn2+
2.2 不同Fe、Zn浓度条件对羊草幼苗矿质元素含量的影响
羊草幼苗Ca含量在缺铁、缺锌及高浓度锌(Zn20)处理下均与对照无显著差异,在高浓度铁(Fe10、Fe20)处理下分别显著降低40.9%和52.0%,在高浓度锌(Zn10)处理下显著增加17.0%,说明高浓度Fe2+显著抑制羊草幼苗Ca含量积累,且抑制作用随浓度的升高而增强,高浓度Zn有显著促进Ca含量积累的趋势(图2,A)。同时,羊草幼苗Fe含量在缺锌、高浓度铁(Fe10、Fe20)处理培养下得到显著促进,分别比对照显著增加15.2%、188.3%、395.2%,在缺铁处理培养下显著降低23.2%,Fe元素积累受到显著抑制,即随着培养基中Fe2+浓度的升高,羊草幼苗体内的Fe元素含量逐渐升高(图2,B)。羊草幼苗Zn含量在缺铁、高浓度锌(Zn10、Zn20)培养下分别比对照显著增加156.4%、538.7%、915.1%,促进了Zn积累,而在缺锌、高浓度铁(Fe10、Fe20)培养下受到显著抑制,分别比对照显著降低34.5%、29%、34.5%(图2,C)。羊草幼苗Mg含量在缺Fe和高浓度锌(Zn10)培养下分别比对照显著增加10.2%、15.4%,积累量得到显著促进,在高浓度铁(Fe10、Fe20)培养下分别比对照显著降低17%、37%, Mg元素积累受到显著抑制(图2,D)。另外,羊草幼苗K含量仅在高浓度铁(Fe10、Fe20)培养下受到显著抑制,分别比对照显著降低43.9%和65.6%,其余处理均无显著变化(图2,E)。以上结果说明含高浓度Fe2+培养基显著抑制羊草幼苗对Ca、Zn、Mg、K元素的吸收积累,显著促进Fe的吸收积累,且羊草对Fe和Zn的吸收有明显的拮抗作用。
2.3 高浓度Fe2+条件下补加其他离子对羊草幼苗生长的影响
以上实验结果显示,高浓度铁(Fe10、Fe20)培养基显著抑制羊草幼苗的根叶生长、根毛发育以及Ca、Zn、Mg、K元素积累,现进一步探究是否可以通过补加Ca、Zn、Mg、K抑制元素来恢复高浓度铁对羊草生长的抑制。
首先,在Fe10培养基中补加0.15 mmol/L Zn2+(Fe10+Zn10)后,羊草幼苗的根长、叶长和鲜重分别比对照显著降低19.6%、17.9%、26.1%,根毛发育也不及对照和Zn10培养基,但均与Fe10培养无显著差异,即在Fe10培养基中补加0.15 mmol/L Zn2+无法恢复高浓度Fe对幼苗生长的抑制作用(图3)。
其次,在Fe20培养基中补加10 mmol/L Ca2+、5 mmol/L Mg2+、20 mmol/L K+(Fe20+ Ca/Mg/K)后,羊草幼苗根长、叶长、鲜重分别比对照显著降低60.5%、43.1%、50%,根毛发育也明显不及对照,所有指标也不同程度地低于Fe20培养基;在对照培养基中添加同样浓度的Ca、Mg、K元素,羊草幼苗生长和根毛发育也显著比对照差,但明显优于Fe20培养基(图4)。可见,培养基中添加额外的Ca、Mg、K元素不仅明显抑制了羊草幼苗生长,也无法恢复高浓度铁(Fe20)对羊草幼苗生长的抑制作用。

图2 不同浓度Fe2+、Zn2+培养基中羊草幼苗矿质元素含量Fig.2 The element contents of L. chinensis seedlings in medium with different concentrations of Fe2+ and Zn2+
2.4 高浓度Fe2+对羊草幼苗根部氧化还原相关酶活性和化合物含量的影响
以上实验结果表明高浓度Fe2+(Fe20)对羊草幼苗生长发育以及矿质元素含量均有显著的抑制作用,而植物在逆境胁迫下会产生过量的活性氧(ROS)物质,导致细胞质膜的过氧化,严重时甚至会导致植株的死亡。因此本实验针对高浓度Fe2+(Fe20)处理下羊草幼苗根部抗氧化系统的响应情况进行探究。表1显示:高浓度Fe2+处理羊草幼苗48 h后,其根部过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、抗坏血酸过氧化物酶(APX)活性显著上升,增幅分别为13.5%、27%、44.4%、32.9%、34.2%,而其根部丙二醛(MDA)、还原型谷胱甘肽(GSH)、抗坏血酸(AsA)含量也显著上升,增幅分别达到62.7%、46%、114.8%。这说明环境中高浓度Fe2+胁迫虽然能诱导羊草幼苗根部抗氧化系统活性和抗氧化物质含量显著增加,但并不能消除高铁胁迫的影响,仍致使根部遭受到严重的过氧化伤害。
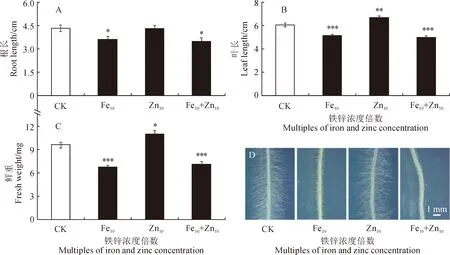
图3 Fe10+Zn10培养基中羊草幼苗生长指标和典型苗根毛形态Fig.3 The growth and typical root hair morphology of L. chinensis seedlings cultured in Fe10 +Zn10

图4 Fe20+Ca/Mg/K培养基中羊草幼苗生长指标和典型苗根毛形态Fig.4 The growth and typical root hair morphology of L. chinensis seedlings cultured in Fe20 +Ca/Mg/K
2.5 高浓度Fe2+对羊草幼苗根部相关基因表达量的影响
为进一步探究高浓度Fe2+(Fe20)处理下羊草幼苗根部相关基因的响应情况,对转录组测序差异表达分析数据进行整理,根据基因表达量变化倍数列出表达量显著上调和下调排名前20的基因(表2和表3)。其中,表达量显著上调基因中有2条植物类萌发素蛋白基因,均上调30倍以上;表达量显著下调基因中主要为烟酰胺合成酶基因和过氧化物酶基因,均至少下调10倍以上。

表1 高浓度Fe2+(Fe20)处理羊草幼苗48 h后根部氧化还原相关酶活性和化合物含量的变化

表2 高浓度Fe2+(Fe20)处理羊草幼苗48 h根部表达量上调前20的基因

表3 高浓度Fe2+(Fe20)处理羊草幼苗48 h表达量下调前20的基因
3 讨 论
3.1 羊草幼苗生长和矿质元素含量对不同浓度Fe2+、Zn2+的响应
本研究发现高浓度Fe2+显著抑制羊草幼苗根叶生长发育以及Ca、Zn、Mg、K元素积累,这与赵燕等[17]报道的过量Fe2+会导致植株中Ca、P、K、Zn、Mg、Mn等营养元素的严重缺乏,植株生长发育、株高、根系长度、干物质量等受到抑制的现象相同。表明高浓度Fe2+胁迫是多种矿质元素失衡的过程,造成植物其他必需营养元素的不足,进一步加剧了胁迫对植物的毒害,使得生长发育过程无法正常进行,这是Fe2+过量导致羊草幼苗根叶生长、根毛发育严重受阻的重要原因。
本试验中Zn10、Zn20处理均表现出促进羊草幼苗叶片生长的趋势。而邹文桐[18]、俞明惠等[19]的研究都发现随着环境中Zn2+浓度的升高,植物生长都表现出先促进再抑制的趋势,这与本试验结果不一致,这可能是因为羊草幼苗阶段对较高浓度的Zn2+有一定的耐受性,所以并未表现出抑制作用。段晓晖的研究表明低浓度Zn缓解了Fe处理对植物幼苗根的毒害作用,而高浓度Zn会与Fe协同作用,使毒害作用加强[20]。这与本试验中补加高浓度的Zn2+无法恢复高浓度Fe2+对羊草幼苗抑制作用结果相同,同样这可能也是补加Ca、Mg、K无法恢复抑制作用的原因。
本研究发现在缺Fe2+(Fe0)培养下羊草幼苗体内Zn元素含量显著升高,在缺Zn2+(Zn0)培养下幼苗体内Fe元素含量显著升高,这是由于Fe2+和Zn2+有着相似的离子半径,二者在转运载体上有着相同的转运位点,从而在转运中形成竞争[21]。在转运中有竞争关系的两种离子其中一种缺乏后,从而促进羊草幼苗转运吸收另一种。
3.2 羊草幼苗根部抗氧化防御系统对高浓度Fe2+的响应
植物作为好氧生物,体内有众多氧气参与的反应,活性氧(reactive oxygen species,ROS)的产生是不可避免的。正常情况下,植物体内的ROS处于动态平衡的状态,当ROS的产生与清除失衡时,就会对植物产生氧化胁迫,造成损伤,严重时还会引起细胞甚至植物的死亡[22]。根是植物从环境中吸收养分的重要器官,当环境发生改变不适宜植物生长,根的生理响应往往最直观和迅速。本试验中羊草幼苗根部经高浓度Fe2+处理48 h后,根部 POD、SOD、CAT活性和MDA含量显著升高,另外抗坏血酸-谷胱甘肽循环中AsA、GSH含量和GR、APX活性也显著升高。当环境中存在高浓度Fe2+时,植物吸收入体内的过量Fe可以通过Fenton反应等生命活动产生大量的ROS[23],ROS含量的升高,导致羊草幼苗根部细胞质膜过氧化程度加深,MDA含量升高,同时诱导羊草体内抗氧化防御系统做出响应,POD、SOD、CAT活性显著升高,提高ROS的清除能力,减少自身损伤;植物体内另一条ROS清除途径抗坏血酸-谷胱甘肽循环同样做出响应,GR、APX活性和GSH、AsA含量升高,其中AsA含量的升高表明羊草幼苗整体抗氧化能力并未衰退[24]。基于以上结果证实高浓度Fe2+对羊草幼苗造成氧化胁迫,产生大量的ROS物质,为应对胁迫羊草体内酶促反应防御系统中关键酶活性升高,非酶类防御系统中抗氧化化合物含量升高,大大提升了羊草体内ROS的清除能力,实现过量Fe2+环境下的防御响应。
3.3 羊草幼苗根部胁迫相关基因表达对高浓度Fe2+的响应
植物在遭受逆境胁迫下,会通过调节体内胁迫相关基因的表达量来控制相关蛋白的合成,从而使机体能更快地适应胁迫环境。王静等[25]研究表明植株在受到胁迫后,POD表达量在6 h达到最大,并在24 h后表达量低于对照组,而本研究中高浓度Fe2+处理羊草幼苗48 h后,可能由于处理时间较长,POD表达量显著下调。Douchkov等[26]发现烟酰胺对植物体内金属离子的吸收和稳态的维持起着重要的作用,在烟草(NicotianatabacumL.)中过表达拟南芥(Arabidopsisthaliana)的烟酰胺合成酶(NAS)基因,可以提高叶片中Fe元素含量。本试验发现在高浓度Fe2+处理下,羊草受到了过量Fe的毒害,为维持体内Fe稳态,下调了NAS表达量,减少烟酰胺的合成,从而降低植株对环境中Fe的吸收,保护羊草幼苗适应胁迫条件。另外,类萌发素蛋白(GLPs)是广泛存在于各种陆生植物中的植物糖蛋白,许多定位于细胞壁,是植物在胁迫响应下细胞壁强化的辅助因子[27]。当植物受到逆境胁迫时,GLPs能够通过发挥其结构蛋白的功能,来帮助植物度过不利的环境条件,降低胁迫对植物的伤害[28]。本试验中羊草幼苗在高浓度Fe2+处理后,根部通过上调GLPs的表达量,提高自身在高浓度Fe2+下的适应性,降低受损伤的程度。
4 结 论
本试验初步研究了不同铁锌浓度对羊草幼苗生长和矿质元素含量的影响,发现缺Zn2+(Zn0)和高浓度Zn2+(Zn20)处理下对生长无明显影响;缺Fe2+(Fe0)和高浓度Fe2+(Fe20)对生长均有抑制作用,尤其是高浓度Fe2+培养下对羊草幼苗根叶生长、根毛发育以及Ca、Zn、Mg、K元素含量有显著的抑制,表明羊草幼苗对Zn2+浓度变化不敏感,而对Fe2+浓度变化敏感。进一步研究发现高浓度Fe2+(Fe20)会导致羊草幼苗根中POD、SOD、CAT、APX、GR活性和MDA、AsA、GSH含量显著升高;NAS、POD表达量显著下调,GLPs表达量显著上调。从而证实高浓度Fe2+会对羊草幼苗造成严重的氧化胁迫。本研究结果填补了羊草铁锌胁迫方面研究的空白,可为了解羊草及相关植物对铁锌的适应特性提供依据,为提高羊草的铁锌营养利用提供重要参考。

