模拟干旱胁迫处理下北柴胡种苗MYC2基因的调控研究
王 晨,胡珊群,李 彤,刘长利*
(1 首都医科大学 中医药学院, 北京 100069; 2 中医络病研究北京重点实验室, 北京 100069)
柴胡是中国常用大宗中药材,药用历史悠久,始载于《神农本草经》,列为上品,具有疏散退热、疏肝解郁、升举阳气等功效,是中医临床治疗少阳证的首选药物。国家药典收录来源于伞形科柴胡属多年生草本植物柴胡(BupleurumchinenseDC.)或狭叶柴胡(BupleurumscorzonerifoliumWild.),其中柴胡是中药柴胡的主要基原,习称为“北柴胡”。柴胡皂苷(saikosaponin, SS)是从中药柴胡中提取的三萜皂苷类化合物,其中柴胡皂苷a、d是国家药典规定检测柴胡质量的指标性成分和国内外研究热点的生物活性成分[1]。
茉莉酸(jasmonate acid, JA)及其衍生物茉莉酸甲酯(methyl jasmonate, MeJA)是植物在生物或非生物胁迫下抵御逆境条件的一个重要信号分子,它能够激活许多相关转录因子,调节植物防御反应。髓细胞组织增生蛋白(myelocytomatosis proteins, MYCs)转录因子在植物JA信号途径中处于重要位置,同时参与了多种信号途径之间的相互作用,其功能与植物激素应答、植物抗逆响应等密切相关[2]。MYC2是植物JA信号通路中核心转录因子,当感应到来自外界的某些微生物、食草动物和机械损害、温度变化、干旱胁迫、盐胁迫等信号时,JA可在植物体内通过酶的作用甲基化生成MeJA,MeJA作为信号分子可进入植物细胞内,在细胞质中经酯酶水解成JA,进而在Jar l (Jasmonic acid resistant 1, Jar l)酶的作用下与异亮氨酸(isoleucine, Ile)结合生成JA-Ile (JA-isoleucine, JA-Ile)。JA-Ile可与Skpl/Cullin l/F-box protein COI l(SCFCOI1)受体以及抑制蛋白(Jasmonate ZIM-domain, JAZ)结合[3]。JAZ蛋白是MYC2的抑制剂,当两者结合在一起的时候,MYC2的转录激活作用被抑制[4]。JA-Ile和SCFCOI1、JAZ蛋白结合以后,JAZ蛋白被泛素化和降解,MYC2被释放出来,进而与下游关键基因的启动子结合,调节关键酶基因的表达,从而影响植物的生长发育、对生物与非生物胁迫的反应及次生代谢产物的合成等[5]。本课题组前期已成功克隆一条北柴胡MYC2基因(BcMYC2, GenBank accession number MT349674),并初步明确其可响应JA信号,参与调控柴胡皂苷的生物合成[6]。
植物在生物或非生物胁迫下,茉莉酸信号通路被激活,内源茉莉酸类物质等信号分子含量增高,释放出相应的转录因子,激活植物次生代谢中关键酶基因的表达,促进植物次生代谢产物的合成并积累。干旱胁迫可影响植物生理功能,也是研究最多的逆境因子之一。目前在玉米[6]、梭梭[7]等植物中已验证转录因子可调控植物在干旱胁迫下的生理功能。因此,本研究选用聚乙二醇PEG6000作为模拟干旱胁迫渗透剂对北柴胡根部进行胁迫处理,在10%、20%浓度PEG6000胁迫处理不同时间后取样,用于检测信号物质OPR、JA含量,BcMYC2及各关键酶基因相对表达量,并且在胁迫0、1、3、6、12、24、36 d后取样,干燥后用于柴胡皂苷a、d含量分析,旨在探究模拟干旱胁迫下北柴胡种苗内茉莉酸信号通路调控BcMYC2,进而影响柴胡皂苷生物合成的机制。
1 材料和方法
1.1 试验材料和试剂
试验材料一年生北柴胡于2020年10月采挖自北京市延庆区艾药园。经首都医科大学教授鉴定为北柴胡。Eastep Super总RNA提取试剂盒购自普洛麦格(上海)生物技术有限公司,KAPA SYBR®FAST Universal购自KAPA公司,FastKing RT Kit (With gDNase)试剂盒购自天根生化科技(北京)有限公司,Hoagland’s(霍格兰氏)营养液购自雷根生物技术有限公司(北京),聚乙二醇(PEG)6000购自兰博利德生物技术有限公司(北京),植物12-氧-植物二烯酸还原酶(OPR)酶联免疫分析试剂盒购自酶免实业有限公司(江苏),植物茉莉酸酶联免疫分析试剂盒购自酶联生物科技有限公司(上海),磷酸缓冲盐溶液(PBS)购自Biological Industries公司,柴胡皂苷a、d标品购自中国食品药品检定研究院,甲醇、甲酸、氨水购自北京化工厂,乙腈购自Thermo Fisher Scientific公司。
1.2 模拟干旱胁迫处理
(1)种苗选择:将从北京市延庆区艾药园挖取的一年生北柴胡种苗清洗干净,擦干称重,从中挑选生长态势均一,质量在2.0~4.0 g的植株备用,将挑选后的植株置于1/4 Hoagland’s营养液中培养3 d,适应环境。
(2)Hoagland’s营养液配制:取适量的Hoagland’s 大量元素溶液、铁盐母液(400x)、微量元素母液(400x),按398∶1∶1的比例充分混合,即为Hoagland’s营养液原液,将原液与蒸馏水按1∶3的比例充分混匀稀释得1/4 Hoagland’s营养液。
(3)胁迫处理液配制:将称重后的PEG6000溶解于1/4 Hoagland’s营养液中,配置成质量分数为10%、20%的PEG6000溶液,即为模拟干旱胁迫处理液。
(4)胁迫处理及取样:将北柴胡种苗分别置于对照组(1/4 Hoagland’s营养液)及含10%、20% PEG的1/4 Hoagland’s营养液的150 mL锥形瓶中诱导,以北柴胡根部接触营养液。分别于胁迫处理0、2、4、6、8、10、12 h取北柴胡根部组织,每份样品取自3株不同植株,放入离心管中,液氮冷冻后放入-80 ℃冰箱备用。
1.3 北柴胡根中OPR和内源茉莉酸含量测定
1.3.1 北柴胡根中OPR含量使用植物12-氧-植物二烯酸还原酶(OPR)酶联免疫分析试剂盒(Elisa试剂盒)检测北柴胡根中内源OPR含量。将北柴胡的根解冻后精密称重装入2 mL离心管中,使用球磨机研磨至粉末。向离心管中加入1.5 mL提取液(提取液体积比为甲醇∶水∶甲酸=15∶4∶1),超声提取30 min。将样品架于80 ℃水浴锅中挥干提取液,挥干后每份样品加入100 μL PBS,离心取上清液即得待测样品。按试剂盒操作步骤使用酶标仪检测毛状根中内源OPR含量。
结果计算:以标准物的浓度为横坐标,OD值为纵坐标,在ElisaCalc软件中绘制标准曲线并确定直线回归方程式。根据样品的OD值由标准曲线计算出相应的浓度,再乘以稀释倍数,即为样品的实际浓度。样品线性回归与预期浓度相关系数应在0.95以上。
1.3.2 北柴胡根中内源茉莉酸含量以1.3.1中所得上清液为待测样品,使用植物茉莉酸酶联免疫分析试剂盒检测北柴胡种苗根中内源茉莉酸含量。按试剂盒操作步骤使用酶标仪检测毛状根中内源茉莉酸含量。
结果计算:在Excel工作表中,以标准品浓度作为横坐标,对应OD值为纵坐标,绘制出标准曲线线形回归方程,按曲线方程计算各样本浓度值。标准品线形回归与预期浓度相关系数应大于等于0.990 0。
1.4 北柴胡根中BcMYC2及柴胡皂苷生物合成途径关键酶基因的相对表达量分析
使用Eastep Super总RNA提取试剂盒提取毛状根RNA。使用FastKing RT Kit (With gDNase)反转录试剂盒将其反转为cDNA。使用Quant Studio 5仪器进行实时荧光定量PCR反应。根据基因序列利用Primer 5.0软件设计引物;根据BcMYC2、Actin(GenBank accession number FJ389747)[8]、HMGR(GenBank accession number EU400217)[9]、IPPI(GenBank accession number EU400218)[10]、FPS(GenBank accession number EU400219)[8]、β-AS(GenBank accession number EU400200)[11]核苷酸序列设计引物,引物均由北京睿博兴科生物技术有限公司合成。使用表1内引物序列采用RT-PCR法检测BcMYC2及HMGR、IPPI、FPS、β-AS基因的相对表达量。
以Actin基因为内参,将cDNA用无菌水稀释10倍为模板进行实时荧光定量PCR (quantitative real time PCR, qRT-PCR)反应。qRT-PCR体系包括:10.0 μL 2×Fast qPCR Master Mix, 0.4 μL Gene-qF, 0.4 μL Gene-qR, 1.0 μL cDNA, 0.4 μL 50×Rox Low, 7.8 μL ddH2O, 总体积为20.0 μL;qRT-PCR程序为:保温阶段:Step 1:95.0 ℃ 3 min,聚合酶链式反应阶段Step 1:95.0 ℃,3 s; Step 2:60.0 ℃,30 s,熔解曲线测定阶段Step 1:95.0 ℃,1 s,Step 2:60.0 ℃,20 s, Step 3:95.0 ℃,1 s。基因表达量运用“ΔΔCT”法[12]进行分析。
1.5 北柴胡根中柴胡皂苷含量测定
1.5.1 胁迫处理、取样及制备采用1.2中方法用广口瓶进行模拟干旱胁迫处理,分别于胁迫处理0、1、3、6、12、24、36 d取北柴胡根部组织材料(每份材料取自3株不同植物),将根部营养液擦干后放入-80 ℃冰箱备用。每隔6 d更换广口瓶中营养液,但发现处理12 d后,置于1/4 Hoagland’s营养液中的北柴胡根出现局部逐渐腐烂现象,取样时将腐败部分去除后放入冰箱备用。将全部样品从-80 ℃冰箱取出,标记后装入信封中,放入烘箱烘干。烘干后的样品使用枝剪剪成段,放入混合型碾磨仪中粉碎1 min后备用。
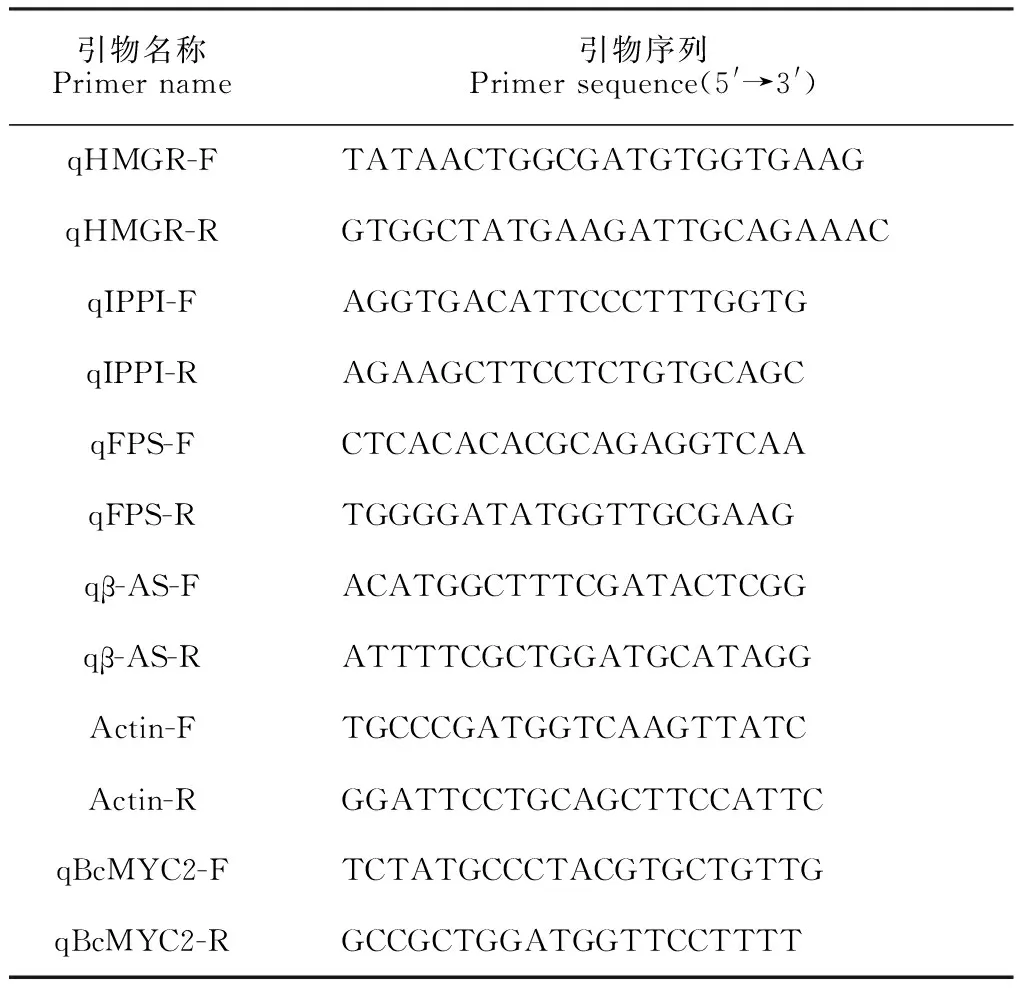
表1 本试验所用引物
1.5.2 柴胡皂苷含量测定精密称取粉碎后的样品,每份0.2 g左右,提取、检测北柴胡根中柴胡皂苷a、d含量,HPLC检测条件中对照品溶液取15 μL进样。
(1)对照品及供试品溶液制备:分别精密称取柴胡皂苷a、d对照品5.71、5.66 mg,分别于5 mL容量瓶中用分析纯甲醇制成浓度为1.040 mg·mL-1、1.084 mg·mL-1的溶液,摇匀,作为柴胡皂苷对照品溶液。精密称取全部干燥后的北柴胡根样品粉末于具塞锥形瓶中,加入含5%浓氨试液的甲醇溶液10 mL,密塞,超声处理30 min,抽滤后旋蒸回收溶剂,残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得供试品溶液[1]。
(2)标准曲线的建立:从柴胡皂苷a溶液中精密吸取500、200、50、25、10 μL对照品溶液,从柴胡皂苷d溶液中精密吸取200、100、12.5、10、5 μL对照品溶液分别置于5 mL容量瓶中,并用分析纯甲醇定容至刻度,摇匀,滤过,取续滤液,得到对照品溶液,取15 μL按HPLC色谱条件进样,以峰面积为纵坐标(Y),溶液中物质的量为横坐标(X),绘制标准曲线。柴胡皂苷a标准曲线为Y=0.003 1X-0.086 5;柴胡皂苷d标准曲线为Y=0.002 5X+0.051,r=0.999 9。
(3)HPLC色谱条件:Agilent1200高效液相色谱仪,色谱柱为Agilent Eclipse Plus C18(4.6 mm×250 mm, 5 μm);检测波长为210 nm;流动相为纯水(A)乙腈(B);流速为1.0 mL·min-1;柱温为30 ℃;进样量为20 μL;洗脱方式为梯度洗脱,具体梯度洗脱方式为:0~5 min, A%为75%~65%, B%为25%~35%;5~20 min, A%为65%~60%, B%为35%~40%;20~30 min, A%为60%~40%, B%为40%~60%;30~35min, A%为40%~0%, B%为60%~100%;35~40 min, A%为0%, B%为100%
1.6 数据分析
使用SPSS Statistics 17软件中的单因素ANOVA分析方法,输入数据经软件计算得P值,判断数据组间是否有显著性差异。
2 结果与分析
2.1 模拟干旱胁迫对北柴胡根中OPR含量的影响
采用ELISA试剂盒法测定北柴胡根中OPR含量,构建的OPR含量标准曲线为Y=0.029 89+261.145 07X(R2=0.982 11),符合试剂盒中说明书要求;OPR含量在PEG6000处理不同时间的表达情况如图1所示。其中,对照组北柴胡根中OPR含量在检测期间比较稳定,基本在1.37~1.38 ng·g-1范围内小幅波动。经10%、20% PEG6000处理0~2 h后,北柴胡根内OPR含量呈逐渐升高趋势并高于对照组,20% PEG6000处理组在2 h处出现峰值(1.944 ng·g-1),10% PEG6000处理组在2 h处OPR含量为1.471 ng·g-1,但不是该处理组的峰值。在2~4 h处理区间,两处理组北柴胡根中OPR含量均明显下降,大幅低于对照组。20% PEG6000处理组内源OPR含量在4 h后逐渐上升,之后趋于稳定;而10% PEG6000处理组OPR含量在4 h后快速上升,于6 h时处达到峰值(1.548 ng·g-1),而在6~10 h之间再次大幅下降,之后又上升并接近对照组水平。20% PEG6000处理组内源OPR含量出现峰值的时间早于10% PEG6000处理组,且峰值高于10% PEG6000处理组。
2.2 干旱胁迫对北柴胡根中内源茉莉酸含量的影响
采用ELISA试剂盒法测定北柴胡根中内源茉莉酸含量,构建的标准曲线为Y=0.042 5+10.473 23X-17.648 92X2(R2=0.997 88),符合试剂盒中说明书要求。检测得到的内源茉莉酸含量在PEG6000处理下不同时间的表达情况如图2所示。其中,对照组柴胡根内源茉莉酸含量在胁迫处理0~8 h之间逐渐下降,在8~12 h之间又逐渐上升。经模拟干旱胁迫处理后,北柴胡根中内源茉莉酸含量在0~2 h间呈逐渐升高趋势,10%、20% PEG6000处理组均在2 h处出现峰值,分别达到135.220和141.857 ng·g-1。20% PEG6000处理组根中内源茉莉酸含量在干旱胁迫2~4 h期间大幅下降,在4~6 h间快速上升,于6 h时达到第二个峰值(102.642 ng·g-1),之后再下降(6~8 h),然后缓慢上升(8~12 h)。10% PEG6000处理组内源茉莉酸含量在处理2 h达峰值后逐渐下降,于10 h降至最低值,之后在10~12 h间又有所上升。
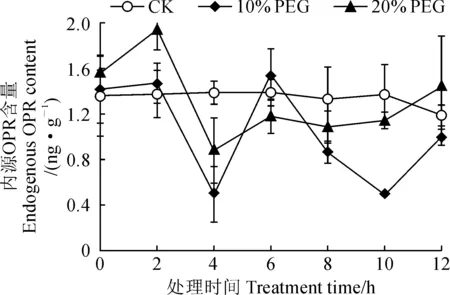
图1 模拟干旱胁迫处理下不同时间北柴胡根中OPR的含量变化Fig.1 Changes of OPR content in the roots of Bupleurum chinense at different time points under drought stress
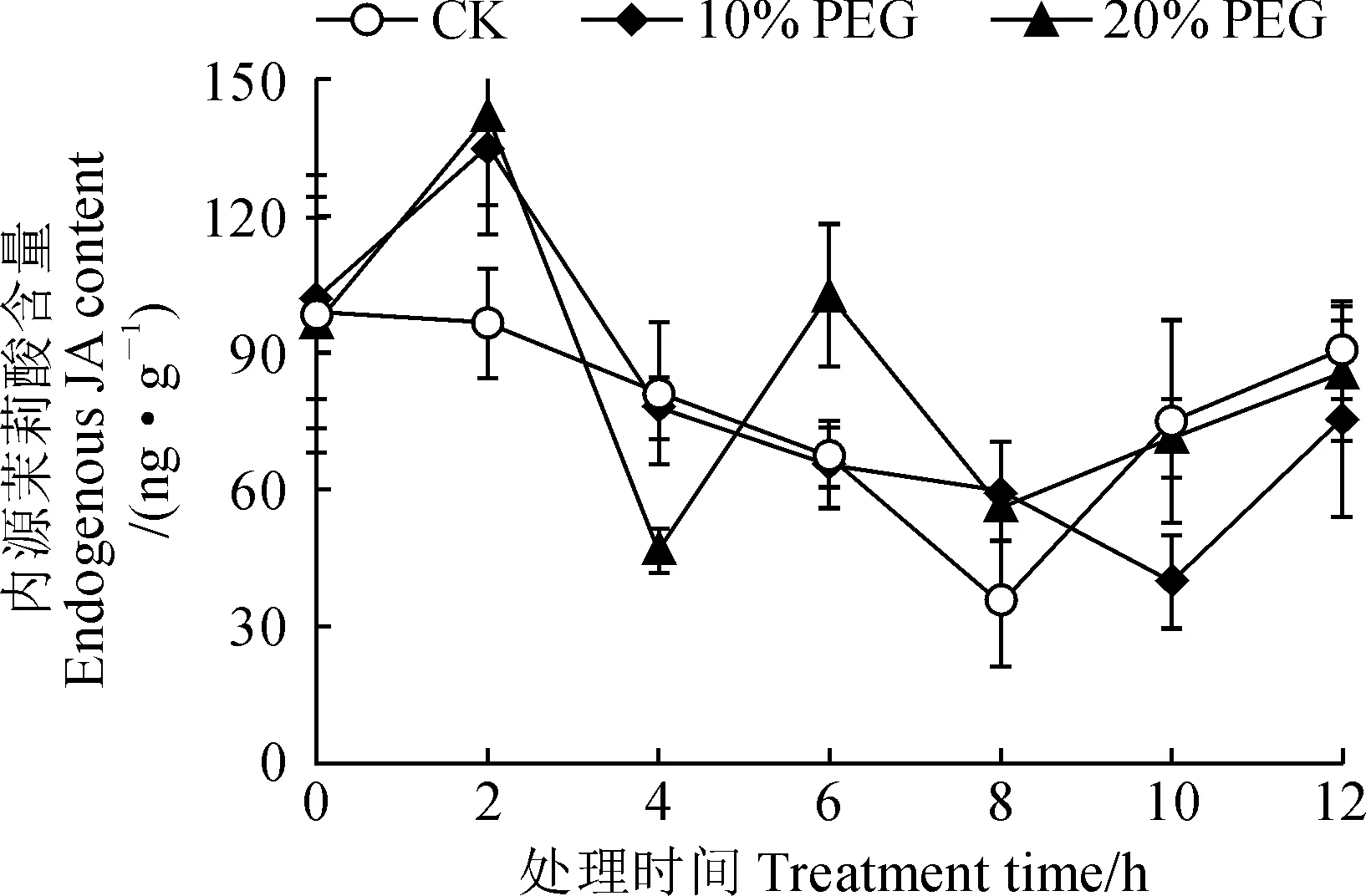
图2 模拟干旱胁迫处理下不同时段北柴胡根中内源茉莉酸的含量变化Fig.2 Changes of endogenous JA content in the roots of B. chinense at different time points under drought stress
2.3 干旱胁迫对BcMYC2及柴胡皂苷生物合成途径关键酶基因的相对表达量影响
图3,A显示,BcMYC2基因相对表达量在PEG6000处理2 h时最高,此时20% PEG6000和10% PEG6000处理组远高于对照组,而20% PEG6000处理又高于10% PEG6000处理; 20%和10% PEG6000处理组BcMYC2基因相对表达量在处理2~4 h期间大幅下降,在处理4 h之后小幅波动整体趋于平缓,10% PEG6000处理的基因相对表达量在4~8 h间略有波动。
同时,柴胡皂苷生物合成途径中4个关键酶基因HMGR、FPS、IPPI、β-AS在20%和10% PEG6000处理下的表达情况如图3,B-E所示。其中,20% PEG6000处理组4个关键酶基因相对表达量峰值均出现在胁迫4 h处,而10% PEG6000处理组各关键酶基因表达量峰值均出现在胁迫6 h处,且各基因相对表达量峰值处表现为20% PEG6000处理组的高于10% PEG6000处理组,10% PEG6000处理组又高于对照组。具体而言,HMGR基因相对表达量在两个PEG6000处理组中峰值过后趋于稳定,而对照组的表达量在实验过程基本稳定。IPPI基因相对表达量在20% PEG6000处理组于4 h达到峰值后,在4~6 h间快速下降,但在6~8 h间逐渐上升,并在8 h处出现第2个峰值,而其低于4 h处的峰值。FPS基因相对表达量在10% PEG6000处理组中于2 h处有一个峰值,但此时的表达量远低于6 h处的表达量;FPS基因相对表达量在20% PEG6000处理组于8 h处出现第2个峰值,但其表达量远低于4 h处的峰值。β-AS相对表达量在10% PEG6000处理组中于2~6 h处于较高水平,于6~8 h间快速下降,8~12 h再次处于上升趋势。
以上模拟干旱胁迫处理结果表明,北柴胡根系BcMYC2表达量在处理组与对照组间有显著性差异,说明适度干旱胁迫可促进转录因子BcMYC2的表达;柴胡皂苷生物合成途径中4个关键酶基因HMRG、IPPI、FPS、β-AS相对表达量在20% PEG6000处理4 h时与对照组有显著性差异,在10% PEG6000处理6 h后与对照组存在显著性差异。整体上来看,关键酶基因表达量峰值出现的时间晚于BcMYC2基因表达量的峰值出现时间,说明BcMYC2可能参与调控关键酶基因的表达。
2.4 干旱胁迫处理对北柴胡根中柴胡皂苷含量的影响
从图4可知,10%和20% PEG6000模拟干旱胁迫后北柴胡根中柴胡皂苷a、d含量在36 d内表现出逐渐升高的趋势(图4,A-C)。其中,在干旱胁迫开始时(0 d),对照组及处理组柴胡皂苷a、d含量均分别约为4.0、5.0 mg·g-1。在干旱胁迫期间,20% PEG6000处理组柴胡皂苷合成速率高于10% PEG6000处理组和对照组,柴胡皂苷a、d含量整体较高。在干旱胁迫36 d后,柴胡皂苷a、d和a+d含量在20% PEG6000处理组中分别达到9.17、11.31、20.48 mg·g-1,在10% PEG6000处理组分别达到8.09、10.07、18.17 mg·g-1;此时两处理组各项柴胡皂苷含量明显高于相应对照组,且差异均达到显著水平。另外,干旱胁迫12 d时,柴胡皂苷含量积累速度下降,特别是对照组中柴胡皂苷d含量在胁迫12 d后表现出逐渐下降趋势,推测可能与北柴胡根在胁迫12 d后逐渐出现腐烂有关。
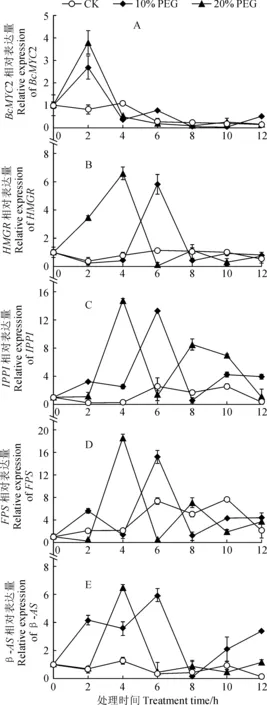
图3 模拟干旱胁迫处理下不同时间BcMYC2基因及柴胡皂苷合成途径中关键酶基因的表达量变化Fig.3 Changes in expression of BcMYC2 gene and key enzyme genes in saikosaponin synthesis pathway at different time points under simulated drought stress
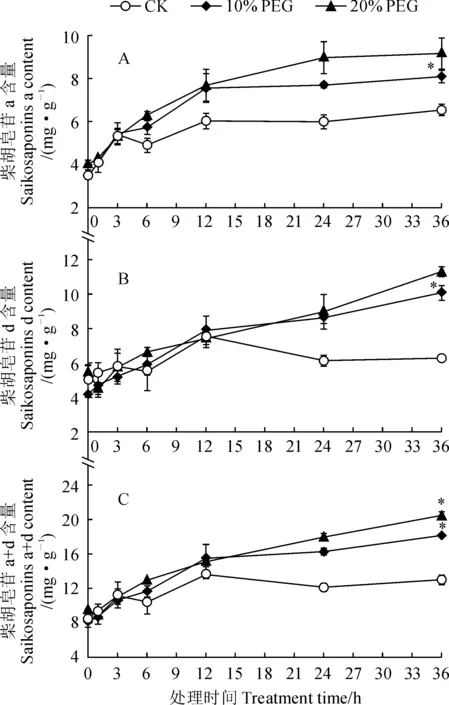
*表示同期处理与对照间在0.05水平存在显著性差异图4 模拟干旱胁迫处理下不同时间北柴胡根内柴胡皂苷含量的变化* indicates significant difference between treatment and control within same time point at 0.05 levelFig.4 Changes of saikosaponins in the roots of B. chinense at different time points under simulated drought stress
3 讨 论
植物在生物或非生物胁迫下,茉莉酸信号通路被激活,内源茉莉酸类物质等信号分子含量升高,释放出相应的转录因子,刺激植物次生代谢途径中关键酶基因的转录活性,进而促进植物次生代谢产物的合成并积累[13]。茉莉酸及其衍生物茉莉酸甲酯等茉莉酸盐类是由亚麻酸途径衍生而来,其具有环戊酮基。茉莉酸盐类广泛存在于植物界,对其调控机理研究发现茉莉酸盐可调控多种基因的表达,主要可分为两大类:一类与植物自身的生长发育有关,如种子的萌发、花粉及花的发育、果实的成熟等;另外一类与植物的防御有关,如病虫害、机械损伤、干旱胁迫及盐胁迫等[14]。当植物受到逆境胁迫时,抗逆基因表达可产生一些特有的次生代谢产物。这些次生代谢产物不是植物生长发育所必需的,但却在植物防御反应中发挥重要作用,也被广泛应用于药物、香料及化工产品。例如,加入外源茉莉酸可促进珍贵的药用真菌牛樟芝产生总三萜及多糖[15]。植物方面如微型月季受茉莉酸处理后,可激发萜类次生代谢产物的合成,这些萜类化合物可用于玫瑰精油的制作[16]。
Yu等[17]实验发现bHLH转录因子家族可与目的基因启动子区域的E-box或G-box结合(G-box是E-box的其中一种),进而提高基因的表达量。E-box是基因启动子区域上游通常存在的结构,由CNNTG 6个碱基排列成特殊回文序列[18]。能够被转录因子识别并结合,进而激活基因进行转录。BcMYC2基因表达量提高后与关键酶基因的启动子区域结合,不同基因启动子区域的E-box或G-box数量不同,所以对HMGR、IPPI、FPS、β-AS基因表达量的影响有强有弱。
在本研究的模拟干旱胁迫试验中,为了给田间种植的北柴胡种苗提供适宜的人工培养条件使用了Hoagland’s营养液,Hoagland’s营养液是植物营养液中最常用的一种配方。为了使用方便、简化操作、用量准确、减少误差,直接购买了含植物所需的大量无机元素、微量元素、铁盐、有机物的母液,使用母液直接配制1/4 Hoagland’s营养液。Hoagland’s营养液可提供柴胡生长所需物质,但柴胡习性是耐干旱怕水涝。本研究使用的北柴胡种苗在北京市延庆区田间肥沃疏松的砂质土壤中种植,而排水不良会导致柴胡根部发生腐病造成死亡[19]。因此,选择田间种植生长态势均一的北柴胡种苗置于1/4 Hoagland’s营养液培养,会造成北柴胡根部一直处于水涝状态,在胁迫12 d后开始逐渐腐烂对柴胡根部柴胡皂苷a、d含量产生不良影响。PEG6000可作为渗透调节剂调节1/4 Hoagland’s营养液的渗透压模拟干旱胁迫实验,柴胡适应性较强耐干旱耐贫瘠,因此在10%、20% PEG6000溶液中生长态势好于1/4 Hoagland’s营养液培养,36 d内未出现腐烂并且根部柴胡皂苷a、d含量逐渐积累。韩晓伟等[20]采用盆栽控水法对北柴胡进行干旱胁迫实验,结果显示适度干旱时(土壤饱和含水量40%~50%)柴胡皂苷生物合成途径中的关键酶基因表达量显著提高,柴胡皂苷含量也随之提高。
干旱胁迫是常见的非生物胁迫方式,对植物的生长发育过程和次生代谢物的合成有重要影响,本实验推测当柴胡感受外界干旱胁迫信号时体内茉莉酸类化合物生物合成途径启动,JAZ蛋白被泛素化和降解,从而激活被JAZ等抑制蛋白结合的BcMYC2转录因子,转录因子通过与柴胡皂苷生物合成途径上的关键酶基因启动子部分E-box或G-box结合,调控关键酶基因的表达;本实验研究结果显示,BcMYC2转录因子在干旱胁迫2 h时出现峰值,4个柴胡皂苷生物合成途径上的基因HMGR、IPPI、FPS、β-AS的相对表达量在干旱胁迫过程中均有不同程度增加,最终促进柴胡皂苷的合成并积累。本次实验中对照组在1/4 Hoagland’s营养液中培养存在的腐败现象应在后续实验中加以改进,如可采用盆栽控水法进行干旱胁迫实验,相比将田间栽培的北柴胡置于营养液中植物更适应在土壤中生长。另外,也可直接在实验室播种北柴胡种苗或通过无菌播种的方法得到北柴胡种苗,进而在实验室条件下进行干旱胁迫实验更能保证实验条件可控,即选择的北柴胡种苗生长态势均一。

