牦牛TNP2基因分子特征及其在不同发育阶段睾丸中的表达
蔺蕙,潘阳阳,韩小红,蔡得琪,王萌,卢国杰,柯良备,王瑞刚,王学义,余四九*
(1. 甘肃农业大学动物医学院,甘肃 兰州 730070;2. 金川区农业农村局,甘肃 金川 737100;3. 西吉县农业农村局,宁夏 西吉 756299)
牦牛(Bosgrunniens)是生活在青藏高原及其周围高海拔地区,适应高寒、低氧的特有物种[1-2]。睾丸作为雄性动物产生精子传递遗传信息的重要生殖器官,其发育的优良影响动物的繁殖性能[3]。哺乳动物精子生成包括精原细胞有丝分裂为精母细胞以及精母细胞经过减数分裂形成单倍体的精细胞;精子发生的后期要经历变态反应,这一过程伴随着一些阶段特异性基因的表达[4-5]。圆形精子细胞要准确的分化为成熟精子,其阶段特异性基因必须在一定的时间准确表达[6]。
过渡蛋白(TNPs)是精子发生过程中的一个重要蛋白家族,TNP2为过渡蛋白家族的成员之一[7-13],其主要在精子细胞中表达,调控精子发生过程中组蛋白-核蛋白转换[14];如果TNPs发生异常,就会导致精子畸形的变化和雄性不育[7]。TNP2在圆形精子细胞中特异表达,其缺失会导致精子畸形,进而影响精子的获能及与卵细胞的融合[8],精子运动能力也会降低;TNP2 mRNA过早翻译会导致精子畸形的比例增加及运动速度降低,也是导致雄性不育的主要原因之一[6]。上述研究表明,TNP2在雄性动物睾丸发育和精子发生过程中起着重要作用。
目前,TNP2基因在人、牛、绵羊及小鼠上已得到成功克隆,并且在小鼠、大鼠睾丸中表达的研究[11]提示其在睾丸相关功能方面起着重要作用,但目前尚未见关于牦牛TNP2基因以及其在睾丸发育中的表达方面的报道。本试验通过克隆牦牛TNP2基因编码区序列进行分子特征分析;通过免疫组织化学(IHC)技术检测TNP2蛋白在牦牛睾丸组织中的表达定位;通过荧光定量PCR(RT-qPCR)技术检测TNP2在牦牛睾丸组织中的mRNA表达;通过免疫印迹(Western blot)技术检测TNP2在牦牛睾丸组织中的蛋白表达,以期阐明牦牛TNP2 基因的分子遗传特性及其在牦牛睾丸发育中的表达情况,为进一步探讨其在牦牛精子发生过程中发挥的作用及提高牦牛繁殖性能提供研究依据。
1 材料与方法
1.1 样品采集
根据韩杰等[15]和李忠邦等[16]对不同发育阶段牦牛的分类方法及何静宜[17]对牛年龄的判断方法,选取初生期(0~1岁)、幼年期(1~2岁)、性成熟初期(2~3岁)、性成熟后期(3~7岁)、老年期(7~11岁)公牦牛各5头,处死以后迅速解剖睾丸组织,用无菌生理盐水将其冲洗干净,一部分包裹上锡箔纸并放入布袋中,快速投入液氮并带回实验室,存放在-80 ℃冰箱备用;另一部分利用4%多聚甲醛固定,存放在4 ℃的冰箱中以备用。
1.2 仪器和试剂
Total RNA Kit I(50)购自OMEGA公司;Go ScriptTMReverse Transcription System和GoTaq®Green Master Mix,2×购自Promega公司;SYBR®Premix ExTaqTMEraserTM(Tli RNaseH Plus)购自TaKaRa公司;pMDTM19-T Vector Cloning Kit(大连宝生物工程有限公司);普通PCR仪(T100TMThermal Cycler,Rio-Rad公司,美国);恒温培养箱(日本松下电器有限公司);荧光定量PCR仪(ABI ViiA7,Life Technologies公司,美国);显微镜(DP71,Olympus,日本); 一抗STP2(DBEl)XP®Rabbit mAb(Bioss公司);二抗羊抗兔IgG(Bioss公司);阳离子防脱片购自北京中杉金桥生物技术有限公司;DAB显色液、显/定影液、SP试剂盒购自Bioss公司。
1.3 RNA的提取与cDNA的合成
将存放在-80 ℃冰箱中备用的各发育阶段牦牛睾丸组织样品按RNA抽提试剂盒Total RNA Kit I(50)的说明书提取总RNA,并将总RNA按照反转录试剂盒Go ScriptTMReverse Transcription System说明书反转录,将cDNA保存于-20 ℃冰箱中。
1.4 引物设计
根据GenBank数据库中牛TNP2基因和牦牛β-actin基因的mRNA序列通过primer-Blast设计引物(引物序列见表1)。引物1用于扩增牦牛TNP2基因序列,引物2用于RT-qPCR检测其TNP2在不同发育阶段组织的表达差异;引物3(β-actin)用于内参对照,由上海生工基因科技有限公司合成引物。

表1 引物序列
1.5 牦牛TNP2基因的克隆
牦牛TNP2基因的扩增:PCR反应条件为:95 ℃预变性4 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,循环数40;72 ℃保存5 min,4 ℃保存。用1%的琼脂糖凝胶电泳检测其扩增产物。
构建重组质粒:取一个200 μL的无RNA酶离心管,加入2 μL PCR扩增产物、1 μL pMDTM19-T Vector(20 μL)、5 μL pMDTM19-T Vector(75 μL)、2 μL ddH2O,在普通PCR仪中于16 ℃条件下作用30 min,将反应后的所有液体加入大肠杆菌感受态细胞JM109中,轻轻置于冰上30 min后,于42 ℃的水浴锅中作用45 s,再于冰中作用1 min,吸取890 μL SOC培养基加入作用后的JM109中轻轻混匀,置于摇床(37 ℃,180 r/min)上培养60 min。取培养产物涂在含有Amp、X-gal、IPTG的LB固体培养基上,倒置于37 ℃恒温培养箱中培养过夜。次日,挑选单个白色菌落于无菌水中以其作为DNA模板进行PCR扩增,并用1%的琼脂糖凝胶电泳检测有无单一条带。若条带单一,将剩余液体接种到1 mL液体培养基中摇床(37 ℃,180 r/min)培养过夜,次日取菌液送北京华大基因科技有限公司测序。
5年来,为提升食品药品监管的公信力,中心先后建立督办制度,对重要案件实施跟踪指导;全面实施首日先行联系制度,确保投诉举报人第一时间得到回应;落实和宣传举报奖励制度,制定了《举报人信息保护工作制度》,鼓励“深喉”和企业内部知情人员积极提供违法违规线索。
1.6 牦牛TNP2基因分子特征分析
对测序成功的基因序列,用在线软件NCBI-ORF finder(http://www.ncbi.nlm.nih.gov/projects/gorf/)进行开放阅读框分析;用NCBI在线软件进行比对,分析与其他物种的同源性,选择12种其他物种的TNP2序列,将其核苷酸序列及氨基酸序列与其他物种的核苷酸序列及氨基酸序列进行同源性比对,并用MEGA7.0构建系统进化树。用在线软件ExPASY(https://www.expasy.org/)分析其蛋白质结构,包括:跨膜区、疏水性、蛋白理化性质、磷酸化位点、N-糖基化位点、蛋白质二级结构、蛋白质三级结构。
1.7 RT-qPCR检测TNP2的mRNA表达
引物2和引物3进行普通PCR扩增后,用1%琼脂糖凝胶电泳检测扩增产物。RT-qPCR反应体系(20 μL):SYBR®Premix ExTaqTMEraserTM(2×)10 μL、模板cDNA 2 μL、上游和下游引物各0.5 μL、去离子水7 μL,并每组做4次重复,进行熔解曲线检测,用2-ΔΔCt法计算TNP2基因的相对表达量。
1.8 IHC检测TNP2蛋白在牦牛睾丸中的表达定位
采用王静瑜等[18]的免疫组织化学法,制作石蜡切片经过脱水至蜡,抗原修复,阻断,封闭,孵育一抗,二抗反应,DAB显色,自来水中终止,苏木精复染,盐酸酒精分化,自来水反蓝,脱水透明最后树脂封片并显微镜拍照。
1.9 Western blot检测TNP2蛋白的表达
采用韩小红等[19]的免疫蛋白印迹法,提取不同发育阶段牦牛睾丸组织蛋白样品,制胶并进行SDS-PAGE;采用PVDF膜制作“三明治”转膜;在5%脱脂奶粉中封闭6 h;置于一抗工作液(STP2(DBEl)XP®Rabbit mAb∶5%脱脂乳=1∶100)4 ℃过夜,次日,PBST清洗,将膜置于二抗工作液(羊抗兔IgG∶5%脱脂乳=1∶1 000)室温摇床孵育1 h,PBST清洗;将曝光液(A∶B=1∶1)滴加于膜上用化学发光仪曝光成影并扫描图片。
1.10 数据统计与分析
对每个样品分别进行3次重复试验,荧光定量结果采用2-ΔΔCt计算TNP2基因的相对表达量,蛋白免疫印迹结果利用Image J收集灰度值;所得试验数据使用SPSS 23.0软件进行统计学分析(单因素方差分析-多重比较),P<0.01表示组间差异性极显著,P<0.05表示组间差异性显著,P>0.05表示组间差异性不显著,所有结果用“平均值±标准误”表示。
2 结果
2.1 牦牛TNP2基因的分子特征
2.1.1 TNP2基因的克隆和测序
引物1的PCR产物进行1%琼脂糖凝胶电泳(图1),其结果条带单一并与预期条带的大小基本相符。

M.D2000 DNA相对分子质量标准;1. TNP2基因
2.1.2 TNP2基因的分子特征分析
通过在线软件预测结果显示TNP2蛋白分子式为C602H969N201O186S2,等电点11.63;TNP2蛋白不含跨膜区和信号肽,属于非分泌蛋白;位于78位的精氨酸(Arg)亲水性最强,分值为-3.100,位于116位的丙氨酸(Ala)疏水性最强,分值为0.178,且其亲水性大于疏水性,是可溶性蛋白;包含5个丝氨酸(Ser)、2个苏氨酸(Thr)其潜力值高于阈值,为可能的O-糖基化位点;磷酸化位点分析结果显示TNP2有12个丝氨酸(Ser)、9个苏氨酸(Thr)、1个酪氨酸(Tyr)可能成为该蛋白的磷酸化位点。
TNP2蛋白结构预测:该蛋白由18种氨基酸组成,其脯氨酸(Pro)含量最高为21.1%,不含异亮氨酸(Ile)和甲硫氨酸(Met)(表2);其二级结构包括α螺旋(Hh)占3.91%、延伸链(Ee)占5.47%、β-转角(Tt)占1.56%和无规卷曲(Cc)占89.06%(图2)。

表2 TNP2的氨基酸组成及占比
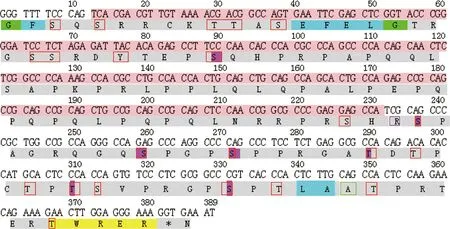
.开放阅读框;.磷酸化位点;.疏水性最强的氨基酸;.亲水性最强的氨基酸;.O-糖基化位点;.β-转角;.延伸链;.无规卷曲;.α-螺旋
利用DNAMAN软件将牦牛的核苷酸序列,与牛、印度水牛、瘤牛、德克萨斯白尾鹿、绵羊、山羊、火狐、白鼬、北美水獭、野猪、野骆驼及人类的TNP2核苷酸序列进行同源性比对,其结果依次为:77.1%、79.2%、79.7%、76.6%、71.0%、72.5%、64.0%、64.0%、62.0%、63.5%、63.8%及52.4%。将牦牛TNP2基因的氨基酸序列与上述物种进行同源性比对,结果显示其与瘤牛的同源性最高为74.2%,而与人类的同源性最低为37.2%。使用软件 MEGA 7.0,进行牦牛TNP2基因系统进化树的构建如图3所示。进化树结果显示牦牛TNP2基因的进化水平与瘤牛、印度水牛更近,与火狐、人类的进化水平较远。

图3 牦牛TNP2基因系统进化树
2.2 TNP2在不同发育阶段牦牛睾丸组织中的表达
2.2.1 TNP2基因的表达情况
利用引物2和引物3进行普通PCR扩增,产物用1%琼脂糖凝胶电泳进行检测,发现产物条带单一,大小与预期相符(图4),故可用于后续RT-qPCR试验。RT-qPCR结果显示,牦牛TNP2基因在不同发育阶段牦牛睾丸中的表达存在显著性差异,其老年期的表达量极显著(P<0.01)高于其他4个时期,幼年期的表达量极显著(P<0.01)高于初生期、性成熟早期和性成熟后期,而初生期、性成熟早期和性成熟后期三者之间无显著差异(P>0.05)(图5)。

M.D2000 DNA相对分子质量标准;1.初生期;2.幼年期;3.性成熟初期;4.性成熟后期;5.老年期
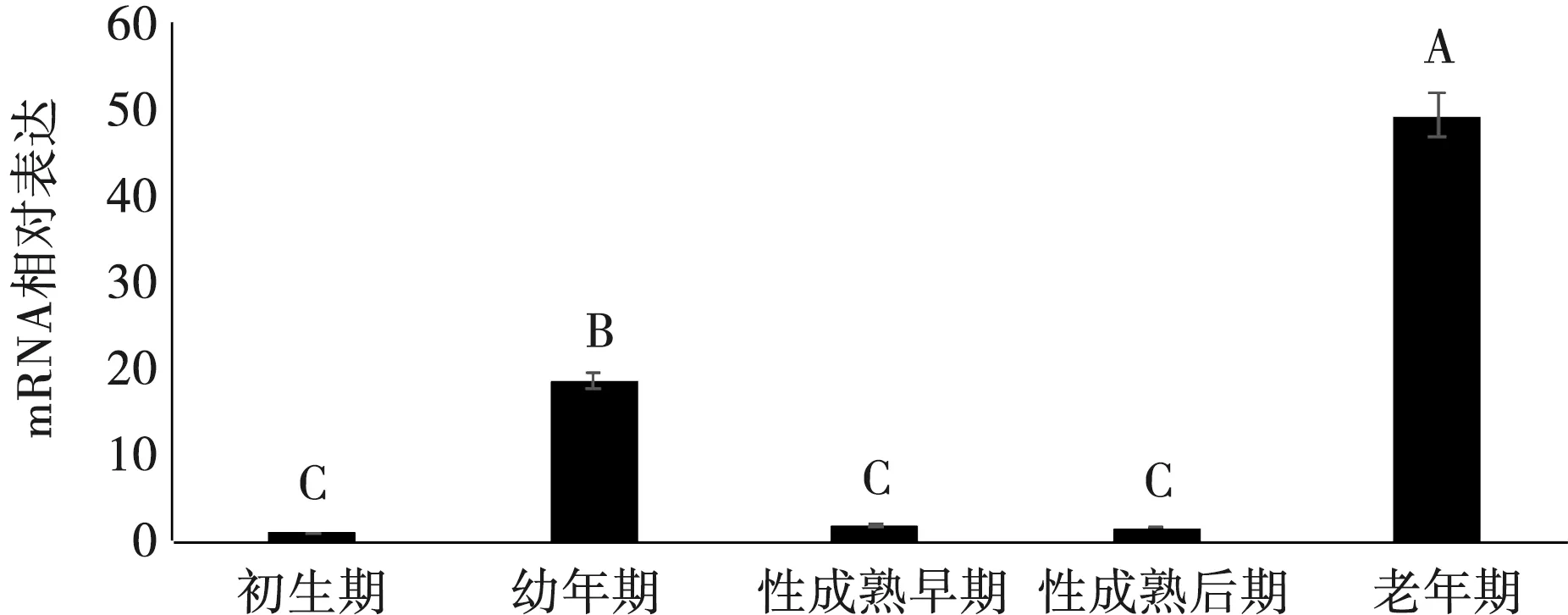
注:不同大写字母表示差异极显著(P<0.01),相同字母表示差异不显著(P>0.05),下同
2.2.2 TNP2蛋白的表达情况
Western blot结果显示牦牛睾丸组织TNP2蛋白表达量在性成熟初期显著(P<0.05)高于性成熟后期,性成熟后期极显著(P<0.01)高于幼年期、老年期和初生期;在幼年期和老年期的表达量极显著(P<0.01)高于初生期;而幼年期和老年期之间差异不显著(P>0.05)(图6A、6B)。说明睾丸TNP2蛋白在性成熟初期及后期的表达量高于其他发育阶段。
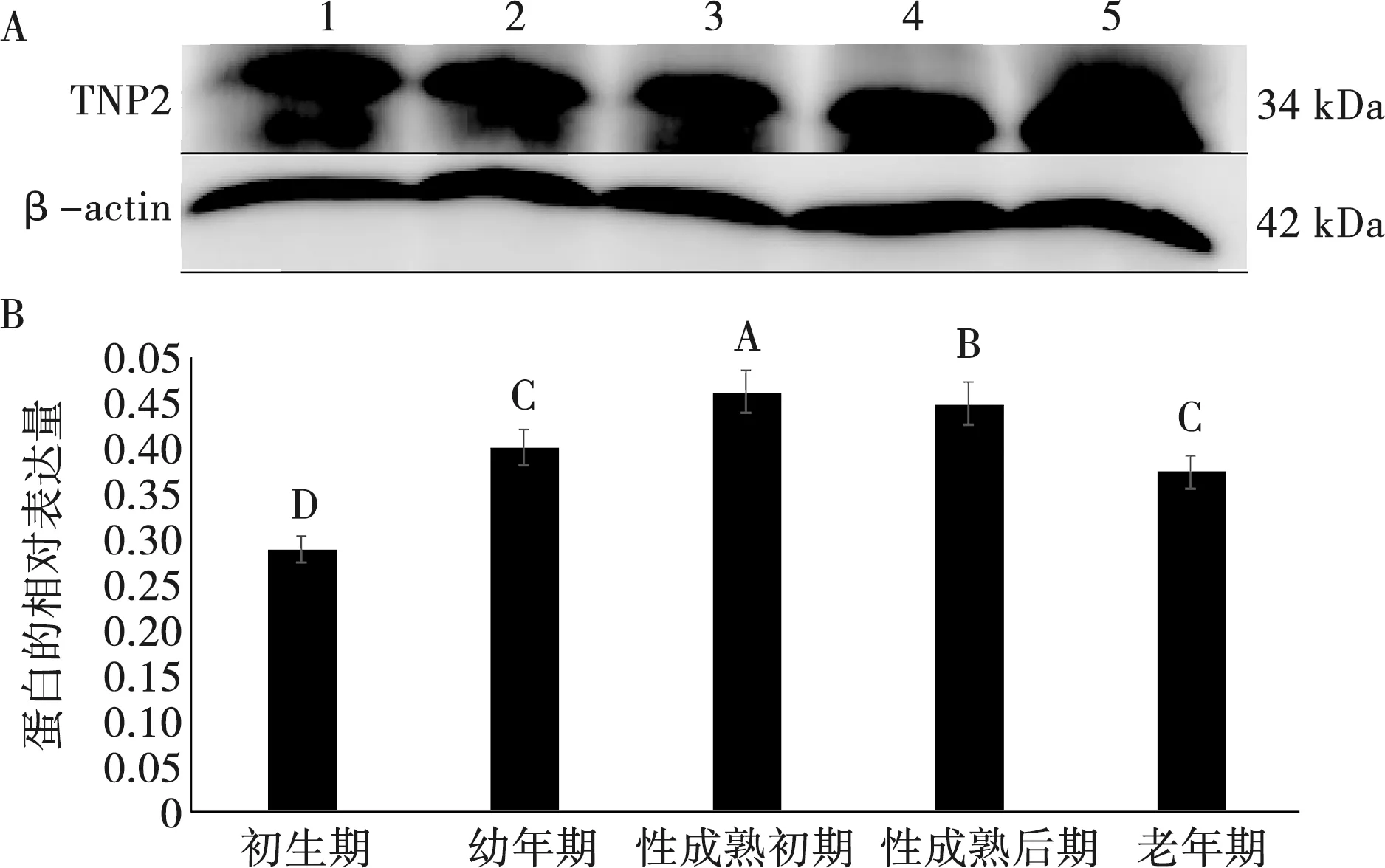
A.Western blot分析(1.初生期;2.幼年期;3.性成熟初期;4.性成熟后期; 5.老年期);B. 蛋白条带灰度分析
2.3 TNP2蛋白在不同发育阶段牦牛睾丸组织中的定位
免疫组织化学结果显示,各发育阶段牦牛的睾丸组织均有TNP2分布(图7A~7D),各个时期的阳性反应部位基本一致,圆形精子细胞和长形精子细胞呈现出颜色较深的棕褐色强阳性表达,睾丸间质细胞、精原细胞、初级精母细胞、次级精母细胞以及支持细胞等呈现出微弱的阳性表达;性成熟初期间质细胞染色呈现的棕褐色反应相对较浅;而老年期的切片中有一部分精子细胞并未呈现颜色较深的棕褐色反应。通过观察发现TNP2蛋白在牦牛睾丸中主要表达于圆形精子细胞和长形精子细胞。

注:CST.生精小管;LC.间质细胞;S.精原细胞;PS.初级精母细胞;SS.次级精母细胞;RS.圆形精子细胞;Sp.精子;SC.支持细胞;标尺=50 μm
3 讨论
近年来,TNP2蛋白在哺乳动物精子发生过程中的作用受到广泛关注,其在牛、绵羊等动物中已成功克隆[4,7],目前关于牦牛的TNP2基因序列尚未见报道。本试验成功克隆了牦牛TNP2基因CDS区序列,将牦牛与其他哺乳动物核苷酸序列同源性比对,其同源性大约只有60%~80%的同源性,而氨基酸序列同源性与其余物种的同源性在50%左右,这与白音巴图等[4]、张帅等[7]对牛、绵羊核苷酸及氨基酸序列与其他物种的同源性比较结果基本一致,进一步验证了TNP2蛋白在哺乳动物中保守性不强[7]这一结论;其理化性质预测发现含有半胱氨酸为1.6%,精氨酸含量为10%左右,赖氨酸含量1.6%,这一结果与卢惠等[10]的研究结果有所不同,其原因可能是TNP2在进化过程中不够保守。
本研究发现TNP2蛋白主要在圆形精子细胞和长形精子细胞中高表达,这与TNP2主要在精子细胞中表达参与组蛋白-核蛋白转换相符[20]。TNP2在初生牦牛睾丸中表达量最低,且表达量随着牦牛性成熟而增加,性成熟牦牛睾丸中TNP2的表达量最高,而老年牦牛的睾丸中其表达量相对下降,且老年牦牛睾丸中有部分精子细胞并未表达TNP2,其可能是老年牦牛精子不能正常成熟、精液质量下降,繁殖能力丧失的原因。此次研究发现TNP2蛋白的这一表达趋势与TNP2主要表达于雄性生殖细胞减数分裂后期,主要参与精子变态过程中组蛋白-核蛋白的转这一生化事件[14]相符。
本试验发现TNP2 mRNA 在不同发育阶段的牦牛睾丸中均有表达,然而其表达量具有差异,表明TNP2在睾丸发育过程中起一定的作用。TNP2基因在幼年牦牛睾丸及老年牦牛睾丸中表达量较高,而在性成熟牦牛睾丸中其表达量反而下降,这可能是睾丸中的细胞组成发生变化,在幼年期及老年期时,睾丸中成熟的长形精子数量少,而在性成熟期睾丸中成熟精子数量增多。有资料显示,TNP2在圆形精子细胞中转录,但储存在翻译抑制状态,一直到长形精子中被激活翻译[8-9,20-24]。
本研究发现牦牛TNP2 mRNA与蛋白的表达水平不一致,出现相反的现象。资料显示,miRNA-122a能够抑制TNP2的转录以及介导TNP2的 mRNA降解[25],故其可能在转录后调控哺乳动物睾丸中TNP2 的表达[10,26-27]。同样有资料显示,miR-469在圆形精子细胞可以抑制TNP2蛋白的翻译,而在伸长的精子细胞中无这种抑制作用,使TNP2 mRNA能够顺利翻译[25,28],故TNP2 mRNA与蛋白相对表达规律不一致可能是由于非编码RNA的调控作用所致。
综上所述,TNP2蛋白在各年龄段的牦牛睾丸中均有表达,而且存在一定的规律性,即其在睾丸的发育以及精子的发生过程中可能起着重要作用。哺乳动物TNP2基因及氨基酸保守性不强,性成熟期牦牛睾丸TNP2基因表达高于其他发育阶段,表明其可能在睾丸的发育以及精子的发生过程中起着重要作用,为进一步研究TNP2基因在牦牛繁殖中的作用提供相关资料。

