FXR1通过相分离激活后期精子细胞中mRNA的翻译
康俊炎,温泽,潘舵,刘默芳
FXR1通过相分离激活后期精子细胞中mRNA的翻译
康俊炎,温泽,潘舵,刘默芳
中国科学院分子细胞科学卓越创新中心,上海 200031
减数分裂后的单倍体精子细胞经过一系列剧烈形态及结构变化,包括细胞质丢弃、细胞核压缩、顶体和鞭毛形成等,最终发育为高度特化的精细胞或精子,此过程被称为精子形成(spermiogenesis)[1~3]。基于精子细胞的形态变化,研究人员将小鼠的精子形成过程划分为16个步骤:第1~8步球形精子细胞期,第9~11步延长形精子细胞期,第12~14步长形精子细胞期,第15~16步精子细胞则基本发育完成,呈现典型的弯钩状[4]。如此复杂的精子细胞发育过程得以有序进行,是因为受到一组时空特异性表达基因的精细调控,这组基因被统称为精子形成基因(spermiogenic gene)。伴随着精子形成过程中细胞核的压缩,精子细胞的转录活性将逐步降低直至完全停止[5]。因此,精子形成基因需提前在精母细胞或早期球形精子细胞中转录为信使核糖核酸(mRNA),然后以翻译抑制状态储存于信使核糖核蛋白(mRNPs)中,至特定发育阶段再被激活翻译,合成蛋白质发挥功能。这个现象被称为“转录–翻译解偶联”,是精子细胞基因表达调控的典型特征[6]。虽然“转录–翻译解偶联”过程为精子形成提供了一个基因表达时空性调控的精巧机制,但长期以来并不清楚储存于精子细胞中的mRNA是如何被有序激活翻译的?这也是生殖生物学中的一个未解之谜。
2022年8月12日,在线发表了中国科学院分子细胞科学卓越中心刘默芳研究组和上海交通大学医学院附属新华医院黄旲研究组的联合攻关成果,报道了她们在小鼠后期精子细胞中发现FXR1通过相分离介导mRNA翻译激活的最新研究。在这项工作中,研究人员联合蛋白组学筛选,RNA多种组学分析,体外、体内实验以及多个突变小鼠模型,确认RNA结合蛋白FXR1通过相分离介导小鼠后期精子细胞中mRNA的翻译激活,从而保障小鼠精子形成过程正常进行[7]。这项工作不但揭示了后期精子细胞中FXR1介导mRNA翻译激活的新机制,而且证明了液液相分离(liquid-liquid phase separation, LLPS)为FXR1激活翻译及保障精子形成和雄性生育必需。
刘默芳研究组长期致力于精子细胞中的转录后基因表达调控研究,在近期的一项研究中,她们发现在球形精子细胞中,小鼠PIWI (MIWI)蛋白与其相互作用小分子非编码RNA—piRNA形成的MIWI/ piRNA复合物,通过招募翻译起始因子EIF3F和RNA结合蛋白HuR,激活了一组精子形成相关mRNA的翻译[8]。然而,她们的早期研究发现,在延长形精子细胞中,MIWI/piRNA通过与脱腺苷酶CAF1相互作用诱导了后期精子细胞中的mRNA降解和清除[9],表明MIWI/piRNA在进入延长形精子细胞期后就不再发挥翻译激活功能。因此,后期精子细胞中储存mRNA的翻译激活机制仍不清楚。
为了挖掘后期精子细胞中潜在的翻译调控因子,研究人员首先比较了不同发育阶段小鼠的睾丸活跃翻译蛋白组分。结果显示,脆性X综合征相关蛋白(Fragile X related protein, FXR)家族成员FXR1大量存在于包含后期精子细胞的成年小鼠睾丸多聚核糖体翻译组分中。进一步研究发现,FXR1结合一大群特异性在后期精子细胞中翻译的mRNA,且与EIF4G3等多个翻译相关因子存在相互作用。上述实验结果提示FXR1可能参与了后期精子细胞中的mRNA翻译调控。此前有研究发现,全身敲除引起小鼠在胚胎期心肌、骨骼肌等发育不良,最终导致其在围产期死亡[10]。因此,为探究精子细胞中FXR1对于其结合mRNA的调控作用,研究人员构建了在生殖细胞中特异性敲除的突变小鼠。结果显示,FXR1所结合mRNA在精子细胞中的表达水平没有明显变化,但翻译活性明显下降;敲除小鼠精子形成受阻、雄性不育。这些发现表明FXR1对后期精子细胞中mRNA的翻译激活和精子细胞发育至关重要。
研究人员进一步发现,成年小鼠中FXR1特异性地在睾丸组织高表达,且在后期精子细胞中的表达水平剧烈增加。更有意思的是,FXR1在后期精子细胞的胞质中呈现明显颗粒状分布。近年来陆续有研究发现,蛋白质与核酸可通过多价相互作用介导的液–液相分离在细胞内形成无膜包被的亚细胞结构,进而实现特定细胞过程的精确时空控制[11,12],其中最典型的例子就是由RNA结合蛋白与RNA组成的核糖核蛋白颗粒(mRNP granules)[13]。FXR1同源蛋白FMR1曾被报道具有相分离能力,并与FMR1的翻译抑制功能相关[14]。研究人员进而发现,FXR1蛋白可在体外和体内自发聚集形成高度动态的液滴或颗粒结构,且高效富集mRNA于这些结构之中。有趣的是,后期精子细胞中的FXR1颗粒同时富集EIF4G3等翻译相关因子及FXR1靶mRNA。因此,研究人员推测FXR1可能通过相分离形成FXR1颗粒,进而参与了mRNA的翻译调控。为了验证这一猜想,研究人员通过可表征RNA翻译状态的TRICK报告系统[15]与慢病毒转导系统,分别在体外培养细胞和体内后期精子细胞中探究了FXR1颗粒形成与否和mRNA翻译激活的相关性。结果显示,野生型FXR1蛋白可以在细胞内形成颗粒,并激活靶mRNA的翻译;相分离能力缺失的FXR1突变体(FXR1L351P)不能形成颗粒,虽然可以结合靶mRNA,但不能激活其翻译;在FXR1L351P末端融合FUS蛋白IDR区段重建相分离能力的融合蛋白(FXR1L351P-IDRFUS)恢复了胞内颗粒形成能力及激活靶mRNA翻译的活性。最后,为了明确FXR1相分离对于小鼠精子形成及可育性的重要性,研究人员进一步构建了生殖细胞中特异性敲入FXR1L351P小鼠模型(Fxr1)。结果显示,在Fxr1后期精子细胞中,FXR1靶mRNA的翻译活性明显降低,Fxr1小鼠精子形成受阻、雄性不育。上述结果共同表明,FXR1相分离介导的mRNA翻译激活为小鼠精子形成及雄性生育必需。
综上所述,在后期精子细胞中特异性高表达的RNA结合蛋白FXR1通过相分离形成FXR1颗粒,同时招募EIF4G3等翻译相关因子,介导了一群后期精子细胞发育必需基因的翻译激活,从而保障了精子细胞发育的正常进行(图1)。这项研究工作发现,FXR1在后期精子细胞mRNA翻译激活中扮演了重要角色,揭示了精子细胞翻译调控的新机制。同时,不同于以前“mRNP 颗粒是用于储存翻译抑制状态mRNA”的认识,该研究发现FXR1相分离为其翻译激活作用必需,提示mRNP 颗粒也参与翻译激活过程。此外,该研究发现相分离缺陷Fxr1敲入小鼠精子形成受阻且雄性不育,重现了敲除小鼠表型,证明了相分离具有重要的生理意义。
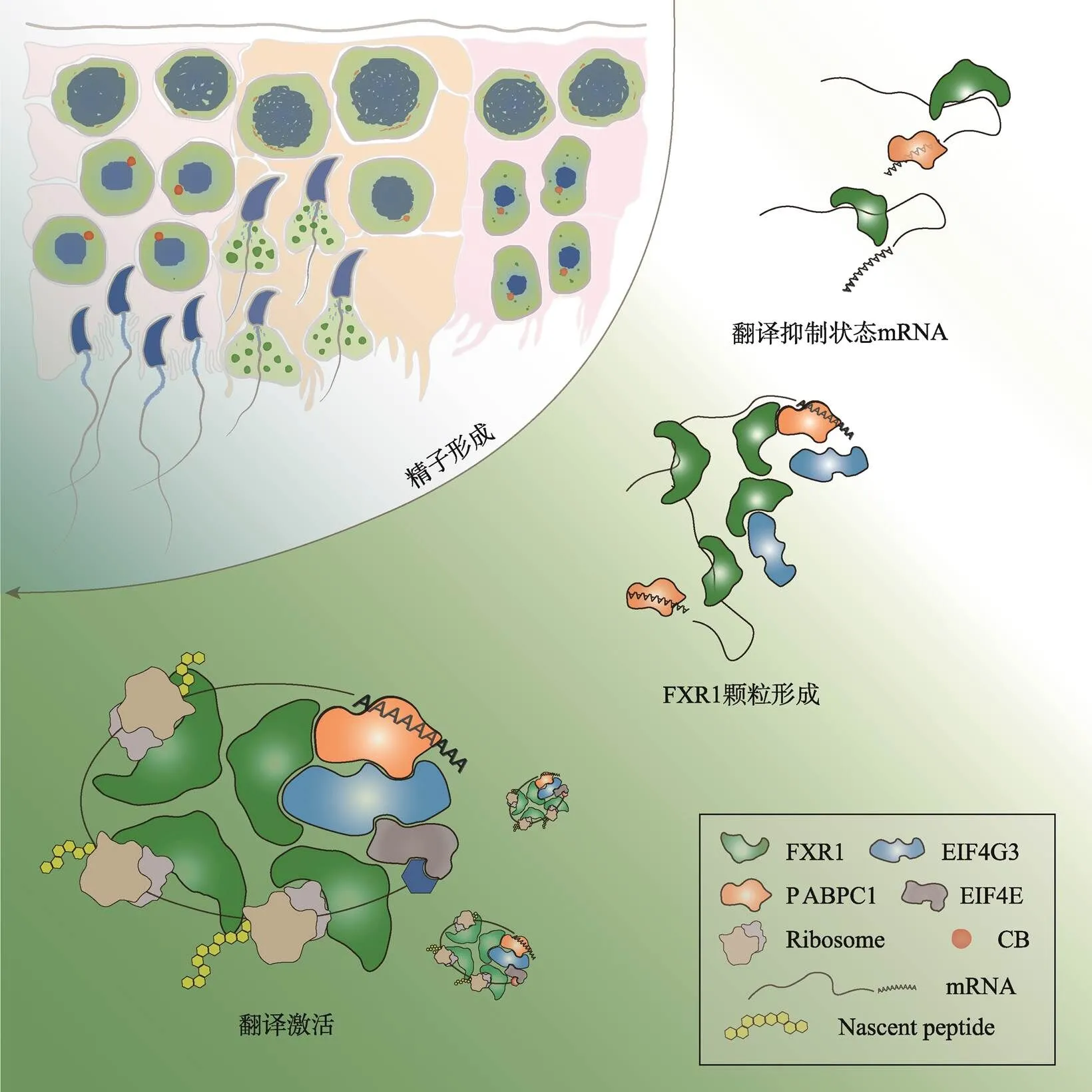
图1 FXR1相分离介导后期精子细胞mRNA翻译激活并驱动精子形成
在小鼠精子细胞的发育过程中,FXR1蛋白水平逐渐升高并通过液液相分离在后期精子细胞中形成颗粒,富集mRNA、招募翻译机器,促进翻译、保障精子细胞发育和精子形成。根据文献[7]修改绘制。
[1] Yan W. Male infertility caused by spermiogenic defects: lessons from gene knockouts., 2009, 306(1–2): 24–32.
[2] Hess RA, De Franca LR. Spermatogenesis and cycle of the seminiferous epithelium., 2008, 636: 1–15.
[3] Govin J, Caron C, Lestrat C, Rousseaux S, Khochbin S. The role of histones in chromatin remodelling during mammalian spermiogenesis., 2004, 271(17): 3459–3469.
[4] Meistrich ML, Hess RA. Assessment of spermatogenesis through staging of seminiferous tubules., 2013, 927: 299–307.
[5] Sassone-Corsi P. Unique chromatin remodeling and transcriptional regulation in spermatogenesis., 2002, 296(5576): 2176–2178.
[6] Idler RK, Yan W. Control of messenger RNA fate by RNA-binding proteins: an emphasis on mammalian spermatogenesis., 2012, 33(3): 309–337.
[7] Kang J-Y, Wen Z, Pan D, Zhang YH, Li Q, Zhong A, Yu XH, Wu Y-C, Chen Y, Zhang XZ, Kou P-C, Geng JL, Wang Y-Y, Hua M-M, Zong RT, Li B, Shi H-J, Li DS, Fu X-D, Li JS, Nelson DL, Guo XJ, Zhou Y, Gou L-T, Huang Y, Liu M-F. LLPS of FXR1 drives spermiogenesis by activating translation of stored mRNAs., 2022, 337, eabj6647. doi: 10.1126/science.abj6647.
[8] Dai P, Wang X, Gou L-T, Li ZT, Wen Z, Chen ZG, Hua MM, Zhong A, Wang LB, Su HY, Wan HD, Qian K, Liao LJ, Li JS, Tian B, Li DS, Fu X-D, Shi HJ, Zhou Y, Liu M-F. A translation-activating function of MIWI/piRNA during mouse spermiogenesis., 2019, 179(7): 1566– 1581.e16.
[9] Gou L-T, Dai P, Yang JH, Xue YC, Hu YP, Zhou Y, Kang JY, Wang X, Li HR, Hua MM, Zhao S, Hu SD, Wu LG, Shi HJ, Li Y, Fu XD, Qu LH, Wang ED, Liu MF. Pachytene piRNAs instruct massive mRNA elimination during late spermiogenesis., 2014, 24: 680–700.
[10] Mientjes EJ, Willemsen R, Kirkpatrick LL, Nieuwenhuizen IM, Hoogeveen-Westerveld M, Verweij M, Reis S, Bardoni B, Hoogeveen AT, Oostra BA, Nelson DL. Fxr1 knockout mice show a striated muscle phenotype: implications for Fxr1p function in vivo., 2004, 13(13): 1291–1302.
[11] Gomes E, Shorter J. The molecular language of membraneless organelles., 2019, 294(18): 7115– 7127.
[12] Feng Z, Chen XD, Wu XD, Zhang MJ. Formation of biological condensates via phase separation: characteristics, analytical methods, and physiological implications., 2019, 294(40): 14823–14835.
[13] Sanders DW, Kedersha N, Lee DSW, Strom AR, Drake V, Riback JA, Bracha D, Eeftens JM, Iwanicki A, Wang A, Wei M-T, Whitney G, Lyons SM, Anderson P, Jacobs WM, Ivanov P, Brangwynne CP. Competing protein-RNA interaction networks control multiphase intracellular organization., 2020, 181(2): 306–324.e28.
[14] Darnell JC, Van Driesche SJ, Zhang CL, Hung KYS, Mele A, Fraser CE, Stone EF, Chen C, Fak JJ, ChiSW, Licatalosi DD, Richter JD, Darnell RB. FMRP stalls ribosomal translocation on mRNAs linked to synaptic function and autism., 2011, 146(2): 247–261.
[15] Halstead JM, Lionnet T, Wilbertz JH, Wippich F, Ephrussi A, Singer RH, Chao JA. Translation. An RNA biosensor for imaging the first round of translation from single cells to living animals., 2015, 347(6228): 1367–1671.
2022-08-02;
2022-08-12
国家重点研发计划项目(编号:2017YFA0504400,2021YFC2700200),国家自然科学基金项目(编号:91940305,31830109,31821004,32171186,91940302,31961133022,32170815,91640201),中国科学院战略性先导科技专项(编号:XDB19010203),上海市科委(编号:2017SHZDZX01,19JC1410200,17JC1420100,21PJ1413800,21ZR1470200),上海高水平地方高校创新团队(编号:SHSMU-ZDCX20210902),国家博士后创新人才支持计划(编号:BX20180331,BX20190081),中国博士后科学基金(编号:2018M642018,2020M670986),生殖医学国家重点实验室开放基金(编号:SKLRM-K202101),基因工程教育部重点实验室资助 [Supported by the National Key R&D Program of China (Nos. 2017YFA0504400, 2021YFC2700200), the National Natural Science Foundation of China (Nos. 91940305, 31830109, 31821004, 32171186, 91940302, 31961133022, 32170815, 91640201), the Strategic Priority Research Program of Chinese Academy of Sciences (No. XDB19010203), the Science and Technology Commission of Shanghai Municipality (Nos. 2017SHZDZX01, 19JC1410200, 17JC1420100, 21PJ1413800, 21ZR1470200), the Innovative Research Team of High-level Local Universities in Shanghai (No. SHSMU-ZDCX20210902), the National Postdoctoral Program for Innovative Talent Grant (Nos. BX20180331, BX20190081), China Postdoctoral Science Foundation (Nos. 2018M642018, 2020M670986), the Open Fund of State Key Laboratory of Reproductive Medicine (No. SKLRM-K202101), and the Foundation of Key Laboratory of Gene Engineering of the Ministry of Education]
康俊炎,博士,研究方向:非编码RNA在精子发生中的功能机制。E-mail: kangjunyan@sibcb.ac.cn
刘默芳,博士,博士生导师,研究方向:非编码RNA在癌症发生和精子发生中的功能机制。E-mail: mfliu@sibcb.ac.cn
10.16288/j.yczz.22-254