Aspirin乙酰化HDAC2抑制肿瘤细胞增殖
戚 倩,余 巍
(复旦大学 生命科学学院,上海 200438)
乙酰化修饰是一种极其重要的蛋白质翻译后修饰,高度保守且可逆,能够调控体内诸多蛋白的功能,如代谢酶、组蛋白、转录因子等[1-2].乙酰化修饰最早发现存在于组蛋白,随着研究的深入,大量非组蛋白的乙酰化修饰被发现且广泛分布于各个亚细胞器中.乙酰化通过影响蛋白活性、定位、稳定性及蛋白相互作用等参与调控细胞的代谢、衰老、凋亡、炎症反应和免疫反应等几乎所有的细胞生物学过程.乙酰基转移酶和去乙酰化酶共同调节乙酰化和去乙酰化的动态平衡,乙酰化调控的异常与肿瘤的发生发展密切相关[3].很多研究揭示了去乙酰化酶在肿瘤中的异常表达和活性.去乙酰化酶也因此成为具有前景的抗癌药物靶点,我国自主研发的组蛋白去乙酰化酶抑制剂(Histone Deacetylase Inhibitors, HDACIs)西达苯胺是第一个被美国FDA授权专利使用的新型抗肿瘤药物.HDACIs可通过调节异常增生和凋亡基因的表达抑制肿瘤细胞的生长和存活[4].HDACs在多种癌症中高表达,如HDAC1在胃癌中高表达[5-6],HDAC2和HDAC3在结肠癌中高表达[7-8].更有表观遗传学研究发现,HDAC1和HDAC2这两种亚型与肿瘤的发生发展尤为相关[9].HDAC2是Ⅰ类组蛋白去乙酰基转移酶(HDAC2),广泛分布于细胞核中,能够促进细胞增殖、分化.有研究结果表明,HDAC2在肿瘤组织中异常表达,敲除HDAC2使某些肿瘤细胞生长停滞甚至凋亡[10].因此特异性的抑制HDAC2,将为癌症的防治提供新的思路.
Aspirin又称乙酰水杨酸,是一种经典的非甾体抗炎药(Non-Steroidal Anti-Inflammatory Drugs, NSAIDs),最早用于解热镇痛,后发现还具有抗血小板的作用而被广泛用于预防心血管疾病.近年来,大量的流行病学和临床研究证据表明,Aspirin还具有抗肿瘤作用,能够抑制肿瘤细胞生长,降低多种恶性肿瘤的发病率、转移率及癌症的死亡率,在消化道肿瘤中尤为明显[11-13].Aspirin也可以和其他药物联合应用发挥抗肿瘤作用,提高肿瘤细胞对放疗、化疗的敏感性.
Aspirin的抗肿瘤机制尚不完全明确,目前认为主要通过环氧化酶(Cyclooxygenase, COX)途径和非环氧化酶途径来抑制肿瘤的发生发展.Aspirin可以对蛋白、激素、核酸等多种底物进行乙酰化修饰[14-15],研究Aspirin的底物及功能对理解其抗肿瘤机制有重要意义.明确Aspirin抗肿瘤作用的分子靶点及其机制,也将对临床治疗起到指导作用.本研究发现Aspirin能够直接乙酰化HDAC2并抑制其去乙酰化活性,进而抑制肿瘤细胞增殖,并进一步鉴定到K51位为乙酰化修饰的关键位点.同时,作为去乙酰化酶,HDAC2能够发生自身去乙酰化.本研究初步揭示了Aspirin发挥抗肿瘤作用的一种新机制.
1 材料与方法
1.1 材料及相关试剂
HEK293T细胞为本实验室保存,结直肠癌细胞HCT116来自上海交通大学医学院附属新华医院,DMEM高糖培养基购自HyClone公司,HA抗体购自英国Abcam公司,FLAG抗体购于美国Sigma公司,HDAC1、HDAC2、Acetylated-Lysine抗体均购自Cell Signaling公司,GAPDH抗体购自Beyotime公司.Flag磁珠购自美国Sigma Aldrich公司.KOD-plus定点突变试剂盒购自日本东洋纺公司,质粒小提试剂盒购自天根生物科技公司.
1.2 细胞培养及转染
HEK293T细胞、HCT116细胞均使用DMEM高糖培养基,并向其中加入10%的胎牛血清,放置于37 ℃、5% CO2的细胞培养箱中培养.
采用PEI转染试剂进行细胞转染实验.当细胞密度达到70%左右时即可进行转染(10 cm培养皿),于1.5 mL的EP管中依次加入1 mL不含血清的DMEM培养基、4 μg目的质粒和12 μL的PEI(1 μg/μL)试剂(即DNA∶PEI=1∶3),混合均匀后,静置15 min,滴加到待转染的培养皿中.8~12 h后更换培养基,36~48 h后收样处理.
1.3 免疫共沉淀(Co-Immunoprecipitation, CO-IP)
除去培养基,用预冷的PBS洗去残留液,加入1 mL裂解液(如NP-40,使用前加入蛋白酶抑制剂),于4 ℃水平摇床快速裂解25 min.将裂解液收集到1.5 mL的EP管中,4 ℃,13 000 r/min,离心30 min,取上清弃沉淀.分别取20 μL上清与5 μL的5×SDS上样缓冲液混匀,95 ℃变性10 min,留作Input待用.向剩余的上清液加入10 μL偶联有抗体的beads浊液,4 ℃旋转4 h或过夜.4 ℃,3 000 r/min,离心2 min,加入1 mL裂解液,重复清洗3次.除去上清,加入适量的1×SDS上样缓冲液,95 ℃煮样15 min,待用.
1.4 免疫印迹(Western blot)
通常配制上层胶浓缩浓度为5%,下层分离胶浓度为10%或12%的SDS-PAGE凝胶用于Western blot实验.加入电泳缓冲液后上样,80 V恒压30 min,调至120 V,直到溴酚蓝指示恰好跑出凝胶,电泳结束.300 mA恒流湿转70 min,取出NC膜,于封闭液(5% BSA)中室温封闭1 h.一抗室温低速水平摇床孵育1 h或4 ℃过夜.加入TBST洗膜3次,每次5 min.根据一抗加入相应的HRP标记的二抗(抗鼠或兔的IgG),室温孵育1 h.洗膜3次,显影记录.
1.5 蛋白纯化
在HEK293T细胞中过表达含Flag标签的目的蛋白,利用Flag-beads进行免疫沉淀,加入5倍beads体积的3×Flag peptide,4 ℃旋转洗脱30 min,离心收集上清,分装,-80 ℃冻存.
1.6 HDAC2酶活检测
以MAL[Boc-Lys(AC)amc]为底物,将真核纯化的野生型HDAC2及其突变体分别加入酶活反应液中混匀,37 ℃避光反应,反应结束时添加胰蛋白酶(5 mg/mL)终止反应,检测F360/F460的荧光强度.去乙酰化反应液:Tris-HCl 50 mmol/L、MgCl24 mmol/L、DTT 0.2 mmol/L、pH=9.0.
1.7 质谱分析
利用同位素D标记的Aspirin处理过表达Flag-HDAC2的HEK293T细胞,利用Flag-beads进行免疫沉淀实验制取样品,交由复旦大学遗传工程国家重点实验室平台质谱中心进行乙酰化谱的质谱分析.
1.8 统计分析
利用Graphpad Prism软件对实验结果进行t检验统计分析.所有数据处理都遵循SEM分析法(mean±SD).P<0.05则认为具有统计学意义即有明显差异,*代表P<0.05,**代表P<0.01,***代表P<0.001,****代表P<0.000 1.
1.9 慢病毒包装
本实验中的shHDAC2的靶向序列来源于Sigma.序列设计如下: shHDAC2#1(5’-CCGGCAGTCT CACCAATTTCAGAAACTCGAGTTTCTGAAATTGGTGAGACTGTTTTTG-3’);shHDAC2#2(5’-CCGGGCAAATACTATGCTGTCAATTCTCGAGAATTGACAGCATAGTATTTGCTTTTTG-3’).
选择生长状态良好的HEK293T细胞,利用PEI试剂转染表达shRNA的慢病毒载体质粒1 μg pLKO.1及包装质粒750 ng psPAX2和250 ng pMD2.G(4∶3∶1),8 h后换液,48 h后收集病毒上清,离心冻存于-80 ℃.感染时,将病毒上清与新鲜培养基以3∶1的比例添加,同时添加polybrene至终浓度8 μg/mL,最后将待感染的细胞悬液均匀加入.
1.10 HDAC2体外去乙酰化实验
通过真核纯化得到Flag-HDAC2和HA-HDAC2蛋白,以HA-HDAC2为底物加入Aspirin共孵育,使其发生乙酰化修饰,达到HA-HDAC2(ac)状态,洗去多余Aspirin.后加入Flag-HDAC2置于37 ℃条件下进行去乙酰化反应.
1.11 CCK-8细胞增殖实验
采用CCK-8试剂盒,消化状态良好的不同细胞系,重悬制成单细胞悬液,利用细胞计数仪计数,配成1 000个/100 μL的细胞悬液,每孔100 μL铺于96孔板,确认细胞贴壁后,每隔24 h每孔加入10 μL CCK-8,反应1 h后,酶标仪450 nm测OD值.
2 结 果
2.1 Aspirin为HDAC2的乙酰化提供乙酰基
首先,我们通过免疫沉淀得到真核纯化的HDAC2-HA蛋白.将不同浓度的Aspirin与HDAC2在体外共孵育,实验结果表明,Aspirin能够为HDAC2-HA提供乙酰基使其乙酰化,且乙酰化程度随Aspirin的浓度梯度的提高而提高(图1(a,c)).为进一步证实Aspirin能够在细胞内为HDAC2提供乙酰基,我们用Aspirin处理过表达Flag-HDAC2的HEK293T细胞,发现Flag-HDAC2的乙酰化程度也随着Aspirin的浓度梯度的提高而提高(图1(b,d)).综上所述,Aspirin可以为HDAC2的乙酰化提供乙酰基且乙酰化程度与浓度呈正相关.
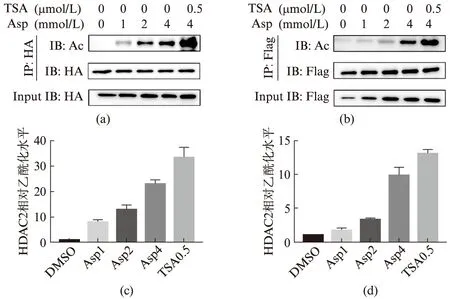
图1 Aspirin乙酰化HDAC2Fig.1 HDAC2 can be acetylated by Aspirin(a) 体外条件下Aspirin能够乙酰化HDAC2蛋白;(b) Aspirin能够乙酰化细胞内的HDAC2;(c),(d)分别为(a),(b)图中乙酰化程度的统计分析,误差线表示标准偏差,每个样本3次独立重复实验,Asp1,Asp2,Asp4分别指1,2,4 mmol/L Aspirin. TSA0.5指的是0.5 μmol/LTSA.
2.2 乙酰化抑制HDAC2的去乙酰化活性
HDAC2作为一个重要的去乙酰化酶,Aspirin乙酰化修饰HDAC2是否会对其去乙酰化活性产生影响.通过免疫沉淀得到真核纯化的Flag-HDAC2蛋白,将蛋白与Aspirin体外共孵育,根据以MAL[Boc-Lys(AC)amc]为底物的酶活检测体系检测HDAC2的去乙酰化活性.结果如图2(a)所示,随着Aspirin浓度的增加,HDAC2的去乙酰化活性逐渐降低;此外,我们从Aspirin处理后的细胞中真核纯化已带有乙酰化修饰的Flag-HDAC2(ac)蛋白,将其用于酶活检测.结果如图2(b)所示,Aspirin处理后,细胞内HDAC2的去乙酰化活性降低.因此,无论是体外共孵育(图2(a))还是直接处理细胞(图2(b)),Aspirin都显著降低了HDAC2的去乙酰化活性,这表明乙酰化修饰会抑制HDAC2的去乙酰化活性.
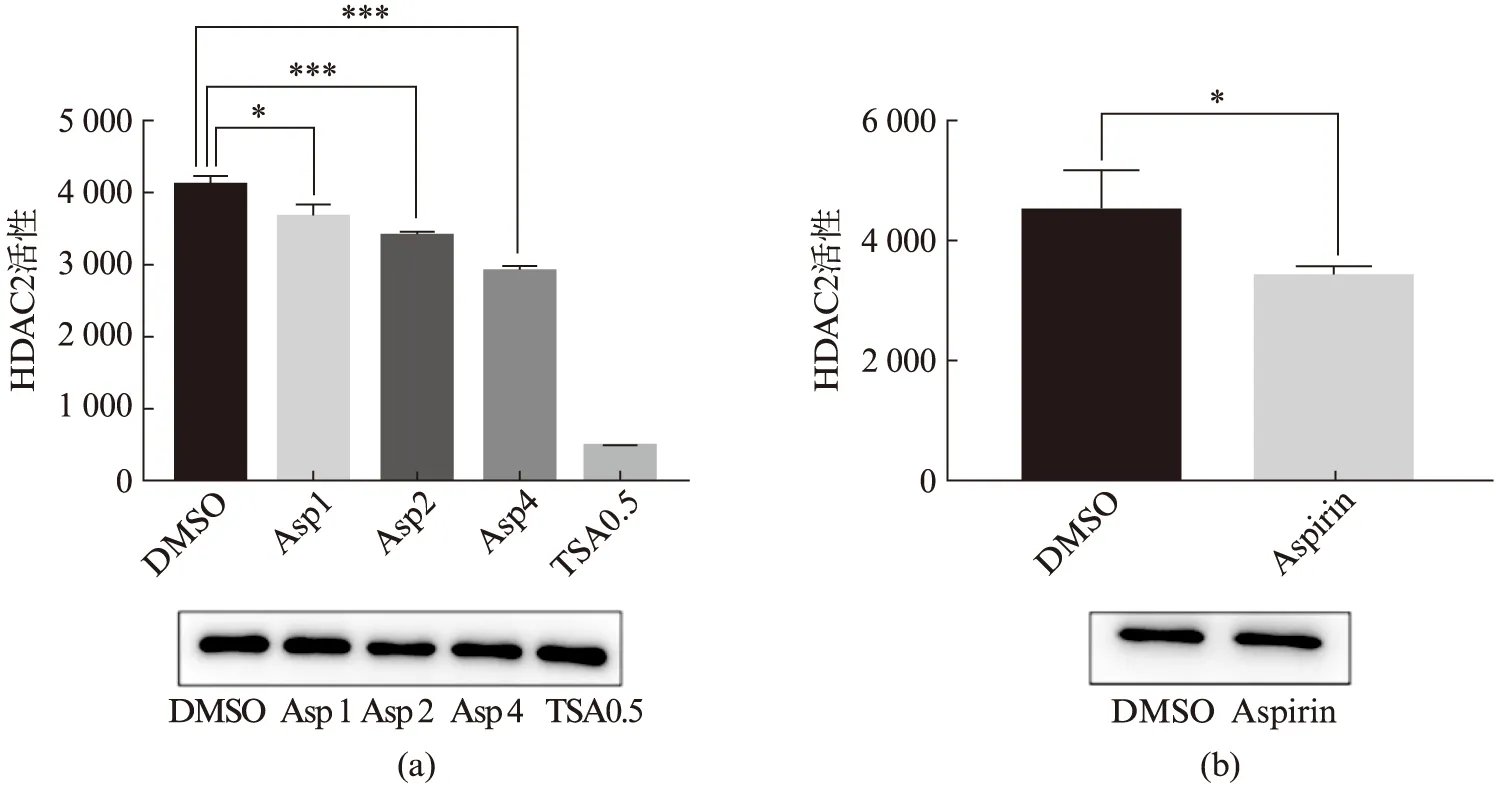
图2 Aspirin抑制HDAC2的去乙酰化活性Fig.2 Aspirin inhibits the deacetylation activity of HDAC2(a) 体外条件下Aspirin与HDAC2共孵育,Aspirin抑制HDAC2的去乙酰化活性,图中HDAC2去乙酰化活性的统计分析,误差线表示标准偏差,每个样本3次独立重复实验;(b) Aspirin处理HEK293T细胞,乙酰化的HDAC2酶活降低,误差线表示标准偏差,每个样本3次独立重复实验(Two-tailed t-test: *P<0.05,***P<0.001).Asp1,Asp2,Asp4分别指1,2,4 mmol/L Aspirin. TSA0.5指的是0.5 μmol/LTSA.
2.3 K51是HDAC2乙酰化修饰的关键位点
利用同位素氘D(2H)标记乙酰基的Aspirin处理过表达Flag-HDAC2的HEK293T细胞,将免疫沉淀得到的样品进行乙酰化谱的质谱分析,我们鉴定到HDAC2发生Aspirin乙酰化修饰的赖氨酸(K)位点为K243、K51、K280、K362、K59、K284、K90、K67、K32、K75、K219、K221(图3(a)).对结果进行分析显示,细胞中约有30%的HDAC2的赖氨酸位点发生的乙酰化修饰来自Aspirin的乙酰基(图3(b)).
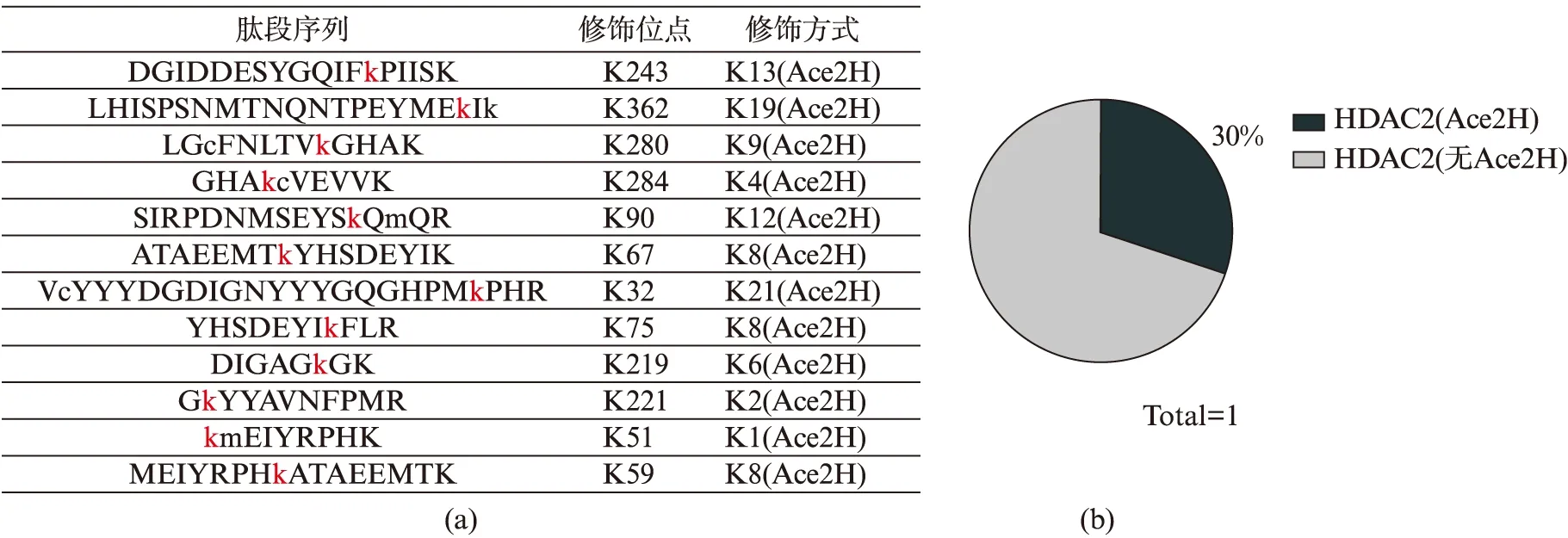
图3 质谱鉴定到的HDAC2的乙酰化位点Fig.3 The acetylation sites of HDAC2 detected by mass spectrographic analysis(a) 质谱分析鉴定到的HDAC2中发生Aspirin乙酰化修饰的肽段及位点;(b) HDAC2中发生Aspirin乙酰化修饰的赖氨酸位点所占比重.
为进一步确定Aspirin介导HDAC2乙酰化修饰的关键位点,我们将质谱鉴定到的赖氨酸(K)位点分别突变为谷氨酰胺Q(模拟乙酰化修饰)和亮氨酸R(模拟去乙酰化修饰),检测突变型HDAC2的去乙酰化活性.实验表明,与野生型(WT)HDAC2蛋白相比,K51Q和K280Q突变型的去乙酰化活性明显下降,其他模拟乙酰化突变型Q无明显差异(图4(a,b),见第630页),这两个位点在质谱鉴定中的肽段峰图如图4(c,d)所示.
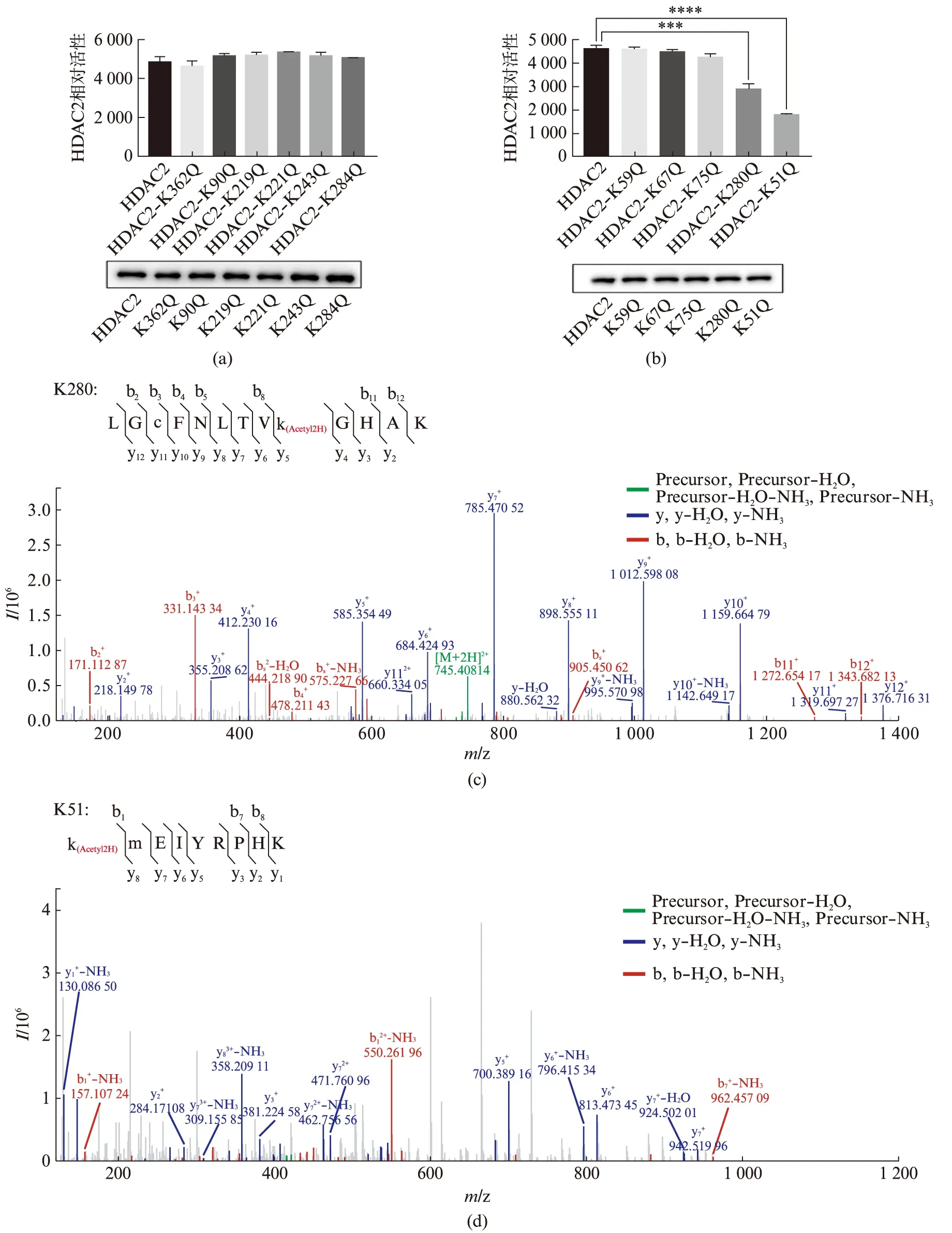
图4 HDAC2K51Q和HDAC2K280Q的去乙酰化活性降低Fig.4 The deacetylation activity of HDAC2K51Q and HDAC2K280Q is reduced(a,b) 质谱鉴定到的乙酰化位点的酶活检测,误差线表示标准偏差,每个样本3次独立重复实验(Two-tailed t-test: ***P<0.001,****P<0.000 1);(c,d) K280、K51位点质谱鉴定所在肽段峰图.
随后,利用NCBI检索数据,将不同物种间的HDAC2进行同源性比对,发现HDCA2的K51位点保守性很高,而K280位点保守性较低(图5(a)),故后续着重对K51位点进行探究.进一步检测K51R的活性发现,其与野生型酶活也无明显差异(图5(b)).综合以上几点,HDAC2 K51位点是Aspirin介导的乙酰化修饰的关键位点,该位点的乙酰化修饰抑制其自身去乙酰化活性.
2.4 HDAC2可以发生自身去乙酰化反应
由于HDAC2是一种重要的去乙酰化酶,且Aspirin可以提供乙酰基使其发生乙酰化,那么HDAC2能否对其自身进行去乙酰化.我们利用免疫沉淀得到真核纯化的Flag-HDAC2和HDAC2-HA蛋白.将HDAC2-HA蛋白与Aspirin共孵育,使其发生乙酰化修饰,转变为HDAC2(ac)-HA的状态,后加入Flag-HDAC2蛋白进行去乙酰化反应.通过Western blot检测结果发现,乙酰化修饰的HDAC2-HA,在与Flag-HDAC2共孵育后,HDAC2-HA的乙酰化水平显著下降,而加入TSA(HDACIs)则可抑制Flag-HDAC2对HDAC2-HA的去乙酰化(图6).因此,HDAC2可以发生自身去乙酰化反应.
2.5 HDAC2乙酰化修饰抑制肿瘤细胞增殖
有报道Aspirin可以抑制肿瘤细胞增殖,且HDACIs也可通过抑制HDACs的活性抑制肿瘤细胞增殖.因此,我们在结直肠肿瘤细胞系HCT116中构建了HDAC2敲低的稳定细胞系(图7(a)),检测Aspirin处理对于敲低HDAC2前后肿瘤细胞增殖的影响.实验结果表明(图7(c)),Aspirin处理可以抑制HCT116的增殖;而对于敲低HDAC2后的HCT116细胞无明显抑制作用.
综上,我们初步证明了Aspirin可以抑制HCT116细胞的增殖且该抑制作用可能与HDAC2有关.为进一步验证Aspirin通过抑制HDAC2的活性来抑制肿瘤细胞增殖,我们在HDAC2敲低的细胞系中分别回补了野生型HDAC2-WT和HDAC2-K51Q突变型(图7(b)),并检测其对细胞增殖的影响.从实验结果可知(图7(c)),回补HDAC2-WT,而非模拟乙酰化的HDAC2-K51Q,可以逆转Aspirin对细胞增殖的抑制作用.结果表明,Aspirin可能是通过抑制HDAC2发挥抗肿瘤作用.
3 讨 论
随着研究的深入,发现除了经典的解热、镇痛、抗炎作用外,Aspirin还具有抗肿瘤作用,且安全性高于其他抗肿瘤药物,故Aspirin在抗肿瘤方面的应用引起广泛关注.早在1988年,Kune等[16]就发现Aspirin除原有的药理作用外,还能够降低患结直肠癌的风险.在随后的研究中,研究人员又发现Aspirin的抗肿瘤作用并不仅仅局限于结直肠癌中,其在肝癌、乳腺癌、前列腺癌、胃癌、卵巢腺癌和肺癌等多种癌症中都表现出抗肿瘤作用[17-20].更有流行病学研究显示,随着Aspirin摄入量的增加,癌症患者因肿瘤导致的死亡率呈指数型下降[21].
然而Aspirin抗肿瘤的机制目前还不完全明确,主要为环氧化酶(COX)途径和非COX途径.比较主流的观点认为其与Aspirin抑制COX的活性有关.研究发现在许多肿瘤组织中都存在环氧合酶-2(COX-2)的过表达[22-23].Aspirin可以下调COX-2的表达,介导COX-2催化的花生四烯酸(AA)途径,阻断前列腺素(PG)的生成,抑制肿瘤细胞增殖,诱导细胞凋亡.Aspirin还可以通过抑制无核血小板中的COX-1导致血栓烷(TXA2)依赖性血小板功能的永久缺陷,从而降低血小板活化,阻碍癌症的发展、转移[24].此外,Aspirin还通过抑制NF-κB、Wnt/β-catenin、cAMP-PKA、PI3K/AKT/mTOR等信号通路,干扰ERK信号传导,激活死亡受体(DR)诱导细胞凋亡、抑制血小板聚集、增加线粒体膜的通透性,影响DNA错配修复系统等发挥抗肿瘤作用[25].当前的诸多研究中,究竟是哪一种或哪几种机制在抗肿瘤中起主导作用,尚存争议.非COX途径很可能是Aspirin抗肿瘤作用的基础,其作用机制比较复杂,仍需进一步的探讨和研究.
乙酰化失调与癌症等疾病有关,因而研究Aspirin的乙酰化底物对于阐明其抗肿瘤的机制有重要意义.在肿瘤细胞中,许多HDACs高度表达,导致去乙酰化作用增强,细胞内乙酰化水平失衡,抑制了某些抑癌基因的表达,促进了肿瘤的发生发展[26-27].越来越多的证据表明HDAC2在结直肠癌中高表达,而敲除HDAC2则会引起某些肿瘤细胞生长停滞和凋亡.在人的早期结肠癌中,结肠息肉肿瘤抑制基因的丢失可以导致Wnt通路依赖性HDAC2表达增加.HDAC2调节β-连环蛋白(β-catenin)降解,β-catenin的降解可以促进肿瘤的发展[7].因此特异性地抑制HDAC2,将成为一种新的癌症防治策略.在本研究中,我们首先通过体外和体内乙酰化实验发现了Aspirin能够直接提供乙酰基使HDAC2乙酰化,且呈剂量相关.由于去乙酰化酶的活性与癌症发生密切相关[28-31],故利用酶活实验检测Aspirin对HDAC2去乙酰化活性的影响.我们的研究结果表明,Aspirin能够抑制HDAC2的去乙酰化活性,且抑制程度随浓度的增加而增强.进一步,通过质谱技术鉴定到了K51为影响HDAC2活性的关键乙酰化修饰位点.通过数据比对发现,K51位的保守性非常高,同时突变型HDAC2 K51Q蛋白相较于野生型HDAC2蛋白的去乙酰化活性显著降低,表明K51位点可能是HDAC2酶活的关键调控位点,暗示可以通过调控K51位点来影响HDAC2的去乙酰化活性.HDACs抑制剂能够抑制HDAC2的活性,维持正常的乙酰化水平,激活特定抑癌基因的表达,抑制肿瘤细胞增殖,诱导凋亡,有相当高的临床应用价值.早在1990年,就有研究发现,HDACIs能够抑制肿瘤细胞的存活[32-33].由此我们猜想HDAC2可能是Aspirin抑制肿瘤细胞增殖的底物.Aspirin通过提供乙酰基使HDAC2乙酰化抑制其去乙酰化活性从而进一步诱导凋亡达到抗肿瘤的目的.为了验证这一猜想,根据以上结果,我们利用Aspirin处理结直肠癌HCT116细胞,发现在Aspirin的作用下,HDAC2乙酰化升高,结直肠癌细胞的增殖受到明显抑制.但Aspirin对HDAC2敲低的HCT116细胞无明显抑制作用,初步证明了Aspirin抑制HCT116细胞的增殖可能与HDAC2有关.接下来又在HDAC2敲低的细胞系中分别回补野生型HDAC2-WT和HDAC2-K51Q突变型,发现回补HDAC2-WT可以逆转Aspirin对细胞增殖的抑制作用,但回补模拟乙酰化的HDAC2-K51Q突变型则无此作用.以上结果进一步说明了HDAC2可能是Aspirin抑制肿瘤细胞增殖的底物之一.综上所述,Aspirin可以为HDAC2提供乙酰基使其乙酰化并抑制其去乙酰化活性,抑制肿瘤细胞增殖,这为研究Aspirin抗肿瘤的机制提供新的思考.
HDACIs在血液和淋巴瘤的治疗上取得了一定的成效,但HDACIs单用药对实体瘤的疗效却并不显著[34-35],这可能是由于泛HDACIs在实体肿瘤中同时发挥了抑癌和促癌的双重效应[36],也可能是HDACIs在实体瘤中抗癌效应并不稳定[37].SAHA是Merck公司开发的第一个HDACIs,并于2006年被美国FDA批准用于治疗皮肤T细胞淋巴瘤.但相关临床数据表明,HDACIs虽然具有较好的抗肿瘤效果,但同时也表现出较大的毒性,且存在半衰期短,用药量大等缺陷,大剂量使用还会造成疲劳、腹泻、厌食、脱水、骨髓抑制和血小板减少症等副作用[38].因此,开发新型HDACIs或将HDACIs与其他抗肿瘤药物联合使用可以产生更好的抗肿瘤效果,减少不良反用.研究表明,Aspirin和其他药物联合使用,可以更好地发挥抗肿瘤效应.Aspirin和COX-2抑制剂联合使用可以降低结肠癌患者的复发率,提高患者的生存年限[39],Aspirin与免疫检查点阻滞剂联用,可以达到更强的抗肿瘤免疫治疗效果[40].2017年,美国预防服务工作组(US Preventive Services Task Force, USPSTF)将Aspirin作为结肠癌的预防用药[41].因此,本研究为靶向HDACIs的联合用药提供了新的思路和开研发方向,有助于开发副作用更小的抗癌药物.
综上所述,我们发现了Aspirin能够直接乙酰化HDAC2并抑制其去乙酰化活性,且HDAC2可能是Aspirin发挥抗肿瘤作用的底物之一,同时HDAC2还能够发生自身去乙酰化.这为探究Aspirin抗肿瘤的功能和机制提供了方向,同时也为开发更为有效的联合用药策略提供了理论基础.

