灌喂鼠李糖乳杆菌对妊娠后期小鼠粪便菌群多样性影响
黄新新,李佳豪,李晓斌,李宏坤,贾怡琪,马利鑫,李 超,贺林娇
(新疆农业大学动物科学学院,乌鲁木齐 830052)
0 引 言
【研究意义】妊娠是复杂的持续性生理应激过程,母体内激素、免疫以及代谢等会发生明显变化,且会出现低水平炎症反应以及胰岛素抵抗现象[1-2],导致妊娠期并发症的产生。增加孕期肠道菌群多样性,维持肠道菌群稳态对于缓解和治疗孕期综合症具有一定的意义。【前人研究进展】肠道菌群稳态对于调控免疫、代谢等病理生理过程发挥重要作用,在妊娠期生理状态发生适应性重构过程中扮演重要角色[3-4]。肠道菌群失调是导致妊娠期并发症产生的因素之一[5]。而益生菌在防治妊娠期并发症的过程中存在一定潜力[6]。马宁等[7]研究发现,益生菌对妊娠母畜的繁殖性能及胎儿的生长性能有促进功能,且益生菌还有助于调节妊娠母体的妊娠期糖尿病。Asemi Z等[8]研究显示,益生菌通过调节血糖水平能抑制孕晚期胰岛素浓度上升,减缓胰岛素抵抗症状。Yeganegi M等[9]研究显示,鼠李糖乳杆菌上清液GR-1可调节胎盘LPS的表达量,对孕期炎症症状有减轻作用。【本研究切入点】目前,关于益生菌对于妊娠母畜的研究主要集中在益生菌对母畜妊娠期疾病的影响,而针对益生菌对妊娠母畜肠道菌群的研究鲜见。而LGG具有调控肠道菌群、改变肠道环境和提高机体免疫能力等生物学作用[10]。【拟解决的关键问题】以孕期小鼠为研究对象,分别为对照组和试验组。在相同的饲养条件和日粮营养水平下,对照组饲喂基础日粮,试验组饲喂基础日粮的基础上灌喂0.5 mL含有0.125 g鼠李糖乳杆菌的灭菌生理盐水,试验期21 d。在整个妊娠通过灌喂鼠李糖乳杆菌探究其对妊娠小鼠粪便菌群多样性和丰度的影响,为鼠李糖乳杆菌在整个妊娠周期的应用提供新的参考依据。
1 材料与方法
1.1 材 料
试验选择体重相近(23.33±1.55) g,配种日期相同的昆明妊娠小白鼠30只,采购于新疆医科大学。
鼠李糖乳杆菌购自西安万方生物科技有限公司,活菌数为1×1010CFU/g。
1.2 方 法
1.2.1试验设计
将30只妊娠小鼠随机分为2组,每组15只,分别为对照组和试验组。在相同的饲养条件和日粮营养水平下,对照组饲喂基础日粮,试验组小鼠在饲喂基础日粮基础上灌喂0.5 mL含有0.125 g鼠李糖乳杆菌的灭菌生理盐水,在09:00进行灌喂。试验期间每3只小鼠为一笼饲养,每组5个重复,隔天换垫料。试验进行至小鼠临产前,直肠采集小鼠粪便样品。表1

表1 日粮组成及营养水平(以风干物质计,%)Table 1 Composition and nutrient levels of diet (Air-dry basis,%)
1.2.2 样品采集
根据配种日期,临产前1 d,直肠采集小鼠粪便样品,同一组3只小鼠的样品合为1个样品,分装于无RNA的冻存管内,液氮冷冻保存。
1.2.3 指标测定
总DNA提取、PCR扩增及Illumina HiSeq测序及结果分析均委托北京诺禾致源生物信息科技有限公司协助完成。最终结果以稀释后的基因组DNA为模板,使用16S rDNA的V4区特异引物515F和806R进行PCR扩增。
515F:5’-GTTTCGGTGCCAGCMGCCGCGGTAA-3’
806R:5’-GCCAATGGACTACHVGGGTWTCTAAT-3’
1.3 数据处理
在Excel中先将数据进行预处理,在使用SPSS 18.0软件进行独立样本T检验分析,试验结果均以平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 灌喂鼠李糖乳杆菌对妊娠小鼠粪便中菌群ɑ多样性的影响
研究表明,妊娠小鼠粪便中菌群α多样性指数显示对照组与试验组之间差异均不显著(P>0.05),但试验组Shannon指数和Simpson指数分别比对照组降低了13.27%(P>0.05)、6.25%(P>0.05)。以97%的一致性(Identity)将序列聚类成为OTUs,共得到810个OTUs,对照组385个,试验组425个,共有OTUs 304个,特有的对照组71个,试验组111个。表2
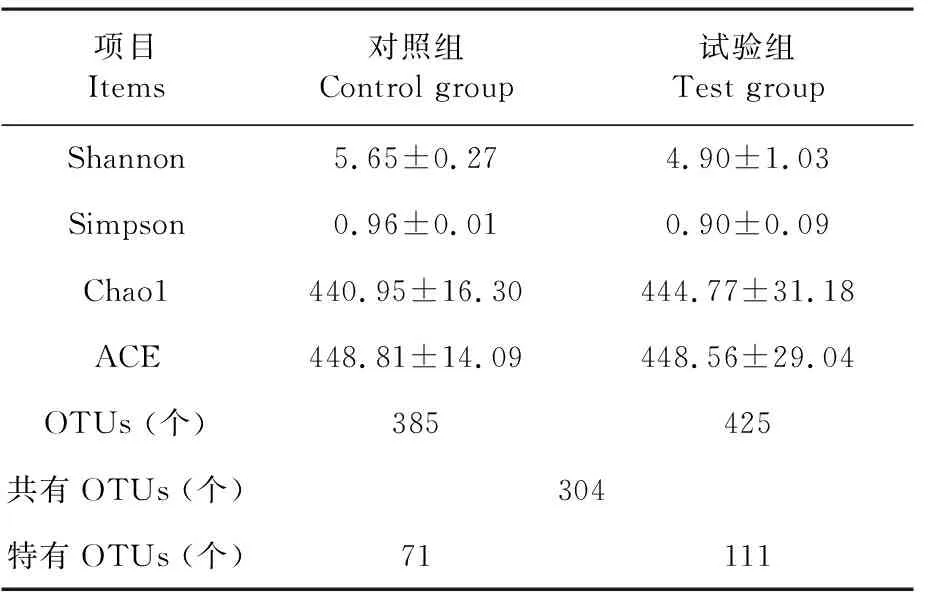
表2 粪便菌群α-多样性Table 2 Fecal flora α-diversity
2.2 灌喂鼠李糖乳杆菌对妊娠小鼠粪便中门水平物种丰度的影响
研究表明,在门水平上top 9的物种如下,妊娠小鼠粪便中的菌门分别为厚壁菌门、拟杆菌门、变形菌门、放线菌门、unidentified_Bacteria、软壁菌门、脱铁杆菌门、蓝细菌、酸杆菌门,其中厚壁菌门、拟杆菌门、变形菌门的丰度之和在90%以上。小鼠粪便中厚壁菌门,试验组比对照组提高了20.12%(P<0.05);但拟杆菌菌门和变形菌门试验组分别比对照组降低了21.95%(P<0.05)、26.15%(P<0.05)。表3
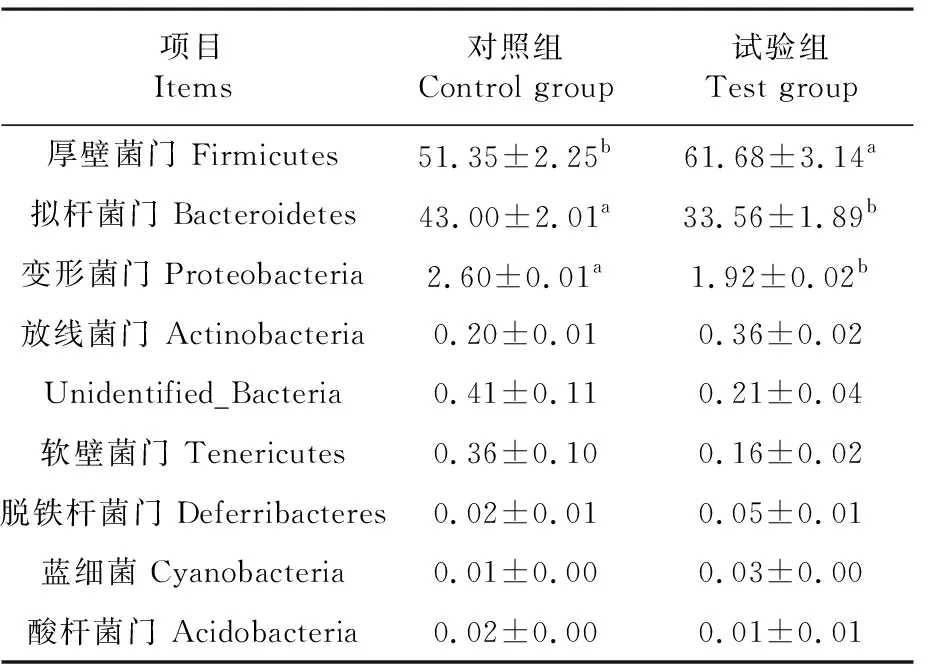
表3 门水平物种的丰度变化Table 3 Abundance of phylum level species (%)
2.3 灌喂鼠李糖乳杆菌对妊娠小鼠粪便中科水平物种丰度的影响
研究表明,在科水平上top 9的物种如下。在科水平上,妊娠小鼠粪便中的物种分别为毛螺菌科、Muribaculaceae、乳酸细菌科、韦荣球菌科、不明梭菌属、脱硫弧菌科、理研菌科、普雷沃氏菌科。毛螺菌科、乳酸细菌科和韦荣球菌科试验组显著高于对照组(P<0.05),其中毛螺菌科和乳酸细菌科试验组分别比对照组提高了23.57%(P<0.05)和50.24%(P<0.05)。其它科水平的物种试验组与对照组之间差异不显著(P>0.05),但Muribaculaceae试验组比对照组降低了6.64%(P>0.05)。表4

表4 科水平物种的丰度变化Table 4 Abundance of family level species (%)
2.4 灌喂鼠李糖乳杆菌对妊娠小鼠粪便属水平菌群丰度的影响
研究表明,在属水平上top 9的物种如下,妊娠小鼠粪便中的物种分别为乳酸杆菌属、未确定毛螺菌科属、Candidatus_Arthromitus、Ileibacterium、Lachnoclostridium、Faecalibaculum、脱硫弧菌属、Turicibacter、Alistipes、罗氏菌属。乳酸杆菌属、Lachnoclostridium与未确定毛螺菌科属试验组显著高于对照组(P<0.05),其中乳酸杆菌属与Lachnoclostridium试验组分别比对照组提高了50.05%(P<0.05)、46.62%(P<0.05)。其它属水平的物种试验组与对照组之间差异不显著(P>0.05),但Candidatus_Arthromitus和Turicibacter试验组分别比对照组降低了20.34%(P>0.05)和12.86%(P>0.05)。表5
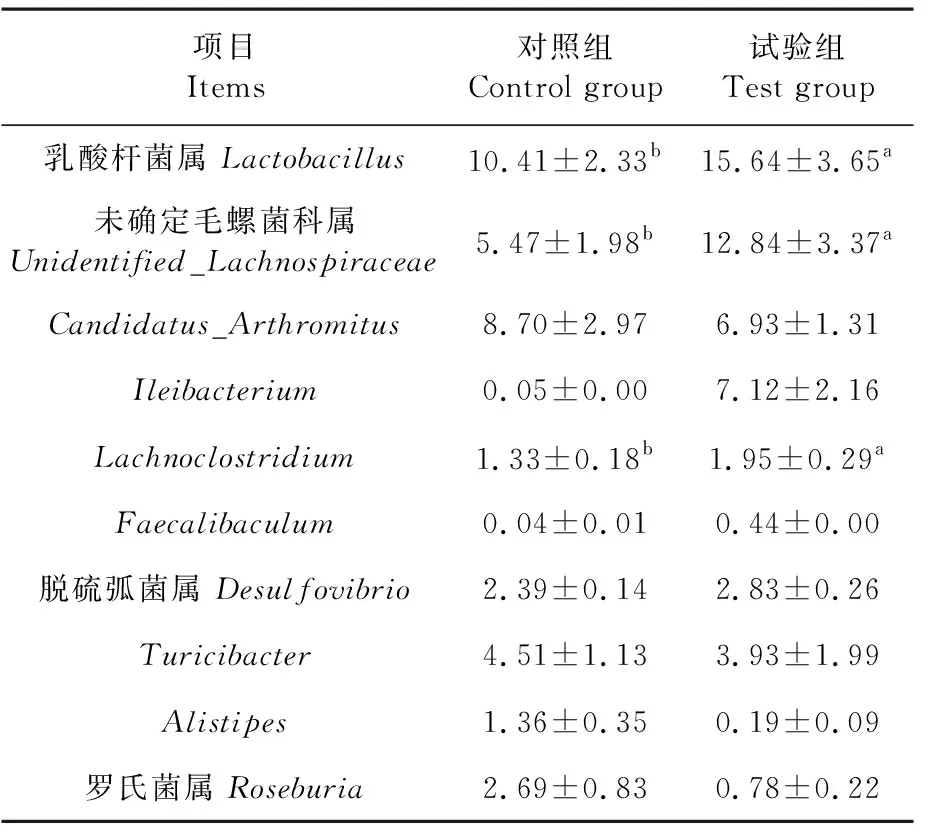
表5 属水平物种的丰度变化Table 5 Abundance of species of genus level (%)
2.5 LEfSe
研究表明,在属和种水平上对照组有差异的菌分别是Candidatus_Arthromitus和unidentified-Clostridiales。图1
2.6 主坐标分子
研究表明,图中PC1为第一主坐标,对检测到的总细菌的代表性贡献率为53.88%,PC2位第二主坐标,贡献率为21.60%。图2
3 讨 论
鼠李糖乳杆菌(Lactobacillusrhamnoides,LGG)属于乳杆菌属、鼠李糖乳杆菌种,为革兰阳性兼性厌氧菌,是目前为止研究最广的益生菌[11]。鼠李糖乳酸杆菌在调控肠道菌群和提高机体的免疫等方面有显著作用[12]。妊娠期营养代谢需求增加,激素分泌水平改变,胃肠道发生系列重构,肠道菌群组成也发生适应性改变,来调控血糖稳态、胰岛素敏感性[13-15]。菌群失调刺激先天免疫系统,激活Toll样受体(Toll-likereceptors,TLRs)和NOD样受体(NOD-likereceptors,NLRs),刺激肠上皮细胞或免疫细胞,促进肠道炎症反应发生[16],炎症递质破坏肠道屏障,肠腔渗透性增加,使肠道处于轻度慢性炎症状态,是导致孕期并发症产生的原因之一。
妊娠期代谢机能发生变化,肠道菌群的构成和丰度也随之改变[17]。GOHIR等[18]发现正常饮食条件下,小鼠孕期某些优势菌丰度显著增高,拟杆菌门相对丰度在整个孕期高于未孕鼠,双歧杆菌科(Bifidobacteriaceae)丰度在孕早期达顶峰,后逐渐下降至丰度与未孕鼠相似,艾克曼菌(Akkermansia)孕早期较为丰富,孕中晚期丰度下降。试验结果显示,在孕后期,门水平丰度较高的菌分别是厚壁菌门、拟杆菌门、变形菌门、放线菌门、unidentified-Bacteria、软壁菌门、脱铁杆菌门、蓝细菌门和酸杆菌门。对照组和试验组厚壁菌门、拟杆菌门和变形菌门的丰度之和分别是96.95%和97.16%。其中试验组厚壁菌门丰度显著高于对照组(P<0.05),而拟杆菌门和变形菌门丰度菌显著低于对照组(P<0.05)。鼠李糖乳杆菌能够提高妊娠后期小鼠粪便厚壁菌门的丰度。由于厚壁菌门丰度与拟杆菌门丰度呈一定比例关系[19],使得试验中试验组拟杆菌门显著低于对照组的原因。同时粪便中大多数的有益菌隶属于厚壁菌门和拟杆菌门[20-21],在试验中试验组厚壁菌门和拟杆菌门丰度升高可能是试验组变形菌门丰度降低的原因,鼠李糖乳杆菌能够抑制肠道中有害菌的增殖,提高有益菌的丰度[22]。刘月静[23]研究结果显示,给正常雌性小鼠喂食鼠李糖乳杆菌菌液,在第0 d、第16 d和第24 d拟杆菌门逐渐增多;厚壁菌门先增多后减少,但整体比0 d时减少;而变形杆菌门逐渐减少。与试验结果有差异的原因,一方面试验仅采集妊娠后期小鼠的粪便,未对妊娠初期粪便菌群丰度做研究,无法判断菌群丰度前后变化的规律;另一方面由于试验小鼠处于妊娠期,所以可能是导致与刘静月[23]研究结果差异的原因。
在科水平试验组毛螺菌科、乳酸细菌科和韦荣球菌科丰度均显著高于对照组(P<0.05)。在属水平,乳酸杆菌属、Unidentified_Lachnospiraceae属和Lachnoclostridium试验组显著高于对照组(P<0.05)。郭佳汶等[24]研究结果显示,给雄性小鼠补喂LGG,第4周LGG组的优势物种为Akkermansia属(16.31%)、Lactobacillus属(11.24%)Unidentifified_Lachnospiraceae属(6.64%)。与试验结果检测到的优势菌有差异主要可能与饲养管理、性别等有关。
在试验结束时小鼠粪便中Shannon、Simpson、Chao1和ACE试验组和对照组均无显著性变化(P>0.05)。郭佳汶等[24]研究结果显示,给雄性小鼠补喂LGG,试验第1周Shannon、Simpson、Chao1和ACE分别为2.02、0.60、366.06和385.76,试验第4周分别为5.17、0.93、283.28和281.63,随着试验的进行Shannon和Simpson在升高,而Chao1和ACE指数在降低,LGG对小鼠粪便菌群多样性具有一定影响。
4 结 论
灌喂鼠李糖乳杆菌对小鼠粪便菌群多样性无显著性影响。在门水平上,厚壁菌门、拟杆菌门和变形菌门的丰度之和在90%以上,厚壁菌门试验组显著高于对照组(P<0.05),但拟杆菌菌门和变形菌门试验组分别比对照组降低了21.95%(P<0.05)、26.15%。在科水平上,毛螺菌科、乳酸细菌科和韦荣球菌科试验组显著高于对照组。在属水平上,乳酸杆菌属、未确定毛螺菌科属与Lachnoclostridium试验组显著高于对照组。给妊娠期小鼠灌喂鼠李糖乳杆菌,对小鼠粪便菌群多样性无显著性影响,但可以提高小鼠肠道细菌物种丰度,对厚壁菌门、毛螺菌科、乳酸细菌科、韦荣球菌科、乳酸杆菌属、未确定毛螺菌科属和Lachnoclostridium丰度具有显著性影响。

