代谢综合征与颅内动脉粥样硬化性狭窄的关联性
郭春燕 万秀明 谭兰

[摘要] 目的 探讨汉族人群中代谢综合征(Mets)及其各组分(体质量超标和(或)肥胖、高糖血症、高血压、血脂紊乱)与颅内动脉粥样硬化性狭窄(ICAS)的相关性。
方法 纳入2014年1月—2018年6月在青岛市市立医院神经内科住院和健康查体中心体检的汉族人1 009例,应用2004年中华医学会糖尿病学分会公布的Mets标准诊断Mets,采用华法林-阿司匹林治疗症状性颅内动脉狭窄的随机对照研究(WASID)方法测定ICAS程度。根据是否存在ICAS分为ICAS组190例和非狭窄组819例。采用多因素Logistic回归分析Mets及其组分与ICAS的相关性;不同Mets组分数量者ICAS发生率的比较采用Cochran-Armitage趋势检验。
结果 总人群中Mets与ICAS显著相关(OR=1.59,95%CI=1.15~2.20,P=0.005);随着Mets组分数量的增多,ICAS发生率增高(χ2=8.84,P<0.01);Mets组分中的高糖血症与ICAS显著相关(OR=1.43,95%CI=1.03~1.98,P=0.032)。亚组分析提示,女性(OR=2.17,95%CI=1.27~3.70,P=0.005)和老年(OR=1.77,95%CI=1.22~2.57,P=0.002)人群Mets与ICAS显著相關,且随着Mets组分数量的增多ICAS发生率增高(χ2=11.12、12.28,P<0.001)。此外,女性高糖血症与ICAS显著相关(OR=1.86,95%CI=1.06~3.27,P=0.031),老年人高血压与ICAS显著相关(OR=2.41,95%CI=1.17~4.97,P=0.017)。
结论 Mets与ICAS显著相关,ICAS的发生率随着Mets组分数量增多而增高,Mets组分中的高糖血症与ICAS显著相关。性别和年龄对Mets与ICAS的关系有影响。
[关键词] 代谢综合征;颅内动脉硬化;危险因素;数据相关性
[中图分类号] R589;R743.1
[文献标志码] A
[文章编号] 2096-5532(2021)05-0712-05
doi:10.11712/jms.2096-5532.2021.57.186
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20211101.1334.006.html;2021-11-02 13:32:02
ASSOCIATION BETWEEN METABOLIC SYNDROME AND INTRACRANIAL ATHEROSCLEROTIC STENOSIS
GUO Chunyan, WAN Xiuming, TAN Lan
(Department of Neurology, Qingdao Municipal Hospital, Qingdao University, Qingdao 266011, China)
[ABSTRACT] Objective To investigate the association of metabolic syndrome (Mets) and its components (overweight and/or obesity, hyperglycemia, hypertension, dyslipidemia) with intracranial arterial stenosis (ICAS) in the Chinese Han population.
Methods A total of 1 009 Chinese Han individuals who were hospitalized in Department of Neurology or underwent physical examination in Health Examination Center, Qingdao Municipal Hospital, from January 2014 to June 2018 were enrolled. Mets was diagnosed based on the diagnostic criteria for Mets published by Chinese Diabetes Society of Chinese Medical Association in 2004, and the severity of ICAS was measured by the method based on the Warfarin-Aspirin Symptomatic Intracranial Disease study. Accor-
ding to the presence or absence of ICAS, the individuals were divided into ICAS group with 190 individuals and non-stenosis group with 819 individuals. A multivariate Logistic regression analysis was used to investigate the association of Mets and its components with ICAS, and the Cochran-Armitage trend test was used to compare the incidence rate of ICAS between individuals with different numbers of Mets components.
Results In the overall population, Mets was significantly associated with ICAS (OR=1.59,95%CI=1.15-2.20,P=0.005), and the incidence rate of ICAS increased with the increase in the number of Mets components (χ2=8.84,P<0.01). Among the Mets components, hyperglycemia was significantly associated with ICAS (OR=1.43,95%CI=1.03-1.98,P=0.032). The subgroup analysis showed that Mets was significantly associated with ICAS in women (OR=2.17,95%CI=1.27-3.70,P=0.005) and the elderly (OR=1.77,95%CI=1.22-2.57,P=0.002), and the incidence rate of ICAS increased with the increase in the number of Mets components in women and the elderly (χ2=11.12, 12.28;P<0.001). In addition, hyperglycemia was significantly associated with ICAS in women (OR=1.86,95%CI=1.06-3.27,P=0.031), and hypertension was significantly associated with ICAS in the elderly (OR=2.41,95%CI=1.17-4.97,P=0.017).
Conclusion Mets is significantly asso-
ciated with ICAS, and the incidence rate of ICAS increases with the increase in the number of Mets components. Among Mets components, hyperglycemia is significantly associated with ICAS. Sex and age have an impact on the association between Mets and ICAS.
[KEY WORDS] metabolic syndrome; intracranial arterio-
sclerosis; risk factor; correlation of data
顱内动脉粥样硬化性狭窄(ICAS)是亚洲人缺血性卒中的主要原因[1-2]。代谢综合征(Mets)是数种代谢性成分异常集结的病理状态,包括肥胖、高血压、血脂紊乱和糖代谢异常等,它与冠状动脉、颈动脉粥样硬化发生密切关联[3-5],也是心、脑血管疾病的危险因素[6-7]。国外研究显示,Mets、糖尿病、高血压、血脂紊乱与ICAS相关[8-12],但不同研究的结果不尽相同。本文研究汉族人群中Mets及其各组分(体质量超标和(或)肥胖、高糖血症、高血压、血脂紊乱)与ICAS的关系,以及性别和年龄对其关系的影响,为临床控制Mets降低ICAS发生的风险提供理论依据。
1 资料和方法
1.1 研究对象
研究对象为2014年1月—2018年6月在青岛市市立医院神经内科住院和在健康查体中心体检者1 009人。纳入标准:①年龄40岁及以上;②完成颅脑磁共振成像和脑血管磁共振成像及相关实验室检查。排除标准:①非汉族者;②有心房颤动、心源性栓塞或血管性疾病并已行冠状动脉旁路移植术治疗者;③有颅内外动脉夹层、动脉炎、烟雾病、肌纤维发育不良者;④有感染、肿瘤、慢性肝病、肾功能不全者;⑤既往有卒中史者。
1.2 Mets诊断标准
采用2004年中华医学会糖尿病学分会公布的中国人Mets诊断标准[13],具备以下4个组分的3个或全部者可以诊断为Mets:①体质量超标和(或)肥胖(体质量指数(BMI)≥25 kg/m2);②高糖血症:空腹血糖≥6.1 mmol/L和(或)餐后2 h血糖≥7.8 mmol/L,和(或)已经确诊为糖尿病并治疗者;③高血压:收缩压/舒张压≥18.7/12 kPa,和(或)已确诊高血压并治疗者;④血脂紊乱:空腹血清三酰甘油≥1.7 mmol/L和(或)空腹血清高密度脂蛋白胆固醇<0.9 mmol/L(男)、<1.0 mmol/L(女)者。
1.3 数据采集
由经验丰富的神经内科医生采集研究对象的人口统计学资料(性别、年龄)、血管危险因素(高血压史、糖尿病史、心房颤动史、既往卒中史、吸烟饮酒史、肿瘤史等)。采集所有研究对象空腹静脉血用于检验血糖和血脂。身高体质量测量按照标准测量要求进行,计算BMI(BMI=体质量(kg)/身高(m)2)。采用欧姆龙电子血压计测量研究对象安静休息状态10 min后血压,测3次取平均值。
1.4 影像学评估
应用3.0 T磁共振扫描仪行颅脑和脑血管磁共振成像检查。磁共振成像参数:重复时间/回波时间(20~25)/(2~3) ms,偏转角度15°,矩阵220 mm×220 mm,层厚1.2 mm,层间距0.6 mm。应用时间飞跃法血管成像技术评估颅内动脉状态。应用颈动脉彩色多普勒超声检查排除颅外动脉粥样硬化性狭窄[14]。所有图像均由两位经验丰富、对受检者的临床信息不知情的放射科医生阅读,出现分歧时再咨询第三位阅片者。根据华法林-阿司匹林治疗症状性颅内动脉狭窄随机对照研究(WASID)的方法测定ICAS程度[15]。ICAS被定义为一条或数条脑动脉直径狭窄≥50%,包括大脑中动脉M1和M2段、大脑前动脉A1 和A2段、大脑后动脉P1和P2段、椎动脉、基底动脉、颈内动脉颅内段等。
1.5 统计学分析
采用SPSS 23.0软件进行统计学处理。符合正态分布计量资料数据以±s表示,数据间比较采用Kruskal-Wallis方法;偏态分布计量资料采用M(P25,P75)表示,数据间比较采用Kruskal-Wallis方法。计数资料以频数和百分率表示,数据间比较采用卡方检验。Mets和Mets各组分与ICAS的相关性分析采用多因素Logistic回归分析,并计算优势比(OR)以及95%可信区间(CI);Logistic回归分析校正的因素包括年龄、性别、吸烟史、饮酒史、低密度脂蛋白胆固醇、本次是否新发脑血栓等。本研究中,年龄、低密度脂蛋白胆固醇为连续数值变量,余变量均为二分类变量;回归分析中二分类变量以男性、无吸烟史、无饮酒史、无新发脑血栓组、非Mets组为参照。不同Mets组分数量(Mets诊断标准共包括4个组分,故Mets组分数量为0~4)者ICAS发生率比较采用Cochran-Armitage趋势检验。双侧检验P<0.05为差异有统计学意义。
2 结 果
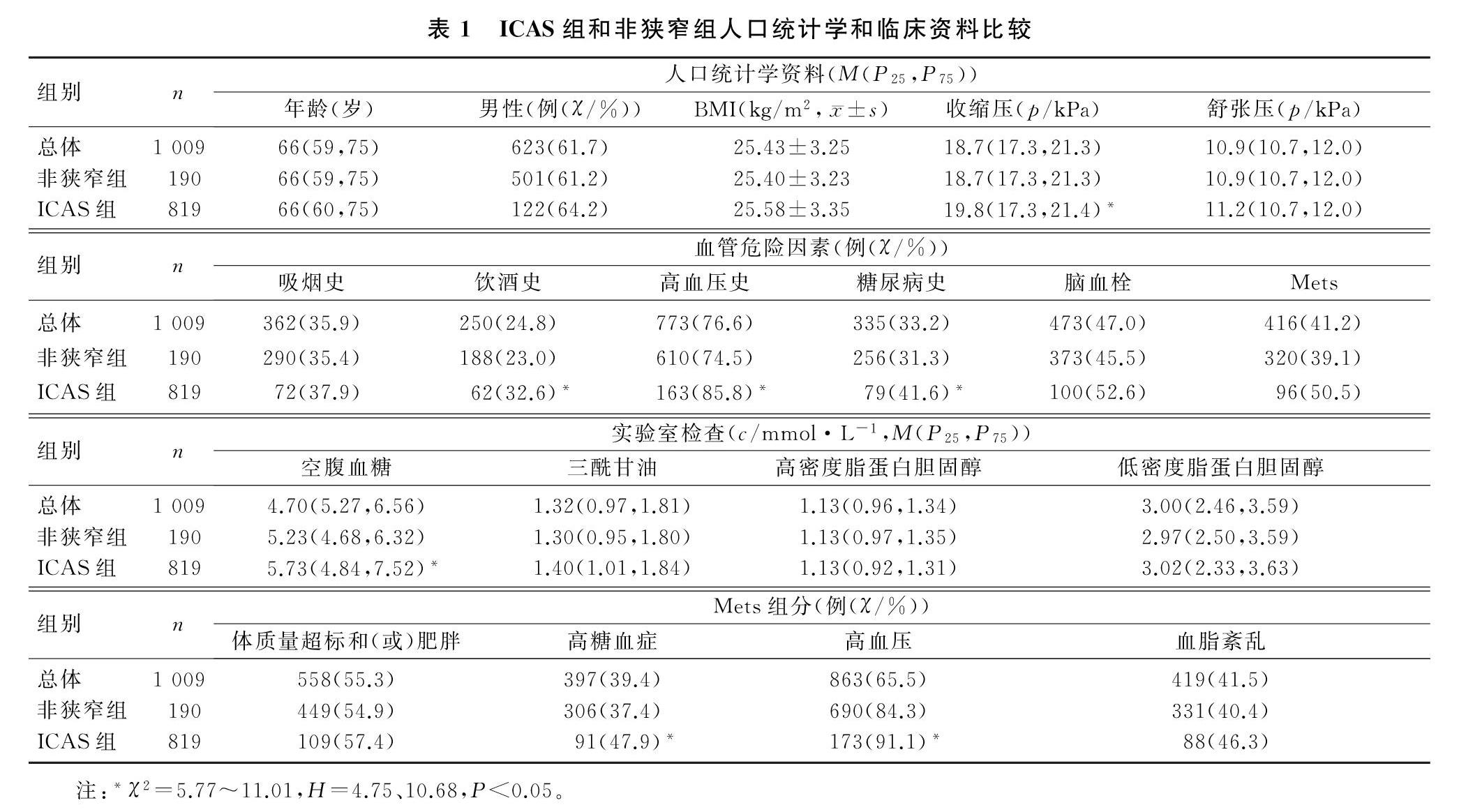
2.1 ICAS组与非狭窄组人口统计学和临床资料的比较
本文1 009例研究对象中,男623例(61.7%),女386例(38.3%),年龄40~97岁,中位数年龄为66岁;Mets组有416例(41.2%),非Mets组有593例(58.8%);ICAS组190例(18.8%),非狭窄组819例(81.2%)。Mets组ICAS 96例(23.08%),非Mets组ICAS 94例(15.85%),Mets组与非Mets组的ICAS发生率比较差异有统计学意义(χ2=8.35,P<0.01)。ICAS组与非狭窄组年龄、性别、舒张压、BMI、吸烟史例数、脑血栓例数、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、Mets体质量超标和(或)肥胖组分及血脂紊乱组分病人的构成比比较差异无显著性(P>0.05);ICAS组饮酒史、高血压史、糖尿病史例数及收缩压、空腹血糖、Mets高糖血症和高血压组分病人构成比均显著高于非狭窄组(χ2=5.77~11.01,H=4.75、10.68,P<0.05)。见表1。
2.2 总人群中Mets与ICAS的关系
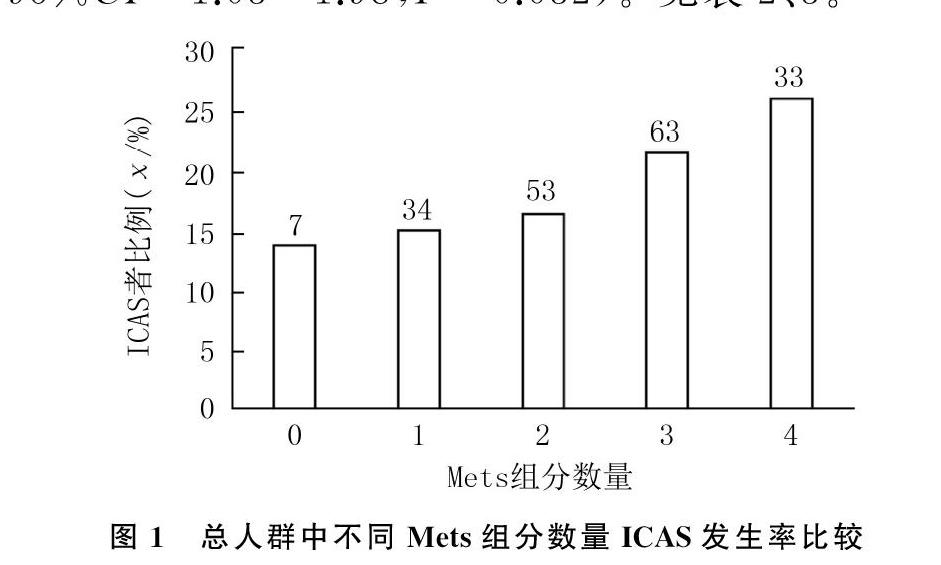
多因素Logistic回归分析显示,总人群中Mets(OR=1.59,95%CI=1.15~2.20,P=0.005)和饮酒史(OR=1.88, 95%CI=1.22~2.91,P=0.004)与ICAS发生显著相关。Cochran-Armitage 趋势检验显示,Mets组分数量越多,ICAS发生率越高,差异有统计学意义(χ2=8.84,P<0.01)。见图1。Mets各组分与ICAS关系的多因素Logistic回归分析显示,高糖血症与ICAS显著相关(OR=1.43,95%CI=1.03~1.98,P=0.032)。見表2、3。
2.3 不同性别和年龄分组Mets与ICAS的关系
亚组分析显示,女性(OR=2.17,95%CI=1.27~3.70,P=0.005)和老年(OR=1.77,95%CI=1.22~2.57,P=0.002)人群Mets与ICAS显著相关,男性和非老年人群中未发现此关联。Cochran-Armitage趋势检验显示,女性(χ2=11.12,P<0.001)和老年(χ2=12.28,P<0.001)人群Mets组分数量越多,ICAS发生率越高;在男性(χ2=1.18,P>0.05)和非老年(χ2=0.04,P>0.05)人群中未显示此趋势。Mets各组分与ICAS的多因素Logistic回归分析显示,女性高糖血症(OR=1.86,95%CI=1.06~3.27,P=0.031)和老年人高血压(OR=2.41,95%CI=1.17~4.97,P=0.017)与ICAS显著相关。
3 讨 论
ICAS是亚洲人缺血性卒中的主要原因[3],而Mets与ICAS相关,控制Mets可能降低ICAS发生的风险。有研究结果表明,Mets和颅内动脉粥样硬化的相关性存在种族差异[16],因此,研究汉族人群Mets与ICAS的关系是十分必要的。研究已显示,不同性别人群Mets发病率[17]及其与ICAS的相关性[18]可能存在差异;此外,年龄是ICAS的独立危险因素[19]。进一步研究性别和年龄对Mets与ICAS关系的影响有重要意义。
本研究结果表明,Mets与ICAS密切相关。对缺血性卒中[8]和非缺血性卒中[9]人群的研究表明,Mets个体发生ICAS的风险更高。本研究中Mets组分数量越多,ICAS发生率越高,与WANG等[20]的研究结果中具有5个Mets组分的病人发生无症状ICAS的风险比无Mets组分者高4倍相一致。WONG等[11]对至少有一项血管危险因素的高风险人群研究表明,高血压、糖尿病、高脂血症是大脑中动脉狭窄的相关因素。本研究仅显示高糖血症与ICAS密切相关,与LPEZ-CANCIO等[10]在居民中随机抽样研究结果一致。高糖血症导致ICAS的机制可能如下。①长期高糖血症引发炎症反应和氧化应激导致血管内皮细胞受损[21],胰岛素减少使载脂蛋白B和极低密度脂蛋白胆固醇积累[22],促进动脉粥样硬化斑块进展。②生理条件下,胰岛素通过PI3K/Akt通路发挥血管保护作用,MAPK通路对血管产生不利影响;胰岛素抵抗时,PI3K通路受损,对血管的不利作用大于保护作用[23]。③胰岛素抵抗、舒张压、肥胖和Mets组分数量与动脉扩张性呈负相关,可能降低动脉扩张性[24]。但也有研究认为高糖血症与ICAS无关[12]。此外,张艳玲等[25]对中国人群研究显示饮酒与ICAS相关。本文研究结果
与之相似,可能与乙醇引发血脂紊乱和炎症反应促进动脉粥样硬化有关[26-27]。但目前饮酒与动脉粥样硬化的关系国内外无定论,需进一步研究。
本文研究结果显示,Mets与ICAS的相关性受性别影响,仅女性Mets与ICAS相关,其机制尚不明确,可能与Mets女性雌激素的抗动脉粥样硬化作用受损有关[28-29]。在不同性别人群中,可能有不同的Mets组分参与了动脉粥样硬化过程,在男性和女性Mets人群中,高密度脂蛋白降低和血糖升高均与颈动脉内膜中层厚度增加相关[30]。而本研究仅在女性中显示高糖血症和ICAS相关,可能与Mets组分性状基因位点在染色体上的分布存在性别差异有关[31]。尚需要更多的临床研究探讨不同性别人群Mets及其组分与ICAS的关系。
研究表明,年龄增长是动脉粥样硬化发展的独立危险因素[19]。其机制可能是:衰老促进炎症反應并影响细胞外基质的合成使斑块进展[32];颅内动脉的抗氧化酶可抗动脉粥样硬化,但其酶活性在老年时显著下降[33]。上述机制与高糖血症导致ICAS的机制有重叠,这可能是本研究在老年人群中显示Mets与ICAS相关的原因。既往研究认为,高血压是颅内动脉粥样硬化的独立危险因素[19],但本研究仅在老年人中显示此关联。
综上所述,在汉族人群中Mets与ICAS密切相关,通过饮食、生活习惯以及药物等方式来控制Mets,尤其是控制女性高糖血症和和老年人高血压,可能有助于预防或延缓ICAS发生。本研究的不足之处在于:首先,这是一个横断面研究,只能探讨Mets及其组分与ICAS之间的关联性,结论尚需纵向研究来进一步证实;其次,本研究对象均是汉族人,这可能会限制研究结果推广到其他种族。因此,本研究得出的结论尚需通过多中心研究、队列研究进行验证。
[参考文献]
[1]WONG L K S. Global burden of intracranial atherosclerosis[J]. International Journal of Stroke, 2006,1(3):158-159.
[2]BANG O Y. Intracranial atherosclerosis: current understan-ding and perspectives[J]. Journal of Stroke, 2014,16(1):27-35.
[3]HERDER M, ARNTZEN K A, JOHNSEN S H, et al. The metabolic syndrome and progression of carotid atherosclerosis over 13 years. The Troms study[J]. Cardiovascular Diabeto-
logy, 2012, 11:77.
[4]OHNUKI T, TAKAHASHI W, OHNUKI Y, et al. Signifi-cance of the presence of metabolic syndrome in patients with asymptomatic
arteriosclerosis affecting the aorta and the cerebral, extra-cranial carotid and coronary arteries[J]. Internal Medicine (Tokyo, Japan), 2013,52(5):523-527.
[5]JUNG J M, YOUNG KWON D, HAN C S, et al. Metabolic syndrome and early carotid atherosclerosis in the elderly[J]. Journal of Atherosclerosis and Thrombosis, 2014,21(5):435-444.
[6]ECKEL R, GRUNDY S, ZIMMET P. The metabolic syndrome[J]. The Lancet, 2005,366(9501):1923.
[7]NINOMIYA J K, LITALIEN G, CRIQUI M H, et al. Association of the metabolic syndrome with history of myocardial infarction and stroke in the Third National Health and Nutrition Examination Survey[J]. Circulation, 2004,109(1):42-46.
[8]BANG O Y, KIM J W, LEE J H, et al. Association of the metabolic syndrome with intracranial atherosclerotic stroke[J]. Neurology, 2005,65(2):296-298.
[9]LPEZ-CANCIO E, GALN A, DORADO L, et al. Biological signatures of asymptomatic extra- and intracranial atherosclerosis: the Barcelona-AsIA (Asymptomatic Intracranial Atherosclerosis) study[J]. Stroke, 2012,43(10):2712-2719.
[10]LPEZ-CANCIO E, DORADO L, MILLN M, et al. The Barcelona-Asymptomatic Intracranial Atherosclerosis (AsIA) study: prevalence and risk factors[J]. Atherosclerosis, 2012,221(1):221-225.
[11]WONG K S, NG P W, TANG A, et al. Prevalence of asymptomatic intracranial atherosclerosis in high-risk patients[J]. Neurology, 2007,68(23):2035-2038.
[12]PARK K Y, CHUNG C S, LEE K H, et al. Prevalence and risk factors of intracranial atherosclerosis in an asymptomatic Korean population[J]. Journal of Clinical Neurology (Seoul, Korea), 2006,2(1):29-33.
[13]中華医学会糖尿病学分会代谢综合征研究协作组. 中华医学会糖尿病学分会关于代谢综合征的建议[J]. 中国糖尿病杂志, 2004,12(3):156-161.
[14]GRANT E G, BENSON C B, MONETA G L, et al. Carotid artery Stenosis: gray-scale and Doppler US diagnosis: society of radiologists in ultrasound consensus conference[J]. Radiology, 2003,229(2):340-346.
[15]SAMUELS O B, JOSEPH G J, LYNN M J, et al. A stan-
dardized method for measuring intracranial arterial Stenosis[J]. AJNR American Journal of Neuroradiology, 2000,21(4):643-646.
[16]BANG O Y, SAVER J L, LIEBESKIND D S, et al. Impact of metabolic syndrome on distribution of cervicocephalic atherosclerosis: data from a diverse race-ethnic group[J]. Journal of the Neurological Sciences, 2009,284(1/2):40-45.
[17]SAKLAYEN M G. The global epidemic of the metabolic syndrome[J]. Current Hypertension Reports, 2018,20(2):12.
[18]崔敏. 颅内动脉粥样硬化危险因素的临床研究[D]. 重庆:第三军医大学, 2016.
[19]QURESHI A I, CAPLAN L R. Intracranial atherosclerosis[J]. Lancet, 2014,383(9921):984-998.
[20]WANG A X, LI Z X, LUO Y X, et al. Asymptomatic intracranial arterial Stenosis and metabolic syndrome: the APAC study[J]. PLoS One, 2014,9(12):e113205. doi:10.1371/journal.pone.0113205.
[21]ORMAZABAL V, NAIR S, ELFEKY O, et al. Association between insulin resistance and the development of cardiovascular disease[J]. Cardiovascular Diabetology, 2018,17(1):1-14.
[22]VERG S B. Pathophysiology of diabetic dyslipidaemia: where are we[J]? Diabetologia, 2015,58(5):886-899.
[23]BORNFELDT K E, TABAS I. Insulin resistance, hyperglycemia, and atherosclerosis[J]. Cell Metabolism, 2011,14(5):575-585.
[24]WHINCUP P H, GILG J A, DONALD A E, et al. Arterial distensibility in adolescents: the influence of adiposity, the metabolic syndrome, and classic risk factors[J]. Circulation, 2005,112(12):1789-1797.
[25]张艳玲,唐兴江,郭晓燕,等. 饮酒与首次缺血性卒中患者颅内外血管狭窄的相关性分析[J]. 四川医学, 2020(3):299-303.
[26]SPYRIDOPOULOS I, WISCHHUSEN J, RABENSTEIN B, et al. Alcohol enhances oxysterol-induced apoptosis in human endothelial cells by a calcium-dependent mechanism[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2001,21(3):439-44.
[27]ROBERTO M, PATEL RR, BAJO M. Ethanol and cytokines in the central nervous system[J]. Handbook of Experimental Pharmacology, 2018,248:397-431.
[28]刘欣,殷惠军. 雌激素与动脉粥样硬化[J]. 医学综述, 2012,18(8):1124-1127.
[29]GUPTE A A, POWNALL H J, HAMILTON D J. Estrogen: an emerging regulator of insulin action and mitochondrial function[J]. Journal of Diabetes Research, 2015,2015:916585.
[30]IGLSEDER B, CIP P, MALAIMARE L, et al. The metabolic syndrome is a stronger risk factor for early carotid atherosclerosis in women than in men[J]. Stroke, 2005,36(6):1212-1217.
[31]KLTING I, KOVCS P, VAN DEN BRANDT J. Sex-specific and sex-independent quantitative trait loci for facets of the metabolic syndrome in WOKW rats[J]. Biochemical and Biophysical Research Communications, 2001,284(1):150-156.
[32]WANG J C, BENNETT M. Aging and atherosclerosis: me-
chanisms, functional consequences, and potential therapeutics for cellular senescence[J]. Circulation Research, 2012,111(2):245-259.
[33]DARMIENTO F P, BIANCHI A, DE NIGRIS F, et al. Age-related effects on atherogenesis and scavenger enzymes of intracranial and extracranial arteries in men without classic risk factors for atherosclerosis[J]. Stroke, 2001,32(11):2472-2479.
(本文編辑 黄建乡)

