miR-494对骨肉瘤细胞增殖和侵袭的作用
张 雷,段广超,吴智辉
(商丘市第一人民医院脊柱外科,河南商丘 476100)
骨肉瘤(osteosarcoma,OS)是一种间质瘤,通常发生于儿童和年轻人[1-3]。发病原因较为复杂,受遗传、表观遗传和生物学因素的影响[4]。OS患者的生存率仅为 15%~30%[5]。MicroRNA (miRNA)是非编码的内源性RNA,在基因组中具有高度的保守性[6]。已有文献报道miRNA的失调会参与影响OS和OS衍生细胞的进程[7]。miRNA(miR)-494已在多种类型的肿瘤中进行了研究,包括非小细胞肺癌、肝癌、胆管癌、胃癌和胰腺癌[8,9]。但是,miR-494的调节作用在不同肿瘤类型中具有不同作用。miR-494的异位表达会诱导OS细胞中G1/S期的停滞[10]。而先前研究表明细胞周期蛋白依赖性激酶6(CDK6)在G1/S期中发挥重要作用[11],故本研究探讨了miR-494的表达情况对于OS的影响并进一步探究miR-494与CDK6在OS中的关联。
1 材料与方法
1.1 实验材料
人骨肉瘤细胞株MG-63、U2OS细胞株购自中国科学院(中国上海)细胞库典藏中心。杜尔伯科改良伊戈尔(DMEM)培养基、α-MEM、胰蛋白酶、胎牛血清等均购自四季青公司,基质胶购自美国Sigma公司,细胞计数试剂盒(CCK-8)购自日本同仁化学公司,Transwell小室购自美国Corning公司,CDK6等抗体购自Abcam公司。
1.2 miR-494转染
细胞分组:MG-63细胞所使用的培养液为含有10%胎牛血清及100 U/ml青链霉素的DMEM培养液,在细胞培养箱内进行培养(37℃,5% CO2)。将处于对数生长期生长的细胞使用胰酶进行消化处理,然后分别接种于2个6孔板中,然后根据说明书分别将miRNA模拟物及miRNA对照链转染于MG-63细胞中。
1.3 检测指标
1.3.1 RT-PCR检测
实时定量PCR检测miR-494的表达情况。于细胞转染12、18以及24 h后,提取对照组、转染组细胞的总RNA,采用锐博公司试剂盒检测miR-494的表达水平,平行重复3次。
1.3.2 CCK-8 检测[12]
瞬时转染24 h后,将MG-63细胞接种到96孔板中,设置空白对照组,每组设置4个重复组,继续培养24、48、72 h后采用CCK-8检测细胞增殖情况。检测步骤如下:首先去除培养基,然后每孔加入10μl的CCK-8试剂,继续培养2 h,然后震荡混匀后采用酶标仪检测吸光光度值(450 nm波长),比较各组细胞增殖速度。
1.3.3 Transwell检测[13]
在孔中加入100μl的培养基,孵育10 min,使聚碳酸酯膜亲水。转染24 h后,使用胰蛋白酶消化,采用无血清的细胞培养以及重悬细胞,孔中各加入100μl的细胞悬浮液,下室中每孔加入500μl的有血清的培养基。置于细胞培养箱中培养12 h。之后,用多聚甲醛固定15 min,然后弃掉甲醛,放置晾干后用0.1%结晶紫溶液染色15 min,使用纯净水冲洗数次,晾干。于显微镜下(×200)选取10个视野进行细胞计算。采用划痕实验检测细胞的迁移能力。将转染后的细胞重悬,在新的6孔板中进行增殖,等到细胞融合率达到75%左右时,使用枪头划横线。之后使用1XPBS清洗3次去除划下的细胞,加入无血清培养基继续培养。在划痕结束的0、12 h时进行拍照,采用Image J软件进行测量距离,计算细胞的12 h的迁移情况。
1.3.4 Western blot检测
首先提取细胞总蛋白,然后采用SDS-PAGE胶进行电泳,待条带分离明显,进行转膜实验,将蛋白胶电转至聚偏氟乙烯(PVDF)膜上。电压80 V,电转120 min后采用牛血清蛋白封闭1 h,过夜孵育一抗,之后使用TBST洗膜5次,之后孵育2抗1 h,再次TBST洗膜5次,然后使用化学发光法进行显影。曝光扫描条带,并采用Image J分析灰度值。进行3次独立重复实验。
1.4 统计学方法
采用SPSS 22.0统计学软件进行数据处理分析,计量资料以±s表示,两组间比较采用独立样本t检验,计数资料采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-494检测
miR-494的RT-PCR检测结果见表1,随时间推移,两组miR-494的表达均显著增加(P<0.05),转染后12、18以及24 h时,转染组的miR-494表达情况均高于对照组(P<0.05)。
2.2 细胞增殖CCK-8检测
CCK-8检测MG-63细胞增殖情况见表1,随时间推移,两组细胞增殖均显著增加(P<0.05),24、48以及72 h时,转染组细胞增殖水平均显著低于对照组(P<0.05)。
2.3 Transwell侵袭和迁移能力比较
侵袭和迁移能力Transwell检测结果见表1,图1。转染组在视野下的平均细胞数、细胞跨膜数量以及细胞迁移率均显著低于对照组(P<0.05)。在两种细胞株中,均表现为转染组的侵袭和迁移能力弱于对照组。
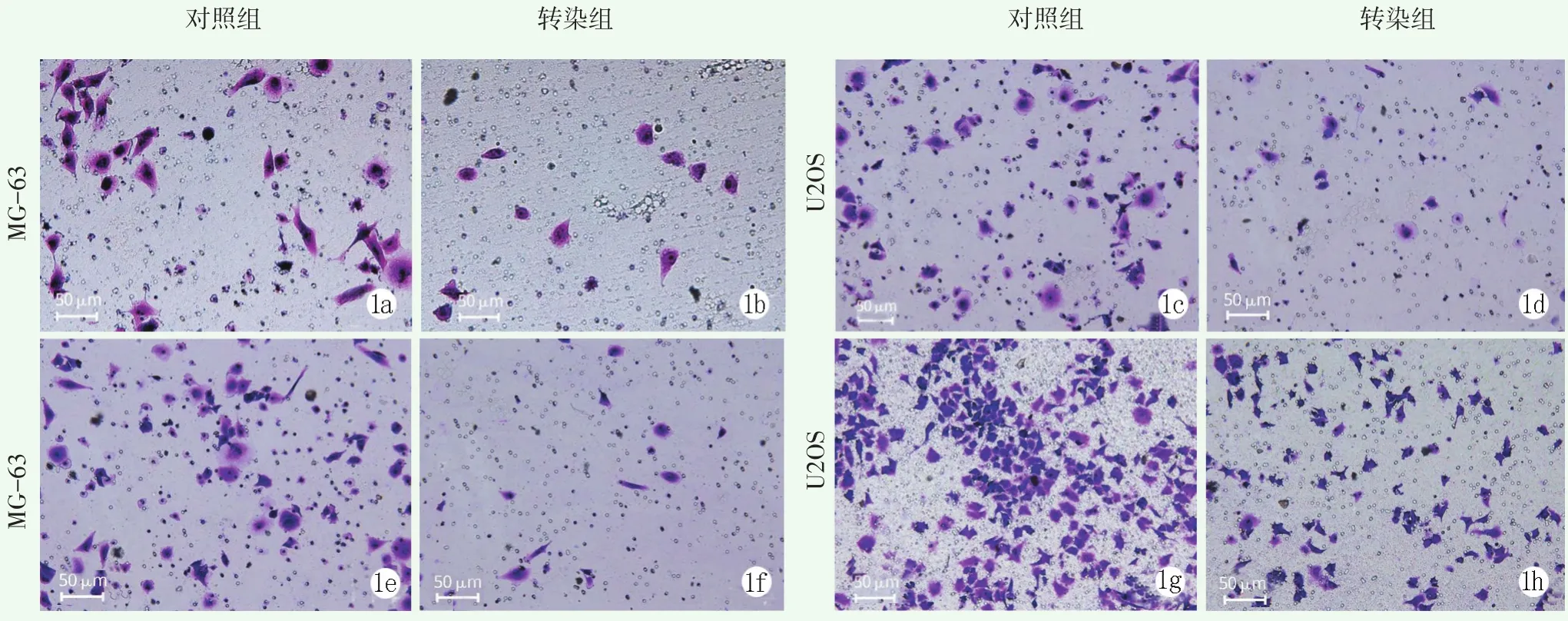
图1 miR-494抑制细胞的侵袭和迁移能力 1a~1d:侵袭实验中,显微镜下观察到MG-63细胞以及U2OS细胞的图像1e~1h:迁移实验中,显微镜下观察到MG-63细胞以及U2OS细胞的图像
2.4 miR-494调控CDK-6的表达情况
使用RT-PCR对CDK6的mRNA进行定量比较,使用Western blot方法对CDK6进行检测比较,发现在转染组中,CDK6的mRNA以及蛋白表达均低于对照组,详情见表1、图2。在两种细胞株中,CDK6的mRNA水平均低于对照组。
表1 两组细胞检测结果(±s)与比较

表1 两组细胞检测结果(±s)与比较
images/BZ_61_205_2061_889_2630.pngimages/BZ_61_889_2061_1173_2630.pngimages/BZ_61_1107_2061_1459_2630.pngimages/BZ_61_1459_2061_1913_2630.pngimages/BZ_61_1913_2061_2275_2630.pngimages/BZ_61_205_2693_889_2756.pngimages/BZ_61_889_2693_1107_2756.pngimages/BZ_61_1107_2693_1459_2756.pngimages/BZ_61_1459_2693_1913_2756.pngimages/BZ_61_1913_2693_2275_2756.pngimages/BZ_61_205_2819_889_2882.pngimages/BZ_61_889_2819_1107_2882.pngimages/BZ_61_1107_2819_1459_2882.pngimages/BZ_61_1459_2819_1913_2882.pngimages/BZ_61_1913_2819_2275_2882.png48.15±10.4490.29±14.02images/BZ_61_205_2944_889_3007.pngimages/BZ_61_889_2944_1107_3007.png<0.001images/BZ_61_1107_2944_1459_3007.pngimages/BZ_61_1459_2944_1913_3007.pngimages/BZ_61_1913_2944_2275_3007.pngimages/BZ_61_205_3070_889_3133.png细胞侵袭迁移能力检测细胞跨膜数(个)CDK-6 mRNA检测(相对值)U2OS mRNAimages/BZ_61_889_3070_1107_3133.pngimages/BZ_61_1107_3070_1459_3133.png0.28±0.06images/BZ_61_1459_3070_1913_3133.png1.11±0.21images/BZ_61_1913_3070_2275_3133.png<0.001

图2 CDK6表达情况 2a:CDK6在mRNA水平上表达情况 2b:Western blot检测CDK6在蛋白水平上表达情况
3 讨论
越来越多的证据表明,miR-494具有双重生物学功能:在某些特定肿瘤中高表达,又是某些肿瘤的抑癌药物[5]。据报道,miR-494在几种实体瘤中表达上调,包括肝细胞癌、急性粒细胞白血病、支气管癌变、视网膜母细胞瘤和结直肠癌[14]。通过靶向MCC及PTEN发挥致癌作用[15]。同时,miR-494在许多实体瘤中表达均下调,包括胰腺癌、前列腺癌、非小细胞肺癌、乳腺癌、卵巢癌和胆管癌[16],并通过靶向IGF1R,Sirt1,C-myc,CXCR4及Bim等发挥肿瘤抑制作用[17]。然而,miR-494在骨肉瘤细胞中的生物学作用及其潜在机制仍不清楚。本研究采用两种常用的骨肉瘤细胞进行研究,结果表明过表达miR-494能够抑制骨肉瘤细胞的增殖。为了进一步探讨miR-494对于骨肉瘤细胞侵袭能力的影响,本研究进行Transwell实验以及划痕实验,在两种骨肉瘤细胞中,转染组的侵袭能力明显低于对照组,这表明过表达miR-494能够抑制骨肉瘤细胞的侵袭和迁移能力,能够抑制骨肉瘤的侵袭扩散。
众所周知,miRNA通过抑制其靶基因发挥生物学活性。CDK6在细胞周期进程中至关重要,并且抑制CDK6将导致肿瘤细胞的增殖不受控制[18]。CDK6在几种类型的癌症中发现与疾病的进展具有相关性,包括胶质母细胞瘤和淋巴样恶性肿瘤[19]。CDK6在OS组织中明显上调,在不同恶性组织中进行了进一步研究表明[20],CDK6的表达与肿瘤表型(转移和无转移)具有相关性,在转移性肿瘤中CDK6的表达升高。本研究中,过表达miR-494的骨肉瘤细胞的CDK6的表达降低,这可能提示miR-494与CDK6的表达存在相关性,进一步分析,miR-494可能靶向调节CDK6的表达,当miR-494过表达时,抑制了CDK6的表达水平。miR-494在OS中的作用可能由CDK6介导发挥作用。但是,确切的调控机理目前尚不清楚。
本研究确定了miR-494是OS细胞中的一种肿瘤抑制物miRNA,miR-494能够抑制骨肉瘤细胞的增殖能力和侵袭、迁移能力,其机制与调控靶基因CDK6有关,具体调控机理仍需进一步研究探索。

