甘草次酸药物代谢动力学评价及其抗肝细胞癌机制研究
于天怡,朱晓芹,刘志强,王博龙
甘草次酸药物代谢动力学评价及其抗肝细胞癌机制研究
于天怡1,朱晓芹1,刘志强2,*王博龙1
(1.宜春春学院化学与生物工程学院,江西,宜春 336000 2.鹤壁职业技术学院,河南,鹤壁 458000)
利用药物信息学技术研究甘草次酸的药物代谢动力学参数及抗肝细胞癌机制。在SwissADME服务器分析甘草次酸的药动学参数,运用TCMSP、Swiss TargetPrediction、PharmMapper、GeneCards、CTD数据库和STRING数据平台预测和筛选甘草次酸抗肝细胞癌靶点,并构建靶蛋白互作网络,运用OmicShare及DAVID v 6.8平台对靶点进行GO功能富集分析和KEGG通路分析。运用AutoDuck Vina软件对甘草次酸与核心靶点进行分子对接,分析二者间的亲和力。实验结果显示:甘草次酸符合类药五原则,具有较好的胃肠吸收性。甘草次酸主要作用于HSP90AA1、CTNNB1、SRC、TNF 4个核心靶点,与TNF的亲和力最大;参与细胞增殖、活性氧、类固醇激素、氧化应激等生物过程;重点调控VEGF信号通路、TNF信号通路、癌症通路和癌症蛋白聚糖,能够遏制细胞增殖、侵袭转移,以及抗炎、抗血管生成。因此甘草次酸成药性好,具有多靶点-多通路-多机制抗肝细胞癌活性,可作为潜在的抗肝细胞癌药物进一步研究。
甘草次酸;肝细胞癌;药动学;信号通路;靶点
原发性肝癌是严重威胁人类健康的消化道恶性肿瘤之一,而肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌中最常见的一种组织学类型,占原发性肝癌的85%~90%以上[1]。早期HCC以外科手术治疗为主,但由于HCC起病隐匿、进展快,临床上大多数HCC患者就诊时已处于晚期,无法从手术获益,死亡率与发病率之比达到0.9:1,在我国5年生存率仅为12.1%[2-3]。索拉非尼是目前唯一被美国FDA批准的晚期HCC靶向治疗药物,但临床数据表明该药物只能延长患者平均2~3个月的生存期[4]。因此,有必要继续探寻抗肝细胞癌药物。
甘草次酸(glycyrrhetinic acid,GA)是甘草中甘草酸的五环三萜烯类水解产物,有顺式(18α)和反式(18β)2种构型,但由于自然界中18α异构体仅占GA天然总量的3%左右,故GA及其衍生物的开发研究仍以18β异构体为主[5]。近年研究表明GA,尤其是18β-GA对乳腺癌、卵巢癌、肝癌等多种肿瘤具有抑制增殖及抗转移作用,但具体机制不甚明确[6]。本研究借助多种数据库,挖掘GA药动学参数及其抗HCC靶点,进行GO(Gene ontology)功能分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,筛选核心靶点与GA进行分子对接,以期全面解析GA抗HCC的分子机制。
1 材料与方法
1.1 数据库与软件
(1)药物代谢动力学评价,SwissADME[7](http://www.swissadme.ch/)。(2)PubChem网站(https://pubchem.ncbi.nlm.nih.gov/)。(3)活性成分靶点数据库:中药系统药理学数据库与分析平台,TCMSP(http://ibts. hkbu. edu. hk/ LSP/ tcmsp. Php);Swiss TargetPrediction(Http://www.swisstargetprediction.ch/);反向分子对接服务器,Pharm Mapper(http://www.lilab-ecust.cn/pharmmapper/)。(4)蛋白质数据库,UniProt(https://www.uniprot.org/);PDB(http://www.rcsb.org/)。(5)疾病靶点数据库:GeneCards(https://www.genecards.org/);毒性与基因比较数据库CTD(http://ctdbase.org/)。(6)蛋白质相互作用分析平台,STRING https://string-db.org/)。(7)生信在线分析平台:OmicShare云平台(http://omicshare.com/);人类基因组注释数据库,DAVID 6.8(https://david.ncifcrf.gov/)。(8)网络分析及作图软件:Cytoscape 3.6.1;Venny 2.1.0(https://bioinfogpcnb. csic. es / tools / venny / index.html);ChemBioOffice 2014。(9)分子对接相关软件:分子三维结构处理软件PyMOL;AutoDuck Vina[8]及AutoDuck Tools。
1.2 GA药物代谢动力学评价
将GA的2D化学结构导入至SwissADME服务,得到其SMILES代码,点击“Run”分析GA的药代动力学参数,探讨GA成药的可能性及其胃肠吸收等药动学参数。
1.3 GA抗HCC靶点网络构建
在PubChem网站搜索关键词“glycyrrhetinic acid”,打开相应的条目,下载其3D化合物结构,运用ChemBioOffice 2014软件对3D化合物结构进行 MM2 能量最小化,保存成 mol2 格式,并将其导入Pharm Mapper服务器,采用药效团匹配法,进行潜在靶点的预测分析,按照“Norm Fit”打分从高到低依次选前100个人类靶蛋白。再分别在TCMSP数据库、Swiss Target Prediction平台检索GA的靶蛋白和靶基因,运用UniProt数据库将上述靶蛋白统一为基因的形式,合并以上三个来源的靶基因作为GA靶基因。分别在GeneCards、CTD数据库中检索HCC相关靶基因,根据相关度分值从高到低各筛前1000个,将以上两个数据库获取的HCC靶基因与GA靶基因输入Venny 2.1.0软件,取三者交集作为GA抗HCC的靶点,将上述靶点及GA导入 Cytoscape 3.6.1 软件构建GA-抗HCC靶点网络图。
1.4 GA抗HCC靶蛋白相互作用网络构建
将GA抗HCC靶点导入STRING平台构建蛋白互作网络(protein-protein interaction,PPI),设置蛋白种类为“Homo sapiens”,自定义相互作用阈值“confidence=0.97”,其他参数保持默认值。将 PPI 网络导入Cytoscape 3.6.1软件,利用“Network Analysis”功能计算各网络节点的度值(Degree)、介数(Betweenness)及最短路径(Closeness)等拓扑参数,节点的Degree、Betweenness、Closeness越大,该节点在网络中的位置就越重要。选取网络中三个拓扑参数均较大的靶点作为GA抗HCC的核心靶点。
1.5 GA抗HCC靶点的GO功能富集分析和KEGG通路分析
将GA抗HCC靶点输入OmicShare和DAVID 6.8平台,分别进行GO功能富集分析与KEGG通路富集分析,依据P-value<0.001和P-value<0.01筛选GA抗HCC靶点富集的生物功能及信号通路。
1.6 GA抗HCC核心靶点的分子对接
在PDB数据库搜索GA抗HCC 核心靶点的蛋白晶体复合物,借助PyMOL将核心靶蛋白与原配体分离,同时去除核心靶蛋白的水分子、磷酸根及多余的非活性配体。将核心靶蛋白导入AutoDuck Tools进行加氢、加电荷等操作。将GA的2D化合物结构导入ChemBio3D后,进行 MM2 能量最小化优化,以mol2的格式保存,将核心靶蛋白、原配体、GA 3D结构统一设置成AutoDuck Tools可识别的pdbqt格式。设置原配体所在位点为活性口袋,进行核心靶蛋白和GA的分子对接,对比分析原配体、GA与各核心靶蛋白的亲和力。
2 结果
2.1 GA的类药性及药物代谢动力学评价
图1是GA的生物利用度雷达图,综合考量了GA的亲脂性、大小、极性、溶解度、饱和度及灵活性六个理化特性[7],粉红色区域代表每个特性的最佳范围,除亲脂性、溶解度稍差外,其余特性均较为理想,具体参数详见表1,由此可见 GA符合Lipinski的类药五原则,具有较好的成药性及较高的胃肠吸收性。

图1 生物利用度雷达图
表1 GA的类药性及药动学评价
Table1 The drug-like properties and evaluation of pharmacokinetics of GA
参数GA标准值 分子量(MW)470.68 g/mol<500 g/mol 氢键给体数量(OH+NH)2<5 氢键受体数量(O+N)4<10 脂水分配系数的对数值(MlgP)4.87-2<MlgP<5 可旋转键的数量1≤ 10 血脑屏障否无 胃肠吸收高无 极性(TPSA)TPSA=74.60Å220Å2≤TPSA≤130Å2 亲脂性(XLOGP3)5.49−0.7≤XLOGP3≤+5.0
2.2 GA抗HCC靶点及其网络构建
从TCMSP、Swiss TargetPrediction及PharmMapper 得到GA靶点187个,从GeneCards、CTD 得到HCC靶点各1000个,取得三者交集后得到GA抗HCC靶点54个(图2),将54个靶点导入Cytoscape 3.6.1 软件构建GA-抗HCC靶点网络图(图3)。
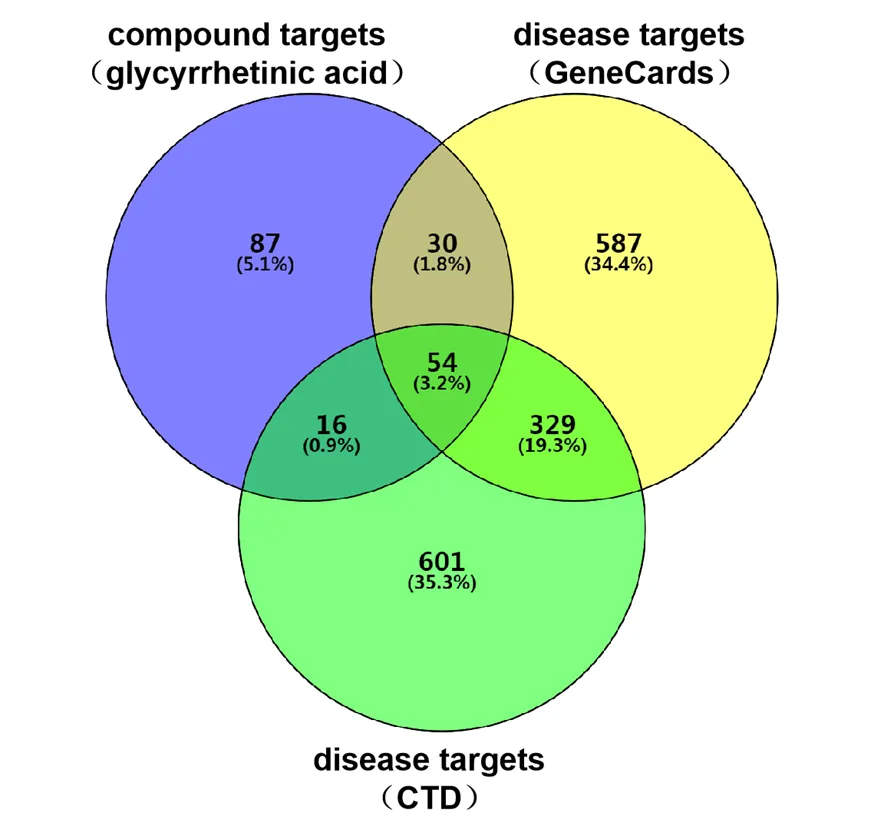
图2 GA-抗HCC靶点韦恩图
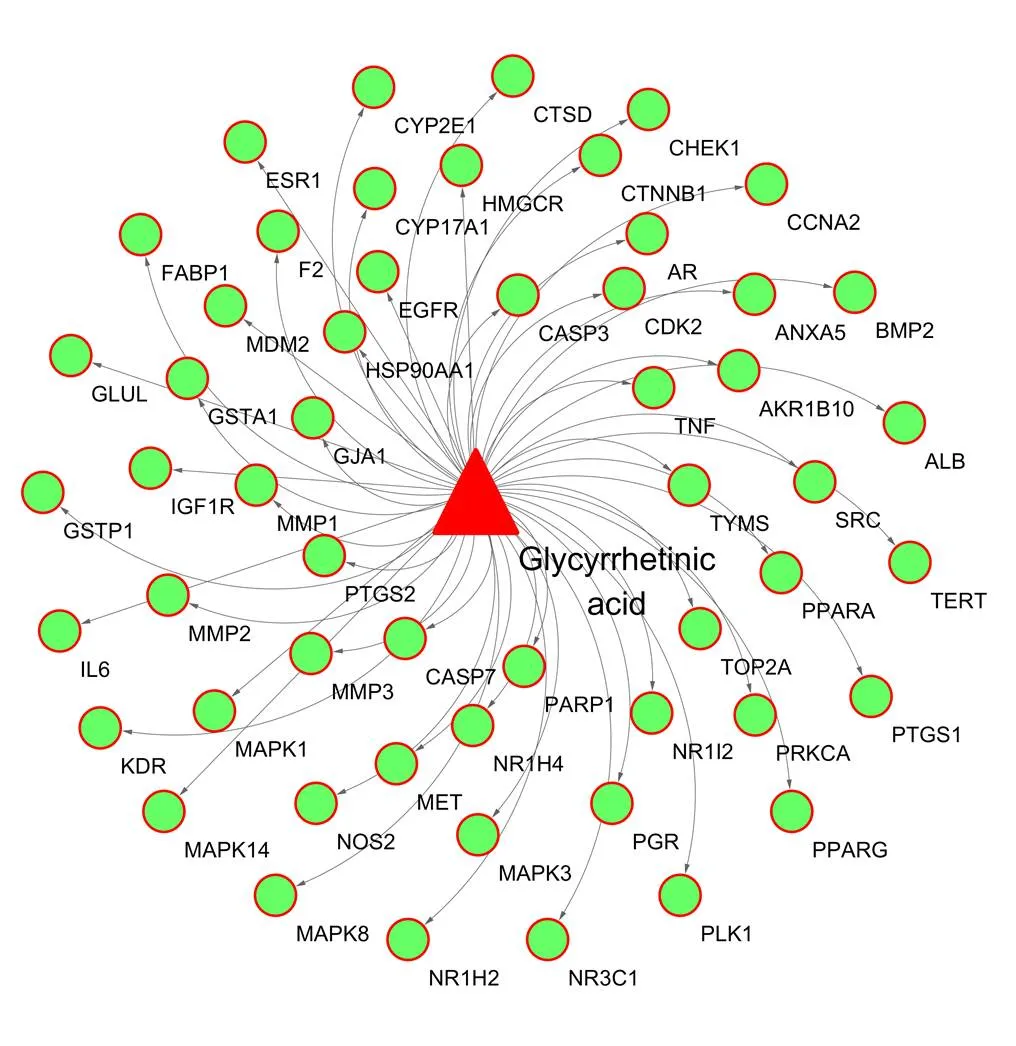
三角形表示GA,圆圈表示HCC靶点
2.3 抗HCC靶蛋白PPI网络
如图4所示,每个参与互作的蛋白节点用一个圆圈表示,圆圈面积越大表示其度值越大,相互作用连线越粗代表其介数越大,圆圈周线越粗代表其最短路径越大。PPI网络中共有30个节点,40条相互作用连线,平均Degree为2.67,平均Betweenness为9.96×10-2,平均Closeness为4.53×10-1,节点的Degree、Betweenness、Closeness三个拓扑参数同时在网络中较大有4个核心靶点分别是HSP90AA1、CTNNB1、SRC、TNF,详细结果见表2。

图4 靶蛋白PPI网络
表2 核心靶点及其拓扑参数
Table2 Core targets and their topological parameters
TargetTarget proteinDegreeBetweennessCloseness HSP90AA1Heat shock protein HSP 90α10 3.34×10-14.69×10-1 CTNNB1 β-catenin7 3.20×10-14.42×10-1 SRCProto-oncogene tyrosine-protein kinase Src7 2.65×10-14.89×10-1 TNFTumor necrosis factor4 1.69×10-13.65×10-1
2.4 GA抗HCC靶点的GO功能富集分析
依据P-value<0.001,选出GO条目262个,其中生物过程(Biology Process)223个,分子功能(Molecular Function)24个,及细胞组成(Cellular Componet)15个。如图5示,生物过程主要涉及刺激反应、生物过程调节、细胞代谢、细胞增殖等;分子功能及细胞组成主要涉及催化活性、细胞器、细胞膜、蛋白质复合物等。进一步富集发现GO条目主要聚集在对化学刺激、活性氧、类固醇激素、氧化应激、脂质的反应及细胞死亡等方面(图6)。

图6 GA抗HCC靶点的GO富集
2.5 GA抗HCC靶点的KEGG通路分析
依据P-value<0.01,筛得相关通路18条(表3)。图7为通路富集气泡图,富集因子(Rich factor)是GA富集在通路下的靶点与该通路所有蛋白的比值,比值越大表示富集度越大。P-value取值范围[0,1],颜色越红表示P- value越小,富集越明显。点的大小表示GA富集在通路下的靶点个数,点越大表示富集靶点越多。由图7可知,富集因子最大的是VEGF信号通路及TNF信号通路,富集靶点最多的通路是癌症通路及癌症蛋白聚糖。
表3 KEGG信号通路信息
Table 3 KEGG signal pathway information
KEGG通路中文名称Count%P-Value Pathways in cancer癌症通路2138.90 5.20×10-13 Proteoglycans in cancer癌症蛋白聚糖1527.80 5.40×10-11 TNF signaling pathwayTNF信号通路1018.50 4.60×10-8 FoxO signaling pathwayFoxO信号通路1018.50 3.30×10-7 Hepatitis B乙型肝炎1018.50 6.40×10-7 VEGF signaling pathwayVEGF信号通路713.00 3.90×10-6 HIF-1 signaling pathwayHIF-1信号通路713.00 5.40×10-5 Estrogen signaling pathway雌激素信号通路713.00 6.50×10-5 PI3K-Akt signaling pathwayPI3K-Akt信号通路1120.40 1.30×10-4 Thyroid hormone signaling pathway甲状腺激素信号通路713.001.50×10-4 Hepatitis C丙型肝炎713.00 3.30×10-4 ErbB signaling pathwayErbB信号通路611.10 3.50×10-4 Toll-like receptor signaling pathwayToll样受体信号通路611.10 8.80×10-4 Ras signaling pathwayRas信号通路814.80 1.00×10-3 MAPK signaling pathwayMAPK信号通路814.80 1.90×10-3 Choline metabolism in cancer癌症中的胆碱代谢59.30 5.60×10-3 Transcriptional misregulation in cancer癌症中的转录失调611.10 6.40×10-3 mTOR signaling pathwaymTOR信号通路47.40 8.00×10-3
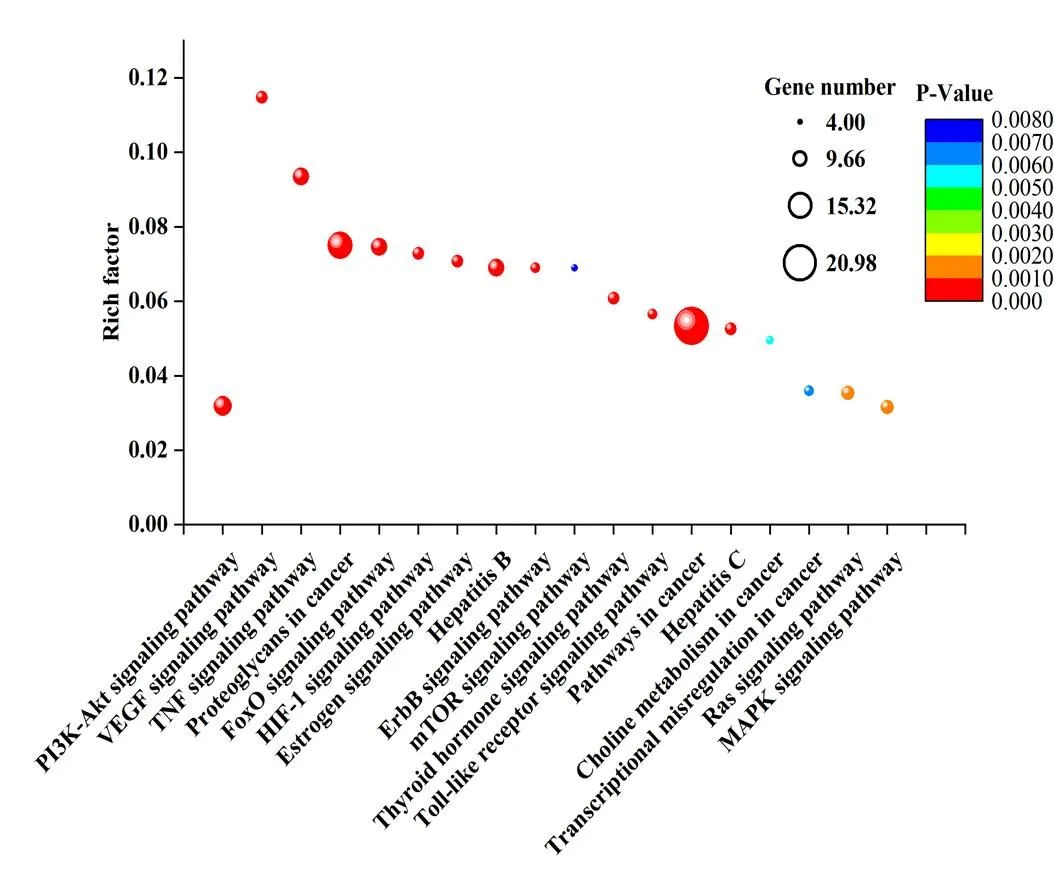
图7 GA抗HCC靶点的通路富集
2.6 GA抗HCC的核心靶点分子对接
由表4可知,GA与4个核心靶蛋白的结合能均<-5 kcal/mol,其中与肿瘤坏死因子(图8)结合能最低(亲和力最大),-9.2 kcal/mol的结合能与原配体(-9.1 kcal/mol)基本相等。表5是GA及原配体与核心靶蛋白TNF对接的氨基酸残基,其中GA对应的氨基酸残基除LYS-11、ILE-58不同外,其余的均可在原配体的氨基酸残基中找到。由于原配体是TNF的抑制剂[9],说明GA也可能通过抑制TNF发挥抗HCC的作用。
表4 4个核心靶点分子对接结果
Table 4 Molecular docking of 4 core targets
核心靶点PDB ID原配体活性位点三维坐标原配体结合能(kcal/mol)GA结合能(kcal/mol) TNF2AZ5307x=-9.181;y=67.363;z=20.045-9.1 -9.2 SRC4K110J9x=19.619;y=23.114;z=57.067-10.5 -8.7 HSP90AA13OW6MEXx=-2.055;y=-10.073;z=-3.403-7.3 -6.6 CTNNB16M92J8Vx=-1.528;y=38.813; z=-14.451-7.0 -5.7
表5 靶蛋白TNF氨基酸残基
Table 5 amino acid residues of target protein TNF
靶蛋白全称GA作用的氨基酸残基原配体(307)作用的氨基酸残基 Tumor necrosis factorTYR-59,TYR-151,TYR-119,SER-60,LYS-11,LEU-57,LEU-55,LEU-157,LEU-120,ILE-58,ILE-155,LY-122,GLY-121,GLN-61VAL-91,VAL-123,VAL-123,TYR-59,TYR-151,TYR-119,SER-95,SER-60,SER-133,LYS-90,LEU-94,LEU-93,LEU-57,LEU-55,LEU-157,LEU-132,LEU-120,ILE-58,ILE-155,HIS-78,GLY-122,GLY-121,GLU-135,GLN-61,ASN-92,ARG-82,ARG-131,ALA-134
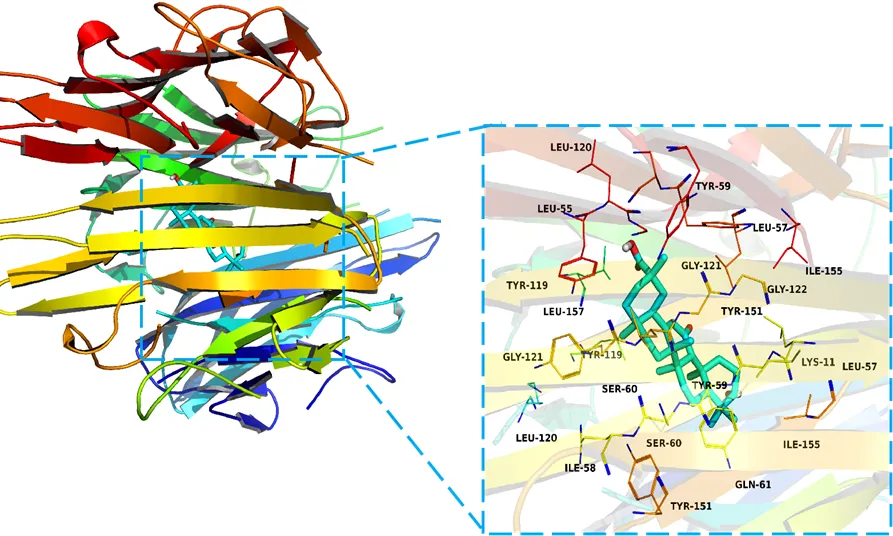
图8 肿瘤坏死因子的分子对接模型
3 讨论
化学药物治疗仍是HCC治疗的常用方法,大部分化疗药物为非选择性,在杀伤患者癌细胞的同时也会产生毒副作用,造成患者化疗不耐受[10-11]。因此,提高药物选择性递送,即肝靶向给药是HCC治疗重点之一。由于肝细胞表面天然存在大量GA受体,能够使GA与肝细胞特异性结合,从而呈现出良好的肝靶向性,加之GA本身的抗癌活性,故使其具有肝靶向性和抗HCC的双重优势[12]。本研究通过SwissADME服务器分析GA成药性及部分药动学参数,发现其符合Lipinski的类药五原则,成药性及胃肠吸收性均较好,具有成为口服抗HCC药物的潜质。
检索多个化合物靶点数据库、疾病靶点数据库,挖掘出54个GA抗HCC的靶点。借助蛋白互作筛出HSP90AA1、CTNNB1、SRC和TNF 4个核心靶点,对这四个核心靶点进行分子对接,发现4个核心靶蛋白与GA的结合能均较低,表明上述四个核心靶点与GA亲和力较大,可能是GA抗HCC的关键所在。研究显示恶性肿瘤的发生发展与炎症反应有关,而肝癌的病理起源与肝细胞持续存在的HBV病毒等感染并诱发慢性炎症密切相关[13]。夏丽敏等[14]发现TNF-α可以激活转录因子FoxM1(Forkhead box M1,FoxM1),上调FoxM1表达,从而促进HCC细胞增殖。雷一鸣等[15]亦发现TNF-α通过内质网应激信号通路诱导肝癌细胞自噬,从而促进肝癌细胞增殖。分子对接显示GA能够很好地结合在TNF抑制剂位点上,说明其很可能通过抑制TNF而发挥抗HCC细胞增殖等作用。HSP90α是HSP90AA1基因编码的分子伴侣,不仅位于细胞内,也可分泌至细胞外甚或存在细胞表面,与肿瘤侵袭性及转移性密切相关[16-17]。其在不同转移潜能人肝癌细胞株及HBV相关性肝细胞癌患者血清中高表达,有可能成为肝癌治疗以及侵袭转移、预后评估的新靶点和新指征[18]。β-catenin(CTNNB1)是介导细胞黏附及信号转导的多功能蛋白,闪海霞等研究发现β-catenin在HCC细胞的胞浆和细胞核内聚集高表达[19],其异常表达与HCC是否合并肝硬化、肿瘤大小、术后复发、转移等具有密切联系。而吴晓玲等[20]发现18β-GA能增强Wnt /β-catenin 信号通路的β-catenin/TCF活性,上调周期蛋白CyclinD1及促凋亡蛋白Bax的表达,下调抗凋亡蛋白Mcl-1、Bcl-2及坏死蛋白RIP3的表达,同时增强Caspase-3活性,从而诱导细胞凋亡。
KEGG通路富集发现,GA抗HCC的主要通路有癌症通路、FoxO信号通路、HIF-1信号通路、VEGF信号通路、TNF信号通路等,其中VEGF信号通路富集度最大。VEGF信号通路是调控肿瘤血管生成的关键通路,当HCC迅速生长时,需要大量的氧气和营养物质供应,此时肿瘤血管生成不能满足HCC生长需要,从而形成缺氧微环境[21]。而缺氧微环境能增强缺氧诱导因子(hypoxia inducible factor-1, HIF-1)表达,其同分异构体HIF-1α和HIF-1β二聚化后形成转录因子结合到VEGF基因,诱导VEGF转录和翻译,活化的VEGF结合到VEGFR-1和VEGFR-2,激活多条信号转导通路,促使细胞增殖、迁移,以及形成新生血管[22-23],下调VEGF表达,明显抑制HCC细胞的增殖[24],说明VEGF信号通路抑制剂可以治疗HCC,目前临床广泛应用的晚期肝癌靶向药物索拉非尼也正是基于阻断VEGFR而发挥作用[25]。旷鹏昊[26]通过建立小鼠原位肝癌模型发现GA能够减少血管生成,结合本研究的GA靶点富集结果,可以推测GA很可能主要阻断VEGF信号通路,兼顾HIF-1信号通路调节,从而抑制血管生成,发挥抗HCC效应。
总之,本研究借助药动学评价及生物信息学相关技术与方法,系统研究了GA成药性以及抗HCC的靶点、生物过程和信号通路,全面揭示了GA多靶点、多通路、多机制抗HCC的药理机制。
[1] 李民,熊俊.《原发性肝癌诊疗规范(2017年版)》解读[J]. 中国普通外科杂志, 2019, 28(7): 785-789.
[2] 许智婷,丁红. 肝细胞癌(HCC)靶向治疗的研究进展[J]. 复旦学报:医学版, 2019, 46(2): 276-280.
[3] 刘琳, 秦叔逵. 分子靶向药物与免疫检查点抑制剂治疗晚期肝细胞癌的研究现状与进展[J]. 临床肿瘤学杂志, 2019, 24(09): 839-849.
[4] 冯韵. 条件性敲除β-catenin在肝癌发生中的作用及机制研究[D]. 上海:第二军医大学, 2017.
[5] 康蕾,李学强,王凤荣. 18β-甘草次酸结构修饰及生物活性研究进展[J]. 中草药, 2012, 43(7): 1430-1442.
[6] Hung C F, Hsiao C Y, Hsieh W H, et al. 18β-glycyrrhetinic acid derivative promotes proliferation, Migration and aquaporin-3 expression in human dermal fibroblasts[J]. PLoS One, 2017, 12(8): 182981-182994.
[7] Daina A, Michielin O, Zoete V. SwissADME: free web tool to evaluate pharmacokinetics, drug-likeness and Medicinal hemistry friendliness of small molecules[J]. Sci ep, 2017, 7: 42717-42729.
[8] Trott O, Olson AJ. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. J Comput Chem, 2010, 31(2): 455-461.
[9] He M M, Smith A S, Oslob JD, et al. Small-molecule nhibition of TNF-alpha[J]. Science, 2005, 310(5750): 1022-1025.
[10] 邱晓,李学涛,居瑞军,等. 中药“扶正固本”与化疗药联合抗肿瘤的研究进展[J]. 世界中西医结合杂志, 2018,13(11): 1615-1619.
[11] 丁小兵,李玉梅,刘大全,等. FOLFOX方案在结直肠癌术后化疗中的应用[J]. 井冈山大学学报:自然科学版, 2010, 31(2): 78-80.
[12] 梁劲康,吴志玲,吴广辉,等. 甘草次酸的抗肝癌作用机制及其作为肝靶向配体的研究进展[J]. 中国药房, 2017, 28(22): 3150-3154.
[13] 李萍,王杰军.炎症与肿瘤转移的研究进展[J]. 第二军医大学学报, 2011, 32(1): 84-87.
[14] 夏丽敏,莫萍,黄文杰,等. TNF-α/ROS/HIF-1诱导FoxM1过表达促进肝细胞癌增殖以及增强抵抗凋亡[J]. 医学争鸣, 2013, 4(1): 34-34.
[15] 雷一鸣,杨逸冬,谭嗣伟,等. TNF-α通过内质网应激信号通路诱导肝癌细胞自噬并促进增殖的研究[J].新医学, 2017, 48(11): 770-774.
[16] 李卫华,陈广原,余湘文,等. 乙型肝炎病毒X蛋白对人肝癌细胞hsp90α基因表达调控机制研究[J]. 中华肿瘤防治杂志, 2013, 20 (20): 1574-1579.
[17] Tsukao Y, Yamasaki M, Miyazaki Y, et al. Overexpression of heat-shock factor 1 is associated with a poor prognosis in esophageal squamous cell carcinoma [J]. Oncol Lett, 2017, 13(3): 1819-1825.
[18] 管志斌,孙溟霞,宋继福,等. 热休克蛋白90α在不同转移潜能人肝癌细胞株及HBV相关性肝细胞癌患者血清中表达水平的临床研究[J]. 癌症进展, 2017, 15(11): 1266-1268,1285.
[19] 闪海霞,朱幼芙,范崇桂,等. Wnt信号通路对肝细胞肝癌的影响[J]. 广东医学, 2016, 37(4): 572-574.
[20] 吴晓玲,庄佩佩,郝嘉楠,等. 18β- 甘草次酸通过Wnt/β -catenin信号通路对U937细胞凋亡的调控机制研究[J]. 中国药学杂志, 2014, 49(19): 1710-1715.
[21] 陈椿,杨哲,黄赞松.细胞信号转导通路与肝癌相关性研究进展[J]. 世界华人消化杂志, 2019, 27(21): 1330-1338.
[22] 陈杰,侯恩存. VEGF及其受体与肝细胞癌血管生成和抗血管治疗研究进展[J]. 现代肿瘤医学, 2016, 24(3): 498-502.
[23] 任勇军,杨林,翟昭华. VEGF在原发性肝癌介入治疗中的价值[J]. 世界华人消化杂志, 2010, 18(15):1582-1587.
[24] Pan Z, Zhuang J, Ji C, et al. Curcumin inhibits hepatocellular carcinoma growth by targeting VEGF expression[J]. Oncol Lett, 2018, 15(4): 4821-4826.
[25] 欧阳洪贵,李玉艳.美国FDA近10年抗肿瘤药物[J]. 中国新药杂志, 2012, 21(24): 2885-2894.
[26] 旷鹏昊. 18β-甘草次酸逆转肝星状细胞的免疫抑制特性从而阻止肝癌的发生发展[D]. 厦门:厦门大学, 2012.
EVALUATION OF PHARMACOKINETICS AND MECHANISM OF ANTI-HEPATOCELLULAR CARCINOMA OF GLYCYRRHETINIC ACID
YU Tian-yi1, ZHU Xiao-qin1, LIU Zhi-qiang2,*WANG Bo-long1
(1. School of Chemical and Biological Engineering, Yichun University, Yichun, Jiangxi, 336000, China;2. Hebi Vocational and Technical College, Hebi, Henan, 458000, China)
To study the pharmacokinetic parameters and its mechanism of anti-hepatocellular carcinoma of glycyrrhetinic acid by using drug information technology. SwissADME server was used to analyze the pharmacokinetic parameters of glycyrrhetinic acid. TCMSP, Swiss TargetPrediction, PharmMapper, GeneCards, CTD databases and STRING platform predicted and screened the targets of glycyrrhetinic acid-anti-hepatocellular carcinoma and constructed protein-protein interaction network. OmicShare and DAVID v 6.8 platforms were used for GO functional enrichment analysis and KEGG pathway analysis. AutoDuck Vina software was used for molecular docking to analyze the affinity between glycyrrhetinic acid and the core targets. Glycyrrhetinic acid conforms to the five principles of pharmacoids and has good gastrointestinal absorption. Glycyrrhetinic acid mainly acts on four core targets of HSP90AA1, CTNNB1, SRC and TNF, has the highest affinity with TNF; it takes part in cell proliferation, reactive oxygen species, steroid hormones, oxidative stress and other biological processes, mainly regulates VEGF and TNF signaling pathways, cancer pathways and proteoglycans, which can inhibit cell proliferation, invasion and metastasis, as well as anti-inflammatory and anti-angiogenesis. Glycyrrhetinic acid is an ideal drug with multi-target- multi-pathway-multi-mechanism activities against hepatocellular carcinoma, which can be further studied as a potential anti-hepatocellular carcinoma drug.
glycyrrhetinic acid; hepatocellular carcinoma; pharmacokinetic; signal pathway; target
R285.5
A
10.3669/j.issn.1674-8085.2021.05.007
1674-8085(2021)05-0028-07
2021-02-21;
2021-06-17
江西省教育厅科技计划项目(GJJ12596)
于天怡(1997-),女,内蒙古赤峰人,硕士生,主要从事药理、药物化学和临床药学研究(E-mail:1203971081@qq.com);
朱晓芹(1993-),女,四川筠连人,硕士生,主要从事药理、药物化学和临床药学研究(E-mail:1468448165@qq.com);
刘志强(1993-),男,河南鹤壁人,助教,主要从事药物化学、天然产物研究与开发(e-mail:626814166@qq.com);
*王博龙(1977-),男,陕西扶风人,副教授,博士,硕士生导师,主要从事药物化学临床前药理研究及临床有效性与安全性评价的研究(E-mail:wblong77@126.com).

