鳕鱼鳔胶原肽对H2O2诱导2BS细胞早期衰老的保护作用
李 娜,马玉洁,刘 楠,王珊珊,周德庆
(中国水产科学研究院黄海水产研究所 山东青岛 266071)
鱼鳔,又名花胶或鱼肚,以其胶原蛋白含量极高而著称,自古以来因各种功效显著而受到颇多消费者的喜爱[1-2]。相关研究报道,通过酶解鱼鳔制备的多肽具有较高的抗氧化活性[3-4]。对氧化与衰老的关系,有研究表明,提高机体抗氧化能力是延缓衰老的最佳途径之一[5]。与传统抗氧化剂相比,来自海洋生物的新型肽,因具有高抗氧化活性,更好的生物相容性和更低的毒性而受到越来越多的关注[6-7]。对多肽与延缓机体衰老的关系探讨成为近年的研究热点。
生物体的衰老发生在机体的每一个层面,包括从细胞、组织到器官。细胞是生命的基本组成单位,细胞衰老被认为是人类衰老的基础。细胞衰老分为早期衰老与复制性衰老两种。复制性衰老即细胞复制过程中会产生端粒缩短的现象,最终导致细胞分裂能力减弱。早期衰老是当细胞遭受外界干扰发生永久不可逆的增殖停滞现象。在衰老相关模型的研究中,人胚肺二倍体成纤维细胞往往被选为模式细胞种类,而且通过H2O2诱导细胞建立早期衰老细胞模型更易于体外模拟衰老进程的研究[8-9]。本研究通过建立H2O2诱导的2BS 细胞早期衰老细胞模型,检测细胞的增殖率、细胞凋亡情况与β-半乳糖苷酶含量等衰老相关指标,探讨鳕鱼鳔胶原肽对早熟性细胞衰老进程的影响。同时检测ROS 活性氧水平与抗氧化酶含量等,探讨其可能通过对抗氧化系统的保护作用实现对细胞早期衰老进程的干预作用。
1 材料与方法
1.1 材料与仪器
鳕鱼鳔(冻鲜品),平均质量10.44 g/只,由青岛海洋兄弟食品有限公司提供。人胚胎肺二倍体成纤维细胞(2BS 细胞),江苏凯基生物科技股份有限公司。
复合蛋白酶、ROS 活性氧试剂盒、Hoechst 染色试剂盒、β-半乳糖苷酶试剂盒,北京索莱宝科技有限公司;SOD、CAT、MDA 试剂盒,南京建成生物公司。
可见分光光度计,上海元析仪器有限公司;pH计,梅特勒-托利多(上海)有限公司;倒置显微镜,日本Nikon 公司;智能活细胞成像分析系统,美国伯腾仪器有限公司。
1.2 试验方法
1.2.1 鳕鱼鳔胶原肽的制备 将鳕鱼鳔原料解冻后洗净,剪成0.5 cm×0.5 cm 的小块,加入10 倍体积0.1 mol/L 的氢氧化钠溶液,于4 ℃条件下搅拌溶胀48 h 后,除去非胶原成分的杂蛋白。洗净后加入10 倍体积蒸馏水匀浆,将pH 值调至中性,按100 U/mL 比例加入复合蛋白酶,于55 ℃水浴条件下酶解4 h,于100 ℃水浴加热10 min 灭酶活,旋转蒸发浓缩后冷冻干燥得到鳕鱼鳔胶原肽,命名为SWP[10]。
1.2.2 2BS 细胞的培养 使用含有10%胎牛血清,100 U/mL 青霉素和100 U/mL 链霉素的MEMNEAA 培养基培养2BS 细胞,于培养瓶中培养至对数期,传代。调整细胞含量至2×104/mL,取90 μL,加入96 孔板中制成2×103/孔的细胞悬液,于细胞培养箱中继续培养。当96 孔板单孔中细胞密度达到50%时,加入不同质量浓度的SWP(800,400,200,100,50,10 μg/mL),继续培养24 h 后采用cck-8 法检测细胞增殖率,评价SWP 的细胞毒性筛选适宜的给药浓度[11]。
细胞增殖率(%) =(OD药物-OD药物对照)/(OD空白-OD空白对照)×100
1.2.3 H2O2诱导2BS 细胞早期衰老细胞模型的建立 细胞培养方法同上。使用不同浓度的H2O2诱导对数生长期2BS 细胞,培养24 h 后,检测不同浓度鳕鱼鳔胶原肽对细胞增殖率的影响,细胞增殖率计算方法同上。
1.2.4 ROS 活性氧水平测定 本试验共分6 组,空白对照组(无H2O2,不给药)、氧化诱导模型组(含H2O2,不给药)和药物干预组(含H2O2,给药)。以10 μmol/L 白藜芦醇(Res)为阳性对照。诱导完成后药物干预组各加入10 μL 不同浓度的药物,对经H2O2诱导的细胞继续培养24 h,按照试剂盒说明书中原位装载探针的方法将10 μL 稀释1 000 倍的DCFH-DA 探针加入处理过的细胞中,于37 ℃,5%CO2细胞培养箱中孵育20 min 后,用不含胎牛血清的MEM-NEAA 培养基清洗细胞,加入100 μL PBS,用荧光酶标仪检测每组细胞的荧光强度,激发光波长为488 nm,发射光波长为525 nm,同时使用智能活细胞成像分析系统对细胞状态进行荧光拍照[12]。
1.2.5 Hoechst 33258 染色 试验分组同上。采用6 孔板培养2BS 细胞。将H2O2诱导的细胞继续培养24 h,加入固定液对细胞进行固定,洗去固定液,加入预先用PBS 稀释的Hoechst 33258 染色液。置室温3~5 min 后洗去染色液,用显微镜观察。激发波长350 nm,发射波长460 nm[13]。
1.2.6 β-半乳糖苷酶含量测定 试验分组及细胞处理方式同上。将H2O2诱导的细胞继续培养24 h,吸出细胞培养液,加入固定液,室温固定15 min。用PBS 洗涤细胞,按比例加入染色工作液,6孔板四周用parafilm 膜封好,于37 ℃恒温箱中过夜。24 h 后吸出染色液,加入PBS,用光学显微镜观察,细胞中有蓝色物质生成的为表达β-半乳糖苷酶的细胞,随机抽取5 个区域进行细胞计数[14]。
1.2.7 过氧化物酶含量测定 试验分组同上。采用25 cm2细胞培养瓶培养2BS 细胞。处理后的细胞用胰酶消化,超声破碎,收集细胞液,检测蛋白浓度,按照试剂盒说明检测SOD、CAT 以及MDA含量[15]。
1.2.8 统计学处理 采用SPSS 17.0 软件进行统计学分析,计量资料以±s表示,两组间比较采用t检验。P<0.05 为有统计学意义。
2 结果与分析
2.1 安全性评价结果
细胞增殖试验可反应受试物的细胞毒性,可通过该试验对鳕鱼鳔胶原肽的安全性进行评价。已知细胞毒性的评判等级可分为5 级:0 级:增殖率≥100%;I 级:增殖率75%~99%;II 级:增殖率50%~74%;III 级:增殖率25%~49%;IIII 级:增殖率1%~24%;V 级:0。结果显示,质量浓度10~800 μg/mL 鳕鱼鳔胶原肽的细胞增值率均超过100%,说明鳕鱼鳔胶原肽无细胞毒性,在一定浓度范围内对2BS 细胞增殖有促进作用。
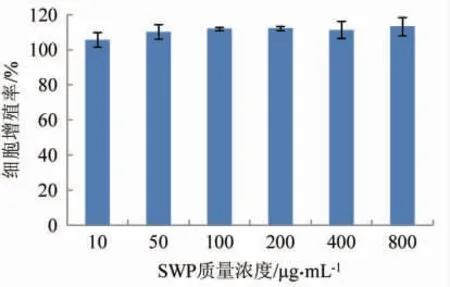
图1 鳕鱼鳔胶原肽对2BS 细胞增殖率的影响Fig.1 Cell viability of 2BS cells treated with SWP
2.2 H2O2 浓度的选择
有研究表明,一定浓度的H2O2可使人二倍体成纤维细胞发生衰老退行性改变,且不表现细胞死亡,该状态的细胞适宜用于早期衰老细胞模型研究[16]。为选择适合的H2O2诱导浓度,检测加入不同浓度H2O2后细胞的增殖率。由图2可以看出,与空白组细胞相比,加入0.1 mmol/L H2O2的细胞增殖率超过100%,随着浓度的进一步增大,细胞增殖率逐渐降低,当H2O2浓度为0.2 mmol/L 时,细胞增殖率为80.1%;当H2O2浓度为5 mmol/L时,细胞增殖率仅1.3%。上述结果表明H2O2对细胞的增殖具有双向调节作用,低浓度促进细胞增殖,高浓度抑制细胞增殖。王昌等[17]在试验中观察到类似的现象,他指出H2O2对细胞的影响取决于细胞类型和诱导剂量。细胞增殖率过低不利于药效的发挥,影响后续试验的进行。本试验采用0.2 mmol/L H2O2建立早期衰老模型。

图2 不同浓度H2O2 诱导2BS 细胞的增殖率(±s,n=4)Fig.2 Cell viability of H2O2-induced 2BS cells (±s,n=4)
2.3 SWP 对2BS 细胞存活率的影响
由图3可看出,与模型组细胞相比,H2O2诱导的2BS 细胞经SWP 或白藜芦醇处理后细胞增殖率提高,且呈一定的剂量依赖。当SWP 质量浓度为200 μg/mL 时,细胞增殖率为79.8%,具有显著性差异(P<0.01)。这表明一定浓度的鳕鱼鳔胶原肽对H2O2诱导的2BS 细胞增殖有促进作用。
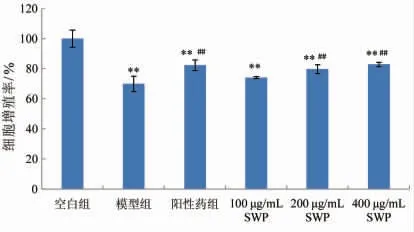
图3 鳕鱼鳔胶原肽分离纯化组分对H2O2 诱导2BS细胞增殖率的影响(±s,n =4)Fig.3 Effects of SWP on cell viability of H2O2-induced 2BS cells(±s,n=4)
2.4 ROS 活性氧
1956年,Harman 首次提出自由基致衰老学说,最早阐释了氧自由基与衰老之间的关联[18]。当体内多余的ROS 活性氧自由基不能被及时清除时,会对机体产生一定的伤害。采用DCFH-DA 探针标记细胞,非荧光的DCFH 被自由基氧化后形成荧光DCF,通过荧光强度检测可反映细胞中活性氧自由基含量变化[19]。本试验结果如图4b 所示,用H2O2处理后,2BS 细胞的ROS 生成明显增加(P<0.01)。从图4a 的细胞形态也可以看出,模型组细胞中被荧光染料染色的细胞数量多,荧光强度大。与模型组细胞相比,经SWP 与白藜芦醇处理的细胞中ROS 活性氧含量显著下降(P<0.01),且SWP 浓度越大,下降越显著。以上结果显示鳕鱼鳔胶原肽能够清除H2O2诱导细胞产生的ROS 活性氧自由基,对早衰细胞起到保护作用。
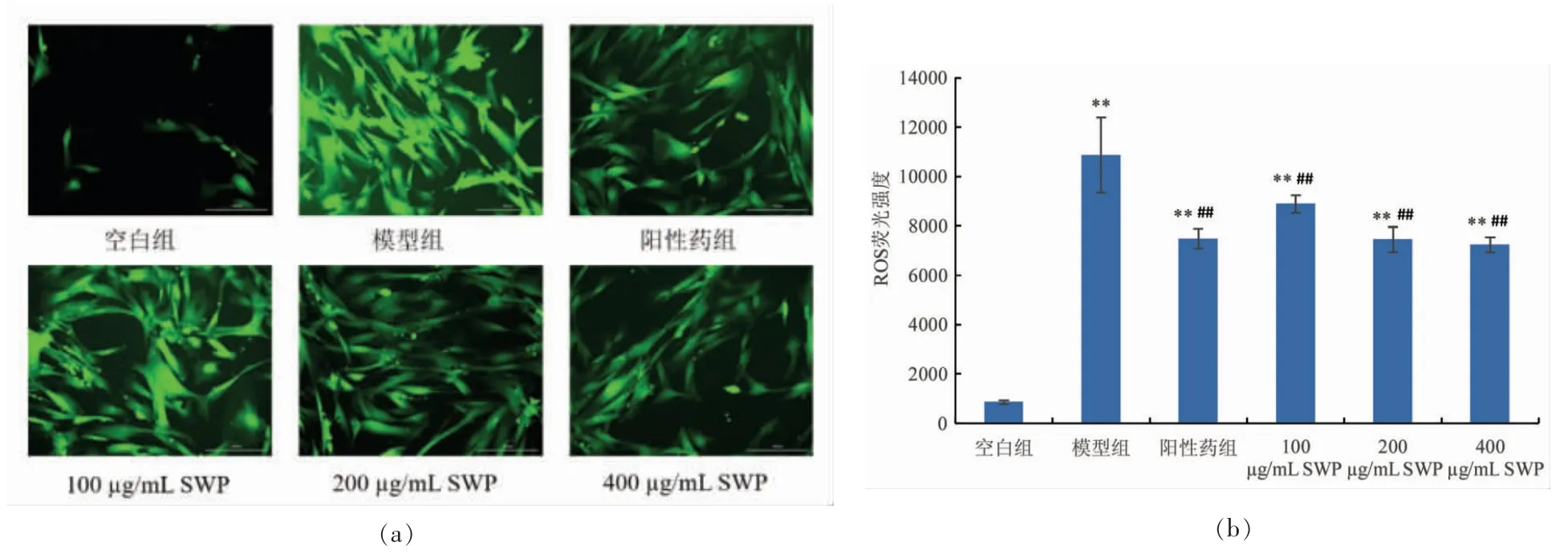
图4 鳕鱼鳔胶原肽对H2O2 诱导2BS 细胞ROS 活性氧的影响(±s,n =4)Fig.4 Effects of SWP on H2O2-induced ROS generation of 2BS cells( xˉ±s,n=4)
2.5 Hoechst 33258 染色
Hoechst 33258 作为一种可穿透细胞膜的具有荧光特性的核酸染料,常被用于DNA 染色,观察细胞凋亡情况[20]。染色结果如图5所示,未经处理的空白组中细胞形态规则且呈均匀的蓝色荧光。经H2O2诱导处理后,细胞数量明显减少,细胞大小不均一且细胞核浓染数量较多,颜色发白、发亮,可见细胞核固缩或碎裂为小核等典型的细胞凋亡形态特征。与模型组细胞相比,阳性药组与SWP 处理组细胞数量有一定程度的增加,浓染细胞数减少,且高浓度SWP 对早衰2BS 细胞的保护作用更显著。试验结果表明鳕鱼鳔胶原肽对H2O2诱导2BS 细胞产生的细胞凋亡具有较好的抑制作用。

图5 鳕鱼鳔胶原肽对H2O2 诱导2BS 细胞Hoechst 33258 染色的影响Fig.5 Effects of SWP on Hoechst 33258 staining of H2O2-induced 2BS cells
2.6 β-半乳糖苷酶
β-半乳糖苷酶(SA-β-gal)是一种存在于动物中的常用来评价细胞衰老水平的生物标志物[21]。本试验采用5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-Gal)染料,经细胞内的β-半乳糖苷酶催化后生成蓝色产物,在光学显微镜下很容易被观察到。通过对染色细胞计数可以检测和量化衰老细胞。随机抽取5 个视野,计数染色细胞,计算染色细胞占总细胞数比例。细胞形态与统计结果见图6。可以看出,经H2O2诱导处理的细胞形态发生变化,SA-β-gal 阳性细胞数量显著增多(P<0.01),达到细胞总数的54.8%。与模型组细胞相比,阳性药组与SWP 处理组细胞中SA-β-gal 阳性细胞数量显著减少(P<0.01),且呈现良好的剂量依赖关系。400 μg/mL SWP 组细胞中染色阳性率与白藜芦醇组相近,为33.8%。该结果显示鳕鱼鳔胶原肽对H2O2导致的细胞中β-半乳糖苷酶升高具有显著的抑制作用。
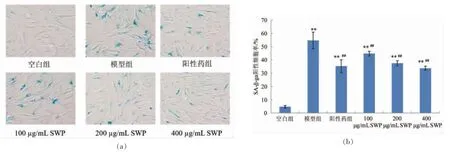
图6 鳕鱼鳔胶原肽对H2O2 诱导2BS 细胞β-半乳糖苷酶含量染色的影响(±s,n = 5)Fig.6 Effects of SWP on SA-β-gal staining of H2O2-induced 2BS cells (±s,n=5)
2.7 抗氧化酶活力
人体内存在复杂的抗氧化防御网络,主要通过内源性酶和非酶抗氧化剂来调节。这些分子共同作用,将体内多余的自由基转化成为稳定的无害化合物,使机体的氧化-还原状态维持在较为平稳的状态[22]。过氧化物酶,如超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等构成人体抗氧化防御体系的第一道防御系统。丙二醛(MDA)是自由基与脂质发生过氧化反应的重要产物,具有明显的细胞毒性,可反映机体因自由基而导致的氧化损伤。细胞中SOD、CAT 活力及MDA 含量检测结果见表1。与空白组细胞相比,模型组细胞中SOD与CAT 活力显著降低(P<0.01),MDA 含量显著升高(P<0.01)。与模型组细胞相比,阳性药组与SWP处理组细胞中SOD 与CAT 活力不同程度地增大,MDA 含量有降低趋势,其中400 μg/mL SWP 组对提高氧化损伤细胞中SOD 与CAT 活力的效果最显著(P<0.01),200 μg/mL SWP 组对降低氧化损伤细胞中MDA 含量的效果最显著(P<0.01)。以上结果显示,鳕鱼鳔胶原肽通过调节抗氧化酶活力并降低脂质过氧化物含量来实现对早期衰老细胞的保护作用。

表1 过氧化物酶含量变化Table 1 The changes of peroxidase content
3 结论
本研究结果表明,对H2O2诱导的早期衰老的2BS 细胞,用鳕鱼鳔胶原肽处理后能够提高细胞增殖率,降低细胞ROS 活性氧水平与β-半乳糖苷酶含量,减少细胞凋亡率,提高细胞内抗氧化酶活力并降低脂质过氧化物含量,说明鳕鱼鳔胶原肽能延缓衰老,是因其具有抗氧化活性及抑制细胞凋亡作用。

