不同提取方法对陕产黄精多糖及其抗氧化活性的影响*
王 敏,赵重博,王 晶,4
(1.南京大学医学院附属鼓楼医院,江苏 南京 210008;2.南京临床药学中心,江苏 南京 210008;3.陕西中医药大学药学院,陕西 咸阳 712046;4.陕西省中药基础与新药研究重点实验室,陕西 咸阳 712046)
黄精来源于百合科植物滇黄精(Polygonatum KingianumColl.et Hemsl.)、黄精(Polygonatum sibiricumRed.)或多花黄精(polygonatum cyrtonemaHua)的干燥根茎[1],其中第二种黄精主要分布在陕西汉中地区,以栽培为主,而野生资源遍布秦岭山脉,因其外形似鸡头,又称为“鸡头黄精”,是传统的药食两用中药,具有养阴润肺、滋阴填髓、补脾益气的功效[2]。黄精含有甾体皂苷、黄酮类、蒽醌类和多糖等多种化学成分[3-4]。多糖不仅是其中药用活性较高的一种成分,也是2020年版《中华人民共和国药典》规定的唯一质量控制指标。黄精多糖主要由葡萄糖、甘露糖、岩藻糖、阿拉伯糖和半乳糖醛酸等组成,具有抗衰老、抗肿瘤、增强免疫力、降血脂血糖及抗氧化损伤等作用[5-7]。黄精多糖生物活性高,其具有重要开发价值。据此,笔者采用不同方法提取黄精多糖,并采用季铵盐沉淀法分离不同性质的多糖组分,研究其结构特征和抗氧化活性,以期为黄精多糖的深入开发提供依据。
1 材 料
1.1 药物与试剂 黄精药材采自陕西汉中略阳步长集团黄精种植基地,经陕西中医药大学赵重博副教授鉴定为百合科黄精属植物黄精(Polygonatum sibiritumRed)的干燥根茎。
1-苯基-3-甲基-5-吡唑酮(PMP)(批号:Y27M11C 114179)、鼠李糖(批号:H29A10G96375)、木瓜蛋白酶(批号:P15J11B118475)、阿拉伯糖(批号:H24J11C116813)、甘露糖(批号:C25D8H51117)和半乳糖(批号:S09D11M133218)均购自源叶生物有限公司;碳酸氢钠(批号:20200713)、磷酸二氢钾(批号:20200929)、乙二胺四乙酸二钠(EDTA-2Na)(批号:20200914)、氯化钠(批号:20200922)、无水乙醇(批号:20201019)、硼酸(批号:20201126)和DPPH(批号:20200217)均购自天津天丽化学试剂有限公司;葡萄糖(批号:20190726)、37.5%盐酸(批号:20200216)、浓硫酸(批号:20190924)、维生素C(VC)(批号:20200104)、溴化钾(批号:20200322)和溴代十六烷基三甲胺(CTAB)(批号:20190918)均购自科密欧化学试剂有限公司。
1.2 主要仪器DIONEX UItimate3000高效液相色谱仪(美国Thermo Fisher Scientific公司);UV2550型紫外分光光度计(日本Shimadzu公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);KH-400KDE型高功率数控超声波清洗机(欧莱博科技有限公司);XJY-2台式高速离心机(上海沪粤明科学仪器有限公司);DHG-9140型电热恒温鼓风干燥箱(常州恒隆仪器有限公司);GB5374-91型电子天平(艾安得仪器有限公司);HH-X型数显电热恒温水浴锅(西安莫吉娜仪器制造有限公司);MG-2200型氮吹仪(上海旦鼎国际贸易有限公司);Tensor-27型博里叶变换红外色谱仪(德国Bruker光谱仪器公司)。
2 方 法
2.1 黄精多糖含量的测定 参照2020年版《中华人民共和国药典》[1]测定黄精多糖含量。
2.2 黄精多糖的提取
2.2.1 样品预处理 取黄精药材细粉(过五号筛)500 g加入5倍量的石油醚,于40℃水浴中回流2 h,过滤,挥干溶剂。残渣中加入药材量10倍量的80%乙醇,于80℃水浴中回流2 h,趁热过滤,残渣用80%乙醇洗涤2次后,挥干溶剂备用。
2.2.2 回流法提取制备黄精多糖粗品参考文献[8],取“2.2.1”项下的脱脂黄精100 g,加入15倍量的蒸馏水回流2次,每次1 h,合并滤液并浓缩至约200 mL,随后加入95%乙醇至醇量为80%,过夜放置后抽滤,挥干得黄精多糖粗品。
2.2.3 超声法提取制备黄精多糖粗品参考文献[9],取“2.2.1”项下的脱脂黄精100 g加入15倍量的蒸馏水超声(功率:250 W,频率:40 kHz,温度:50℃)2次,1 h/次,合并滤液并浓缩至约200 mL,随后加入95%乙醇至醇量为80%,过夜放置后抽滤,挥干得黄精多糖粗品。
2.2.4 酶法提取制备黄精多糖粗品参考文献[10],取“2.2.1”项下的脱脂黄精100 g,加入15倍量的蒸馏水,加入1.5%木瓜蛋白酶,在pH值为6.0和65℃条件下酶解2次,1 h/次,合并滤液并浓缩至约200 mL,随后加入95%乙醇至醇量为80%,过夜放置后抽滤,挥干得黄精多糖粗品。
2.3 黄精多糖的分离纯化
2.3.1 黄精多糖半精品的制备 黄精多糖粗品装入截留量为3 500 Da的透析袋,依次用超纯水和蒸馏水透析24 h和48 h以去除小分子杂质。随后,将所得到的黄精多糖减压浓缩,并且按体积比5∶1加入Sevage试剂[V(氯仿)∶V(正丁醇)=4∶1],涡旋20 min后静置,3 000 r/min离心10 min,移取上层水相。重复4次,向所得水相中加入95%乙醇至含醇量为80%,过夜放置后抽滤,挥干得黄精多糖半精品。
2.3.2 黄精多糖酸性组分的提取 黄精多糖半精品2 g溶于60 mL蒸馏水中,加入50 mL的5%的CTAB,静置2 h后,抽滤收集沉淀。沉淀用10%NaCl溶液溶解后,加入3倍体积95%乙醇后,抽滤收集沉淀。沉淀经溶解、透析和真空冷冻干燥得到黄精多糖酸性组分AP1。
2.3.3 黄精多糖中性组分的提取 将CTAB处理后的上清液用1% H3BO3调至pH值为6.0,再用2 mol/L NaOH溶液调至pH值为11.0,静置2 h,抽滤收集沉淀并用10% NaCl溶液溶解,然后用2%乙酸调至pH值为7.0,加入3倍体积95%乙醇后,抽滤收集沉淀。沉淀经溶解、透析和真空冷冻干燥得到黄精多糖中性组分AP2。
2.3.4 黄精多糖碱性组分的提取 用乙酸将提取AP2后的上清液调至pH值为4.4,加入3倍体积95%乙醇后,抽滤收集沉淀。沉淀经溶解、透析和真空冷冻干燥得到黄精多糖碱性组分AP3。
2.4 黄精多糖的抗氧化活性研究参考文献[10],分别取系列质量浓度的回流、超声和酶法获得的黄精多糖粗品和不同性质的组分(0.5~8.0mg/mL),以及对照品Vc溶液(0.5~10.1 mg/mL)各0.2 mL,加入1.0×10-4mol/L DPPH自由基溶液7.8 mL混匀,于515nm处测定吸光度,所有样本均做3个复孔取平均值计算DPPH自由基清除率。DPPH自由基清除率=[1-Ai/AO]×100%。其中Ai为样品加DPPH溶液的吸光度,AO为空白溶液加DPPH溶液的吸光度。
2.5 黄精多糖的结构分析参考文献[11],黄精多糖粗品20 mg于西林瓶中,加入0.05 mol/L三氟乙酸溶液3 mL,氮气置换瓶中空气后封口后110℃水解5 h,继而加入甲醇旋蒸,去除三氟乙酸后,再加入超纯水2 mL溶解即得黄精多糖水解样品。向黄精多糖水解样品加入0.3 mol/L NaOH溶液和0.5 mol/L的PMP甲醇溶液各1 mL,混匀后70℃反应30 min,冷却后加入0.3 mol/L的HCl调节至中性,随后使用三氯甲烷反复萃取过量的PMP,移取水层并稀释至5 mL供HPLC进样分析。
HPLC分析条件如下:色谱柱为CAPCELL PAK C18(4.6 mm×250 mm,5 μm),进样量为10 μL,pH 6.8 0.05 mol/L磷酸缓冲液-乙腈(体积比为82∶18)等度洗脱,柱温为30℃,流速为0.6 mL/min,检测波长为245 nm。
3 结 果
3.1 多糖含量的测定结果 去除小分子杂质和蛋白的黄精多糖半精品190~600 nm波长范围的紫外光谱图见图1,回流、超声和酶法获得的黄精多糖半精品在260 nm和280 nm处均无吸收峰,表明不同提取方法所得到的黄精多糖半精品均不含有蛋白质和核酸[12-13]。
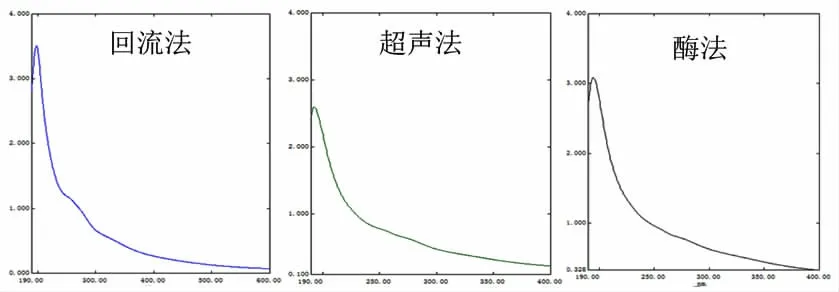
图1 黄精总多糖紫外扫描图
黄精药材经不同提取方法所得的黄精粗品、半精品和不同性质组分的黄精多糖得率见表1。当采用酶法提取时,黄精多糖粗品和半精品得率最高,而回流法对黄精多糖粗品、半精品和不同性质的3个组分得率均最低。
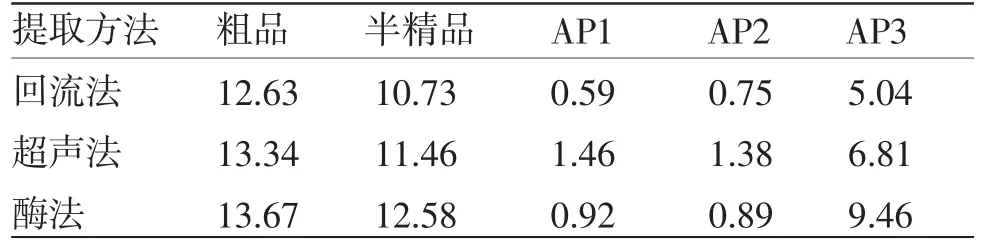
表1 不同提取方法黄精多糖得率(%)
3.2 黄精多糖抗氧化活性结果 以DPPH清除率表征黄精多糖的抗氧化活性[14]。黄精药材经不同提取方法所得的黄精粗品、半精品和不同性质组分的抗氧化结果见图2,其中超声法所得黄精粗品和半精品的抗氧化活性最高,而回流法得到的黄精多糖粗品、半精品和不同性质的3个组分的抗氧化活性均最低。

图2 黄精药材经不同提取方法所得的黄精粗品(A)、半精品(B)和不同性质组分(C)的抗氧化结果
3.3 多糖结构研究
3.3.1 单糖组成结果 回流法、超声法和酶法获得的黄精多糖的单糖组成结果见图3、表2。超声法获得的黄精多糖粗品含有甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖和岩藻糖,回流法获得的黄精多糖粗品不含葡萄糖和半乳糖,酶法获得的黄精多糖粗品不含有葡萄糖。3种提取方法均以岩藻糖单糖摩尔比最高。
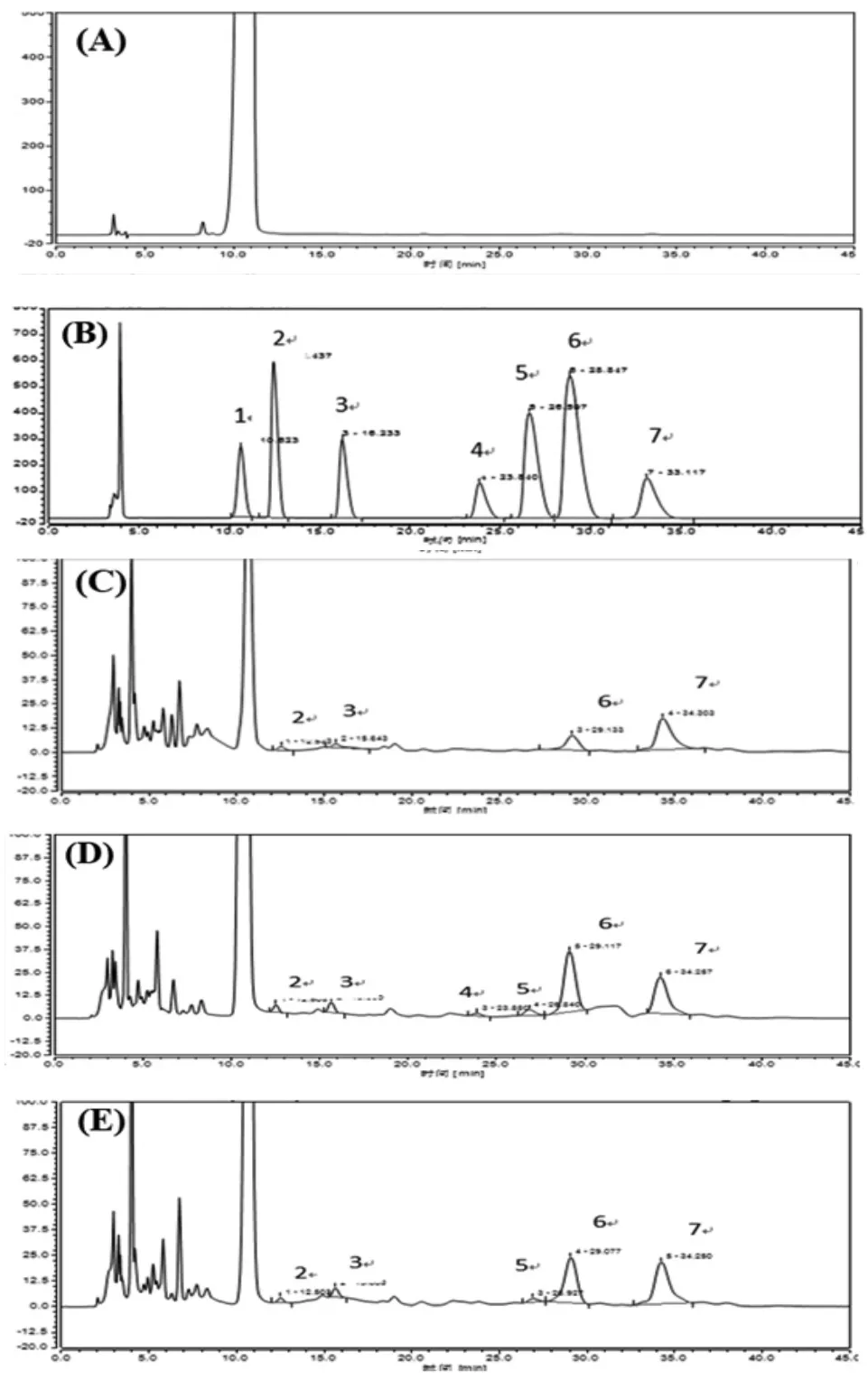
图3 空白对照(A)、混合多糖对照品(B)以及回流法(C)、超声法(D)和酶法(E)获得的黄精多糖的单糖组成HPLC谱图

表2 不同提取方法黄精多糖的单糖组成及摩尔比
3.3.2 红外测定结果 回流法、超声法和酶法获得的黄精多糖粗品的红外光谱图见图4,结果表明黄精多糖主要有糖环上的C-H振动吸收峰、O-H振动吸收峰、糖醛酸振动吸收峰、吡喃环的醚键C-O-C振动吸收峰及吡喃糖骨架吸收峰。此外回流法和酶法提取的多糖有水合振动吸收峰,而超声法没有此吸收峰;回流法和超声法提取的黄精多糖存在苷键为β-构型的吸收峰,而酶法提取的多糖不含此吸收峰。

图4 回流法(A)、超声法(B)和酶法(C)获得的黄精多糖红外光谱图
4 讨 论
黄精为药食同源的中草药,具有健脾、润肺、益肾、生津等功效,相继被《名医别录》《本草纲目》和《新修本草》等历代本草所记载。多糖是黄精的主要成分,具有多种生物活性,如抗衰老、抗肿瘤、增强免疫力、降血脂、降血糖及抗氧化损伤等。
笔者通过比较回流法、超声法和酶法3种方法黄精多糖的结构特征和抗氧化活性,以期为黄精多糖的研究开发提供依据。已有文献报道[10]显示,分别采用果胶酶、纤维素酶、木瓜蛋白酶提取黄精多糖,木瓜蛋白酶处理后的多糖含量最高,并且有利于后续除去蛋白质杂质,故本实验选择木瓜蛋白酶进行黄精多糖的提取。研究表明,3种方法中酶法所获得的黄精多糖的含量和抗氧化活性均高于超声法,而回流法所得的黄精多糖含量和抗氧化活性最低。无论是单糖组成,还是糖环形式和糖苷键类型,3种提取方法所获得的黄精多糖粗品均比较相似,但略有差别。黄精多糖粗品经季铵盐沉淀法分离得到不同性质多糖,3种提取方法纯化后均以碱性AP3组分的含量最高,超声法所获得的AP3组分抗氧化活性最高。超声提取是利用超声波辐射产生强烈的空化效应、机械振动、扰动效应、扩散和击碎等多种作用,增加物质分子振动的频率和速度、溶剂的穿透力,从而击破黄精细胞壁的破裂促进多糖进入溶剂,实现多糖的快速、高效提取。与回流提取和酶法相比,超声提取具有无需加热、提取率高、成本低、操作简便,且不破坏化学成分的结构的特点[15-16]。
综上所述,出于对黄精多糖提取效率、抗氧化活性和工艺成本的综合考虑,可选择超声法作为优选的提取方法。

