TBHP促进(异)喹啉与苯甲醇的交叉偶联脱氢反应
冯寅寅,李泽琼,晏利琴,3*
(1.皖西卫生职业学院药学系,安徽六安 237005; 2.安徽师范大学化学与材料科学学院,安徽芜湖 241002;3.功能分子固体教育部重点实验室,安徽芜湖 241002)
0 引言
酰基喹啉结构单元广泛存在于天然产物及人工合成的化合物中,许多酰基喹啉类药物具有重要的生物和药物活性[1],同时也是合成相应的芳烃、酰胺的重要中间体[2].目前,文献报道了多种合成酰基喹啉类化合物的方法,光电催化喹啉、异喹啉或者吡啶的酰化反应[3]、金属试剂催化缺电子N-杂环(异喹啉、喹诺酮和喹喔啉)的官能团氧化[4]、无金属催化喹啉或异喹啉发生氧化交叉脱氢偶联反应(CDC)[5].虽然,传统的方法为酰基喹啉的合成提供了有效的方法,但仍然存在一些不足.例如:使用危险或高毒试剂,苛刻的反应条件等[6].因此,进一步开发简便和原子经济的喹啉的先计划反应显得十分迫切.

图1 TBHP催化的喹啉与芳香醇的酰基化反应
近年来,有机小分子催化喹啉的Minisci反应,对喹啉和异喹啉引入酰基形成酰基喹啉更加高效[7].例如,2015年Miao Wan课题组报道了异喹啉与甲基芳烃的氧化交叉脱氢偶联(CDC)可以容易地合成结构多样的苯甲酰异喹啉[5a],在DTBP和催化量的Y(OTf)3的催化下,该方法表现出良好的化学选择性,形成了独特的苄基化产物.2016年Mehdi Adib课题组报道了一种新的酰化方法,是芳基甲醇与异喹啉与喹啉反应酰基化的首次报道[5c].文章提到在80 ℃、MeCN溶剂中,使用K2S2O8作为氧化剂和甲基三辛基氯化铵(Aliquat 336)作为相转移催化剂,在反应物喹啉和异喹啉等与芳基甲醇发生氧化交叉脱氢偶联(CDC)反应形成新的C-C键,该反应在无金属和温和的条件下进行的,分离产物得到较高的产率.
本课题组在前期研究工作的基础上[8],报道了一种用芳香醇作为底物,NCS促进TBHP为氧化剂的交叉偶联反应,来构建 C-C 和 C-H键.该反应类型具有底物范围宽泛、产率收率高等优点,不仅拓展了Minisci反应的应用范围,也为合成2-酰基喹啉类化合物提供了简便的新途径.
1 实验部分
1.1 仪器与试剂
实验所用试剂均购于阿拉丁试剂公司.对质谱的测定用的是Bruker APEX Ⅲ7.0TESLA FTMS型质谱仪.核磁共振氢谱、碳谱均以CDCl3作溶剂,1H NMR以TMS(δ = 0)作内标使用Bruker公司的AV 300型核磁共振仪(300 MHz/500 MHz),所做化合物熔点的测定使用XT4显微熔点测定仪.旋转蒸发仪使用SB-Ⅲ型,紫外荧光灯采用ZF-3.
1.2 实验方法
以1a的合成为例.称取1 mmol的苯甲醇和0.5 mmol喹啉,再用注射器将2equiv过氧化叔丁醇(TBHP)注入反应管中,25%的N-溴代丁二酰亚胺(NBS),溶于2 ml的1,1,2-三氯乙烷溶剂置于反应管中,在80 ℃温度下不间断搅拌12 h,即可停止反应,反应管冷却至室温条件下,然后所得的产物用二氯甲烷萃取(3×10 ml),随后用无水硫酸钠干燥、浓缩有机相后得到粗产物,最后硅胶柱分离提纯(石油醚∶乙酸乙酯=20∶1)即得到目标化合物.
2 结果与讨论
2.1 反应条件的优化
我们以苯甲醇(1a)和喹啉(2a)为底物对反应条件进行了优化,主要的实验结果如表1所示.当以1,2-二氯乙烷(DCE)为溶剂,TBAB、TBAI、NIS为促进剂时,1a不发生反应(表1,entries 1-3).改用CF3COOH作为促进剂,TBHP为氧化剂时,反应在80 ℃条件下进行12 h可以顺利的以47%的收率得到预期的喹啉-2,4-二酮产物2a(表1,entry 4).随后对促进剂的条件进行了进一步的摸索,最终经过筛选得出在相同条件下,NCS的催化效果是最优的(表1,entries 5-8).在其他氧化剂如DTBP、H2O2等条件下,效果都不如TBHP.如果没有氧化剂时,几乎不产生新物质.值得注意的是,添加了K2S2O8为氧化剂时,反应仍以63%的收率得到了目标产物2a(表1,entries 9-12).同时对反应的溶剂进行进一步的筛选,其中包括1,4-二氧六环(1,4-Dioxane)、二甲亚砜(DMSO)、乙醇(EtOH)、二氯甲烷(DCM)、甲苯(Toluene)以及1,1,2-三氯乙烷(TCE),发现用TCE做溶剂时产率最优(表1,entries 13-18).在考察了温度对反应的影响时发现,当升高温度至90 ℃,反应效果更好,达到了77%的收率.温度继续升高至100 ℃,收率反而下降(表1,entries 19-23).对反应时间的考察表明反应12 h收率最好(表1,entries 24-26).

表1 1a的反应条件优化
2.2 底物的拓展
基于上述优化的反应条件,本文对各种喹啉和醇的底物范围进行了系统的研究.首先固定喹啉1a为底物来考察醇2(R′)的适用范围,结果如图2所示.研究表明:不同取代基如芳基、甲基、甲氧基、烷基等的醇均能适应此酰化反应.得到相应的产物3a-3m.其中,具有不同电子性质如供电子基团和吸电子基团均能兼容此反应.如含甲氧基(2b)、甲基(2c、2d)、溴(2e、2f)、三氟甲基(2g)、氯(2h)、苯基(2i)、萘基(2j、2k)、异丙基(2l)和三甲氧基(2m)在优化条件下都能顺利进行.值得一提的是,对于空间位阻比较大的衍生物,如含苯基(2i)、异丙基(2l)表现出较高反应活性,收率分别达到83%和81%.1-萘甲醇和2-萘甲醇也是有效的底物,得到3j和3k,产物分别为81%和79%.除此之外,异喹啉也能与不同的醇发生反应,如溴代酰基异喹啉(1n)、萘酰基异喹啉(1o、1p)、苯酰基异喹啉(1q)、甲基取代苯酰基异喹啉(1r、1s)、氟取代苯酰基异喹啉(1t)和氯取代苯酰基异喹啉(1u),均能得到良好的收率.随后对喹啉的普适性进行了探究.如喹喔啉(1v)、8-甲基喹啉(1w、1x)和7-溴代喹啉(1y、1z),都能很好的反应,生成相应的产物2-酰基喹啉(3v-3z),产率为54%-71%.所合成的2-酰基喹啉3a-3z的结构均经过核磁共振1H NMR谱和13C NMR谱、红外光谱、质谱的验证.

图2 反应底物的拓展
2.3 反应机理
在上述实验结果的基础上,结合有关文献的探讨和总结[1,6,8],以喹啉和苯甲醇为例对机理进行了探索,提出了一种可行的反应过程(Fig.3).TBHP在NCS的存在下形成叔丁基氧自由基和羟基自由基,苯甲醇在叔丁基氧自由基的氧化下成酰基自由基,随后酰基自由基加入杂芳烃形成酰基化合物.最后,叔丁基氧自由基从酰基化合物中夺取氢形成了酰化产物.并且在查阅大量文献的过程中发现苯甲醇在被氧化为苯甲醛时,投入TEMPO会明确得被消耗形成PhCO-TEMPO.
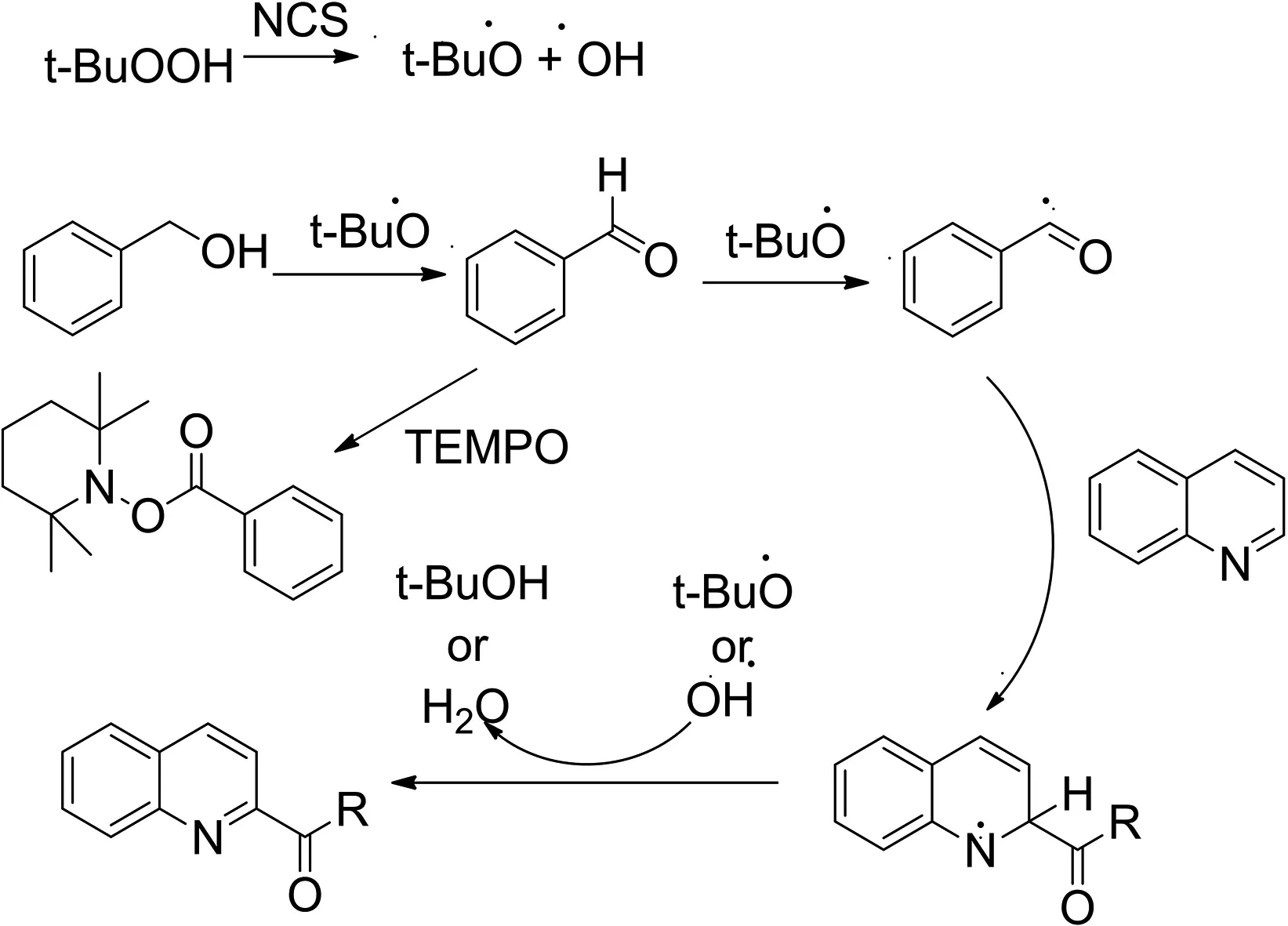
图3 可能的反应机理
2.4 小结
本体系以过氧化叔丁醇(TBHP)作为氧化剂,N-氯代丁二酰亚胺(NCS)为添加剂,CHCl3为溶剂实现了杂环分子间的酰化反应.通过对影响反应的各种条件的探索最终筛选得出最优的反应条件,同时探索了取代基对反应底物的影响,在探究中发现取代基效应和空间效应对反应的产率有一定的影响,当苯甲醇类化合物做底物时带有吸电子基团的底物其产率略低于带有供电子基的底物,从空间效应来看对反应差率也没有很大的差别.
此外,使用过氧化叔丁醇作为氧化剂有三点优势:(1)各种醇与杂芳烃无需金属参与即成功合成目标产物;(2)反应对空气相对稳定且反应副产物为水和叔丁醇;(3)反应条件有效温和且廉价.
2.5 产物谱图数据
苯基(2-喹啉基)甲酮(3a):白色固体;mp:105-106℃;yield:77%.1H NMR(300 MHz, CDCl3)δ=8.35(d, J=9Hz, 1H), 8.22(t, J=9Hz, 3H), 8.11(d, J=9Hz, 1H), 7.91(d, J=9Hz, 1H), 7.79(t, J=9Hz, 1H), 7.65(dd, J=18Hz, J=9Hz, 2H), 7.52(t, J=6Hz, 2H)ppm;13C NMR(125 MHz, CDCl3)δ 194.3, 155.1, 147.1, 137.5, 136.5, 133.5, 131.9, 131.0, 130.5, 129.3, 128.8, 128.6, 128.1, 121.2 ppm.HRMS(ESI)calcd for[C16H11NO+H]+234.091 3, found 234.090 8.
(4-甲甲氧基苯基)(2-喹啉基)甲酮(3b):白色固体; mp: 87-88℃; yield: 70%.1H NMR(300 MHz, CDCl3)δ=8.36(s, 1H), 8.33(s, 1H), 8.30(s, 1H), 8.28(s, 1H), 8.21(d, J=6Hz, 1H), 8.07(d, J=9Hz, 1H), 7.79(t, J=9Hz, 1H), 7.66(t, J=6Hz, 1H), 7.00(d, J=9Hz, 2H), 3.91(s, 3H)ppm; 13C NMR(126 MHz, CDCl3)δ 192.7, 164.1, 155.8, 147.0, 137.5, 134.3, 130.8, 130.5, 129.3, 129.2, 128.6, 128.1, 121.3, 114.0, 56.0 ppm.HRMS(ESI)calcd for[C16H10ClNO+H]+264.101 9, found 264.101 5.
2-喹啉基(对甲苯基)甲酮(3c):白色固体; mp: 81-82℃; yield: 72%.1H NMR(300 MHz, CDCl3)δ=8.35(d, J=9Hz, 1H), 8.20-8.01(m, 4H), 7.91(d, J=6Hz, 1H), 7.79(t, J=6Hz, 1H), 7.66(t, J=6Hz, 2H), 7.46-7.30(m, 2H), 2.44(s, 3H)ppm;
13C NMR(125 MHz, CDCl3)δ 193.9, 155.5, 147.1, 144.4, 137.4, 133.9, 132.0, 130.9, 130.5, 129.3, 129.3, 128.7, 128.0, 121.3, 22.2 ppm.HRMS(ESI)calcd for[C17H13NO+H]+264.101 9, found 264.102 2.
2-喹啉基(间甲苯基)甲酮(3d):白色固体; mp: 81-82℃; yield: 71%.1H NMR(300 MHz, CDCl3)δ=8.35(d, J=9Hz, 1H), 8.21(d, J=9Hz, 1H), 8.10-8.01(m, 3H), 7.91(d, J=6Hz, 1H), 7.79(t, J=9Hz, 1H), 7.66(t, J=6Hz, 1H), 7.43-7.37(m, 2H), 2.41(s, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 194.6, 155.3, 147.2, 138.4, 137.5, 136.5, 134.3, 132.1, 131.0, 130.5, 129.3, 129.2, 128.8, 128.4, 128.1, 121.2, 21.8 ppm.HRMS(ESI)calcd for[C17H13NO+H]+248.107 0, found 248.107 1.
(4-溴苯基)(2-喹啉基)甲酮(3e):白色固体; mp: 119-120℃; yield: 64%.1H NMR(300 MHz, CDCl3)δ=8.35(d, J=9Hz, 1H), 8.16(q, J=6Hz, 4H), 7.91(d, J=6Hz, 1H), 7.79(t, J=9Hz, 1H), 7.67(t, J=9Hz, 1H)ppm;13C NMR(125 MHz, CDCl3)δ 193.0, 154.5, 147.1, 137.7, 135.3, 133.4, 131.8, 130.9, 130.6, 129.4, 129.1, 128.8, 128.1, 121.1.HRMS(ESI)calcd for[C16H10BrNO+H]+312.001 9, found 312.001 6.
(3-溴苯基)(2-喹啉基)甲酮(3f):白色固体; mp: 135-136℃; yield: 68%.1H NMR(300 MHz, CDCl3)δ=8.42-8.35(m, 2H), 8.22-8.13(m, 3H), 7.92(d, J=9Hz, 1H), 7.83-7.69(m, 3H), 7.40(t, J=9Hz, 1H)ppm;13C NMR(125 MHz, CDCl3)δ 192.6, 154.3, 147.1, 137.7, 136.2, 134.7, 131.0, 130.7, 130.5, 130.1, 129.5, 129.1, 128.1, 122.7, 121.1 ppm.HRMS(ESI)calcd for[C16H10BrNO+H]+312.001 9, found 312.001 4.
(4-三氟甲基苯基)(2-喹啉基)甲酮(3g):白色固体; mp: 112-113℃; yield: 54%.1H NMR(300 MHz, CDCl3)δ=8.37(d, J=9Hz, 1H), 8.22-8.00(m, 3H), 7.92(d, J=6Hz, 1H), 7.81(t, J=6Hz, 1H), 7.68(t, J=9Hz, 1H), 7.51-7.46(m, 1H), 7.33(td, J=9Hz, J=3Hz, 1H)ppm;13C NMR(125 MHz, CDCl3)δ 192.6, 163.8, 161.8, 154.5, 147.2, 138.5(d, J=6.25 Hz), 137.6, 131.0, 130.6, 130.1(d, J=7.5 Hz), 129.4, 129.1, 128.1, 127.7, 121.1, 120.4, 120.3(d, J=21.3Hz), 118.7, 118.6(d, J=22.5 Hz)ppm.HRMS(ESI)calcd for[C17H10F3NO+H]+302.078 7, found 302.078 3.
(2-氯苯基)(2-喹啉基)甲酮(3h):白色固体; mp: 103-104℃; yield: 63%.1H NMR(300 MHz, CDCl3)δ=8.34(d, J=9Hz, 1H), 8.20(d, J=9Hz, 1H), 8.08(d, J=9Hz, 1H), 7.89(d, J=6Hz, 1H),7.67-7.61(m, 3H), 7.46-7.39(m, 3H)ppm;13CNMR(125 MHz, CDCl3)δ 196.0, 191.0, 153.8, 147.6, 138.6, 137.5, 132.8, 131.9, 131.3, 131.0, 130.4, 130.4, 129.7, 129.2, 128.0, 126.8, 120.0 ppm.HRMS(ESI)calcd for[C16H10ClNO+H]+268.052 4, found 268.052 5.
(4-[1,1’-联苯]基)(2-喹啉基)甲酮(3i):白色固体; mp: 92-93℃; yield: 83%.1H NMR(300 MHz, CDCl3)δ=8.82(s, 1H), 8.38(d, J=9Hz, 1H), 8.28-8.14(m, 3H), 7.97-7.90(m, 5H), 7.83-7.78(m, 1H),7.70-7.51(m, 4H)ppm;13C NMR(125 MHz, CDCl3)δ 206.0, 194.2,155.4, 147.2, 137.6,136.0, 134.6,133.8,132.8,131.0,130.6,130.3,129.3,129.0, 128.8, 128.4, 128.2, 128.1, 127.0, 126.8, 121.3 ppm.HRMS(ESI)calcd for[C22H15NO+H]+310.122 6, found 310.123 0.
(1-萘基)(2-喹啉基)甲酮(3j):白色固体; mp: 74-75℃; yield: 81%.1H NMR(300 MHz, CDCl3)δ=8.45-8.36(m, 2H), 8.28-8.20(m, 1H), 8.08(t, J=9Hz, 2H), 7.95-7.85(m, 3H), 7.77-7.63(m, 2H), 7.56-7.51(m, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 197.0, 155.7, 147.5, 137.5, 134.6, 134.3, 132.9, 132.0, 131.7, 131.2, 130.5, 129.5, 129.0, 128.9, 128.0, 126.7, 126.3, 124.5, 121.1 ppm.HRMS(ESI)calcd for[C20H13NO+H]+284.107 0, found 284.106 7.
(2-萘基)(2-喹啉基)甲酮(3k):白色固体; mp: 99-100℃; yield: 79%.1H NMR(300 MHz, CDCl3)δ=8.34(d, J=3Hz, 2H), 8.23(d, J=9Hz, 1H), 8.13(d, J=6Hz, 1H), 7.91(d, J=6Hz, 1H), 7.79-7.66(m, 5H),7.48-7.40(m, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 194.2,157.3,155.4,147.2, 137.6, 136.0, 134.6,133.8,132.8,131.0,130.6,130.3,129.3, 129.0, 128.8, 128.4, 128.2, 128.1, 127.0, 126.8, 121.3 ppm.HRMS(ESI)calcd for[C20H13NO+H]+284.107 0, found 284.106 7.
(4-异丙基苯基)(2-喹啉基)甲酮(3l):白色固体; mp: 69-70℃; yield: 68%.1H NMR(300 MHz, CDCl3)δ=8.35(d, J=9Hz, 1H), 8.20(t, J=9Hz, 3H), 8.08(d, J=9Hz, 1H), 7.92(d, J=9Hz, 1H), 7.79(t, J=9Hz, 1H), 7.66(t, J=9Hz, 1H), 7.37(d, J=6Hz, 2H), 3.06-2.96(m, 1H), 1.32(s, 6H)ppm; 13C NMR(125 MHz, CDCl3)δ 193.9,155.5,155.1,147.1,137.5,134.2, 132.2, 130.9, 130.4, 129.3, 128.7, 128.1, 126.8, 121.3, 34.8, 24.1 ppm.HRMS(ESI)calcd for[C19H15NO+H]+310.122 6, found 310.123 0.
2-喹啉基(3,4,5-三甲氧基苯基)甲酮(3m):白色固体; mp:145-146℃; yield: 63%.1H NMR(300 MHz, CDCl3)δ= 8.36(d, J=9Hz, 1H), 8.20(d, J=9Hz, 1H), 8.12(d, J=9Hz, 1H), 7.93(d, J=6Hz, 1H), 7.81(t, J=9Hz, 1H), 7.71-7.64(m, 3H), 3.97(s, 3H), 3.91(s, 6H)ppm;13C NMR(125 MHz, CDCl3)δ 192.6,155.3,153.1,147.0,137.6,131.3,130.8,130.7,129.3,128.9,128.1,121.5,109.6,61.4,56.7 ppm.HRMS(ESI)calcd for[C19H17NO4+H]+324.123 0, found 324.122 7.
(4-溴苯基)(1-异喹啉基)甲酮(3n):白色固体; mp: 88-89℃; yield: 63%.1H NMR(300 MHz, CDCl3)δ=8.60(d, J=6Hz, 1H), 8.26(d, J=6Hz, 1H), 7.93(d, J=9Hz, 1H), 7.85-7.74(m, 4H), 7.67-7.61(m, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 194.0, 156.0, 141.5, 137.2, 135.9, 132.7, 132.2, 131.2, 129.4, 129.0, 127.6, 126.9, 126.5, 123.4 ppm.HRMS(ESI)calcd for[C16H10BrNO+H]+310.994 6, found 310.994 2.
(1-异喹啉基)(1-萘基)甲酮(3o):白色固体; mp: 119-120℃; yield: 83%.1H NMR(300 MHz, CDCl3)δ=8.85(d,J=9Hz,1H),8.56(d,J=6Hz, 1H),8.43(d,J=9Hz,1H),8.05(d,J=9Hz,1H),7.96-7.92(m, 2H), 7.82-7.74(m, 2H), 7.68-7.55(m, 4H), 7.42(t, J=9Hz, 1H)ppm;13C NMR(125 MHz, CDCl3)δ 197.8,158.0,141.8,137.2,134.9,134.4, 134.2, 133.1, 131.8, 131.2, 129.0, 128.7, 127.6, 127.0, 127.0, 126.7, 126.4, 124.66, 123.3 ppm.HRMS(ESI)calcd for[C20H13NO+H]+284.107 0, found 284.107 3.
(1-异喹啉基)(2-萘基)甲酮(3p):白色固体; mp: 116-117℃; yield: 79%.1H NMR(300 MHz, CDCl3)δ=8.64(d, J=9Hz, 1H), 8.35(s, 1H), 8.24(d, J=6Hz, 1H), 8.15(d, J=9Hz, 1H), 7.95-7.82(m, 5H), 7.74(t, J=9Hz, 1H), 7.60(dd, J=15Hz, J=6Hz, 2H), 7.49(t, J=6Hz, 1H)ppm;13C NMR(125 MHz, CDCl3)δ 195.2, 157.1, 141.7, 137.2, 136.3, 134.4, 134.2, 132.8, 131.2, 130.3, 129.3, 128.9,128.8, 128.2, 127.6, 127.1, 126.9, 126.6, 125.7, 123.0 ppm.HRMS(ESI)calcd for[C20H13NO+H]+284.107 0,found 284.106 8.
(4-[1,1’-联苯])(1-异喹啉基)甲酮(3q):白色固体; mp: 92-93℃; yield: 80%.1H NMR(300 MHz, CDCl3)δ=8.63(d, J=6Hz, 1H), 8.27(d, J=9Hz, 1H), 8.04(d, J=6Hz, 2H), 7.95(d, J=9Hz, 1H), 7.83(d, J=6Hz, 1H), 7.97-7.62(m, 6H), 7.50-7.40(m, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 194.7, 157.1, 146.8, 141.6, 140.4, 137.2, 135.8, 131.8, 131.2, 129.4, 128.9, 128.7, 127.8, 127.6, 127.5, 126.9, 126.6, 123.1 ppm.HRMS(ESI)calcd for[C22H15NO+H]+310.122 6, found 310.123 0.
(1-异喹啉基)(对甲苯)甲酮(3r):白色固体; mp: 73-74℃; yield: 62%.1H NMR(300 MHz, CDCl3)δ=8.59(d, J=3Hz, 1H), 8.19(d, J=3Hz, 1H), 7.93-7.71(m, 5H), 7.60(t, J=9Hz, 1H), 7.27(d, J=6Hz, 2H), 2.42(s, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 194.9, 185.7, 157.2, 145.1, 141.6, 137.1, 134.5, 131.3, 131.1, 129.6, 128.6, 127.5, 126.8, 126.6, 122.8, 22.2 ppm.HRMS(ESI)calcd for[C17H13NO+H]+248.107 0, found 248.107 1.
(1-异喹啉基)(间甲苯)甲酮 (3s):白色固体; mp: 73-74℃; yield: 67%.1H NMR(300 MHz, CDCl3)δ=8.60(d, J=6Hz, 1H), 8.19(d, J=9Hz, 1H), 7.91(d, J=6Hz, 1H), 7.81-7.71(m, 4H), 7.60(t, J=9Hz, 1H), 7.43-7.32(m, 2H), 2.38(s, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 195.5, 157.1, 141.6, 138.7, 137.1, 135.0, 131.4, 131.1, 128.8, 128.7, 128.5, 127.5, 126.6, 122.9, 21.7 ppm.HRMS(ESI)calcd for[C17H13NO+H]+248.107 0, found 248.107 7.
(3,4-二氟苯基)(1-异喹啉基)甲酮(3t):白色固体; mp: 73-74℃; yield: 54%.1H NMR(300 MHz, CDCl3)δ=8.60(t, J=6Hz, 1H), 8.28-8.24(m, 1H), 7.96-7.64(m, 6H), 7.31-7.22(m, 1H)ppm;13C NMR(125 MHz, CDCl3)δ 192.3, 155.4(d, J=8.82 Hz), 155.3, 153.4, 153.3(d, J=12.5 Hz), 151.7(d, J=12.5 Hz), 151.6, 149.7(d, J=12.5 Hz), 149.6, 141.4, 137.3, 134.1, 131.3, 129.1, 128.6(q, J=3.75 Hz), 127.6, 126.9, 126.4, 123.6, 122.6, 120.4, 120.3(d, J=12.5Hz), 117.8, 117.7(d, J=12.5 Hz)ppm.HRMS(ESI)calcd for[C16H9F2NO+H]+2269.065 2, found 269.065 0.
(3-氯苯基)(1-异喹啉基)甲酮(3u):白色固体; mp: 74-75℃; yield: 60%.1H NMR(300 MHz, CDCl3)δ=8.74(d, J=9Hz, 1H), 8.54(d, J=3Hz, 1H), 7.93(d, J=6Hz, 1H), 7.83-7.71(m, 5H), 7.48-7.40(m, 3H)ppm;13C NMR(125 MHz, CDCl3)δ 196.5, 154.9, 141.7, 139.5, 137.4, 132.9, 132.7, 131.4,131.0,130.5,129.4, 127.5, 127.3, 126.8, 126.8, 124.3 ppm.HRMS(ESI)calcd for[C16H10ClNO+H]+268.052 4,found 268.052 7.
苯基(2-喹氧林基)甲酮(3v):白色固体;mp: 84-85℃;yield: 62%.1H NMR(300 MHz, CDCl3)δ=9.50(s, 1H), 8.23(t, J=9Hz, 4H), 7.94-7.85(m, 2H), 7.68(t, J=9Hz, 1H), 7.55(t, J=9Hz, 2H)ppm;13C NMR(125 MHz, CDCl3)δ 192.4, 148.6, 145.3, 143.2, 140.4, 135.5, 133.7, 132.1, 131.3, 130.9, 130.5, 129.4, 128.4 ppm.HRMS(ESI)calcd for[C15H10NO+H]+235.086 6, found 235.086 3.
(4-甲氧基苯基)(8-甲基喹啉-2-基)甲酮(3w):白色固体; mp: 101-102℃; yield: 71%.1H NMR(300 MHz, CDCl3)δ=8.44(d, J=9Hz, 2H), 8.30(d, J=9Hz, 1H), 8.14(d, J=9Hz, 1H), 7.73(d, J=6Hz, 1H), 7.63(d, J=6Hz, 1H), 7.54(t, J=9Hz, 1H), 7.00(d, J=9Hz, 2H)ppm;13C NMR(125 MHz, CDCl3)δ 192.2, 163.9, 154.2, 139.1, 137.6, 134.6, 129.7, 129.3, 128.5, 125.9, 120.9, 113.6, 55.9, 18.4 ppm.HRMS(ESI)calcd for[C18H15NO2+H]+278.117 6, found 278.117 3.
(8-甲基喹啉-2-基)(3,4,5-三甲氧基苯基)甲酮(3x):白色固体; mp: 140-141℃; yield: 65%.1H NMR(300 MHz, CDCl3)δ=8.32(d, J=9Hz, 1H), 8.16(d, J=9Hz, 1H), 7.75(d, J=9Hz, 3H), 7.65(d, J=6Hz, 1H), 7.56(t, J=6Hz, 1H)ppm;13C NMR(125 MHz, CDCl3)δ 192.2, 154.0, 153.0, 146.1, 142.9, 138.8, 137.9, 131.7, 130.6, 129.4, 128.7, 126.0, 121.3, 109.8, 61.41, 56.7, 18.6 ppm.HRMS(ESI)calcd for[C20H19NO4+H]+338.138 7, found 338.138 3.
(7-溴喹啉-2-基)(4-甲氧基苯基)甲酮(3y):白色固体; mp: 122-123℃; yield: 54%.1H NMR(300 MHz, CDCl3)δ=8.41-7.26(m, 1H), 7.08(d, J=9Hz, 1H), 7.80-7.75(m, 2H), 7.26(s, 1H), 7.00(d, J=9Hz, 2H)ppm;13C NMR(125 MHz, CDCl3)δ 192.2, 164.3, 156.7, 147.6, 137.4, 134.3, 133.1, 132.1, 129.3, 129.1, 127.7, 124.6, 121.7, 113.9, 55.9 ppm.HRMS(ESI)calcd for[C17H12BrNO2+H]+342.012 4, found 342.012 1.
(7-溴喹啉-2-基)(苯基)甲酮(3z):白色固体; mp: 123-124℃; yield: 66%.1H NMR(300 MHz, CDCl3)δ=8.40(s, 1H), 8.33(d, J=9Hz, 1H), 8.22(d, J=9Hz, 2H), 8.12(d, J=9Hz, 1H), 7.80-7.73(m, 2H), 7.64(t, J=6Hz, 2H), 7.52(t, J=6Hz, 2H)ppm; 13C NMR(125 MHz, CDCl3)δ 193.8, 155.8, 147.7, 137.5, 136.3, 133.7, 133.2, 132.3, 131.8, 129.3, 128.6, 127.9, 124.7, 121.7 ppm.HRMS(ESI)calcd for[C16H10BrNO+H]+312.001 9, found 312.001 4.

