桔梅奇酵母液体制剂的制备及其在柑橘果实上的应用
陈力维,张鸿雁,邓丽莉,2,曾凯芳,3
桔梅奇酵母液体制剂的制备及其在柑橘果实上的应用
陈力维1,张鸿雁1,邓丽莉1,2,曾凯芳1,3※
(1. 西南大学食品科学学院,重庆 400715;2. 西南大学食品贮藏与物流研究中心,重庆 400715;3. 国家柑桔工程技术研究中心,重庆 400712)
桔梅奇酵母是分离自柑橘果园叶面的新种酵母,可有效控制柑橘果实采后青霉病、绿霉病和酸腐病,前景广阔且可替代化学杀菌剂。但生物防治剂效果不稳定、生防作用机制不明确等因素导致拮抗酵母商业化应用的成功率较低。因此开发货架期较长且防治效果稳定的拮抗酵母生物制剂是实现桔梅奇酵母商业化的关键。该研究以桔梅奇酵母为研究对象,制备以桔梅奇酵母为主要活性成分的液体制剂,并探究制剂对柑橘果实采后主要病害的控制效果。结果表明:经单因素试验和响应面优化试验得到的保护剂配方:海藻糖19.74%、谷氨酸钠1.05%、吐温80 4.24%、脯氨酸1.11%对酵母的保护效果最好,酵母存活率可从5.02%提高到54.96%。贮藏稳定性试验表明,当温度低于10 ℃时,在贮藏30 d后酵母存活率仍大于60%,适当降低温度有利于延长制剂的货架期。离体试验发现,与新鲜酵母相比,液体制剂对柑橘采后病原菌的抑制作用无显著变化(>0.05),抑菌圈可达到12 mm以上。在柑橘果实上能够有效控制柑橘果实采后青霉病、绿霉病、酸腐病和炭疽病,可将发病率降低25.00%~48.33%。综上,对桔梅奇酵母进行制剂化处理后能够有效保留其细胞活力和生防效力,以桔梅奇酵母为主要活性成分制备的液体制剂对柑橘采后病害具有良好的控制效果。
农产品;采后病害;桔梅奇酵母;柑橘;生物防治
0 引 言
柑橘果实采后贮藏期间极易受病原菌侵染,造成产业重大经济损失。目前,主要通过使用化学杀菌剂来控制采后病害[1]。然而,化学杀菌剂易使病原菌产生抗性,且不易降解,同时对人体和环境造成危害,因此现阶段,开发出一种能替代化学杀菌剂的安全且环保的控病方法迫在眉睫[2]。据报道,梅奇酵母属菌株——核果梅奇酵母成功实现商业化应用,将其活菌体作为有效成分的产品Shemer是目前仍在生产销售的BCAs产品[3]。桔梅奇酵母是本实验室分离自柑橘果园叶面的新种酵母,前期研究结果表明其对柑橘果实采后绿霉病和酸腐病均有较好的控制效果[4-5]。
由于外部环境因素的胁迫影响,常导致酵母活力下降甚至死亡。生物防治剂作为活菌制剂,开发制备的前提条件是确保酵母制剂能够维持或接近鲜酵母的生活力[6]。液体制剂具有制备工艺简单、生产成本低、使用方便等优点,经济实用[7-8]。添加保护剂是提高酵母存活率的有效手段。糖类保护剂是常见的保护剂之一,其中二糖的保护作用普遍较好[9]。研究表明细胞内源性化合物,如糖醇类、海藻糖等的积累可以提高菌体在胁迫环境下的耐受性[10-11]。微生物在环境胁迫作用下酵母细胞内会积累大量活性氧,导致严重的氧化损伤[12],抗氧化剂的加入可以有效保护菌体免受氧化胁迫影响。乳化剂可以有效防止溶液中不溶物质的絮凝作用,可维持液体体系的稳定性[13-14]。此外,拮抗酵母的生防效力也是生防制剂开发过程中需考虑的因素,拮抗微生物与其他化学物质的联合使用是提高生防效力、增强抗应激能力的有效途径之一[15],包括钙离子、抗坏血酸、碳水化合物以及其他化学物质[16-18]。脯氨酸是一种细胞保护剂,能够诱导生物膜形成,提高细胞活力[19-20]。氯化钙作为一种高效、安全的食品添加剂已被用于控制果实采后病害,Wang等[18]将氯化钙与酵母联合使用时发现能够提高酵母生防效果。
本文以桔梅奇酵母为研究对象,将其制备成液态的生防制剂。通过添加保护剂以提高酵母菌悬液在贮藏过程的存活率,并研究了液体制剂的贮藏条件,及在离体条件下对柑橘果实采后病原菌的拮抗作用,最后在采后柑橘果实上进行实际应用,以期为柑橘生防制剂商业化提供理论基础。
1 材料与方法
1.1 菌种与试剂
供试酵母菌:桔梅奇酵母()由本实验室筛选和保存的桔梅奇酵母FL01株系,并保藏于中国工业微生物菌种保藏管理中心,保藏号为CICC NO.33213。
病原菌:青霉菌()、绿霉菌()、酸腐菌()和炭疽菌()为本实验室保藏菌种。上述病原菌分别在PDA培养基上、4 ℃条件下保藏,每两个月活化一次。
酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD):酵母浸粉10 g,葡萄糖20 g,蛋白胨20 g,琼脂粉10 g,蒸馏水1 L。
马铃薯葡萄糖琼脂培养基(Potato Dextrose Medium,PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,1 L蒸馏水,121 ℃灭菌15 min。
海藻糖(分析纯)购自上海泰坦科技股份有限公司;L-抗坏血酸、阿拉伯树胶(均为分析纯)购自重庆跃翔化工有限公司;乳糖、吐温80、氯化钙、谷氨酸钠(均为分析纯)购自重庆市钛新化工有限公司;脯氨酸(分析纯)购自重庆择物生物科技有限公司。
1.2 仪器与设备
BXM30R立式高压灭菌锅,上海博讯实业有限公司医疗设备厂;SW-CJ-1F超净工作台,苏净集团安泰有限公司;DHP-9082电热恒温培养箱,上海齐欣科学仪器有限公司;AvantiTM J-30I高速冷冻离心机,美国Beckman有限公司。
1.3 方法
1.3.1 保护剂及保护剂悬浮液的制备
试验中所使用的保护剂包括:糖类保护剂,抗氧化剂,乳化剂,增效剂。所有保护剂按比例溶解到0.05 mol/L磷酸盐缓冲溶液(Phosphate Buffered Solution,PBS)中以制备保护剂溶液,使得最后与酵母悬浮液混合后浓度与试验方案中浓度一致。
1.3.2 保护剂的单因素试验
根据微生物制剂的研究进展,本研究所选的四类保护剂是目前对维持微生物菌株活性保护效果较好的。试验浓度结合了文献报道以及本课题组前期研究结果。
糖类保护剂:选择海藻糖、乳糖作为保护剂进行单因素试验,试验浓度包含1%、5%、10%、15%、20%五个梯度;
抗氧化剂:选择抗坏血酸、谷氨酸钠作为抗氧化剂进行单因素试验,试验浓度包含0.05%、0.1%、0.5%、1%、2%五个梯度;
乳化剂:选择吐温80、阿拉伯树胶作为乳化剂进行单因素试验,试验浓度包含2.5%、5%、7.5%、10%四个梯度;
增效剂:选择脯氨酸、氯化钙作为增效剂进行单因素试验,试验浓度包含0.5%、1%、2%、5%四个梯度。
以上单因素试验以0.05 mol/L PBS缓冲溶液作为对照,于25 ℃条件下保存7 d后测定酵母存活率。试验重复3次。
1.3.3 保护剂的Box-Behnken响应面优化试验
基于保护剂的单因素试验结果,使用海藻糖、谷氨酸钠、吐温80、脯氨酸进行四因素四水平的Box-Behnken响应面优化试验,试验因素水平如表1所示。
1.3.4 酵母存活率的测定
采用稀释平板菌落计数法[21],将稀释到合适浓度的酵母涂布在YPD平板上,在28 ℃培养箱中培养48 h。试验重复3次。酵母存活率用酵母活菌数初始值(0)以及保存7 d后酵母活菌数(N)来表示,用如下公式计算酵母存活率:
存活率=(N/0)×100% (1)

表1 桔梅奇酵母液体保护剂Box-Behnken试验因素水平表
1.3.5 贮藏期酵母存活率的测定
将酵母液体制剂分装后,密封保存,分别在-20、4、10、18、25、37 ℃条件下贮藏。贮藏第0天酵母的菌落总数计为0。贮藏后酵母的菌落总数计为N。每隔15 d测定一次,根据式(1)计算存活率。
1.3.6 桔梅奇酵母液体制剂对柑橘果实采后主要病害病原菌的平板对峙试验
参照Parafati等[22]的方法,取10L 1×108CFU/mL新鲜.菌悬液、1×108CFU/mL液体制剂稀释液,均匀涂布在PDA平板的中轴线上,在中轴线两侧接种5L 5×105个/mL.、.、.孢子悬浮液或生长5 d的.-的菌饼,以只接种病原菌的平板作为对照,25 ℃培养8 d后记录病原菌菌丝生长情况,以及色素圈大小。
1.3.7 桔梅奇酵母在柑橘果实伤口处的生长动态
用无菌打孔器在果实赤道部位等距打四个孔(深3 mm,直径3 mm)。每个伤口处接种20L新鲜酵母或酵母液体制剂。待菌液吸收后,果实用聚乙烯薄膜袋(170 mm× 140 mm)单果包装,放置于25 ℃、相对湿度85%~90%的环境条件下。每天取样测定伤口处酵母细胞数量。结果以每个伤口组织鲜重中酵母细胞的数量来表示,单位为CFU/wound。
1.3.8 桔梅奇酵母液体制剂对柑橘果实采后主要病害的控制效果
果实伤口打孔方法同1.3.7。每个伤口接种20L如下处理液:无菌水;新鲜.(1×108CFU/mL);液体制剂最优配方保护剂;液体制剂稀释液(1×108CFU/mL)。4 h后,再在每个孔接种10L、1×105个/mL的.或.,或10L、1×106个/mL的.-或.。每个处理3个平行,每个平行10个果实。待菌液吸收后,单果包装,贮藏在25℃、相对湿度85%~90%的环境下。每天统计发病率(Disease Incidence,DI)和病斑直径(Lesion Diameter,LD),计算公式如下
DI=(伤口腐烂的数量/伤口数)×100% (2)
LD=(病斑横向直径+病斑纵向直径)/2 (3)
1.4 数据分析
以上指标均取3个平行样品,重复测定3次。Excel 2018统计分析数据,Design-Expert 8.0.6(Minneapolis,MN 55413)进行响应面优化设计及分析,运用OriginPro 9.0.0(Northampton,MA 01060 USA)绘制图表,应用SPSS 23.0(SPSS Inc.,Chicago,IL,USA)对数据进行差异显著性分析和相关性分析。
2 结果与分析
2.1 保护剂的单因素筛选试验
如图1a所示,没有添加保护剂时制剂中菌体存活率为5.02%,糖类保护剂加入后能够提高酵母存活率,随着海藻糖浓度的升高,酵母存活率呈现先上升后下降的趋势,其中,15%的海藻糖的保护效果较好,菌体存活率可达到11.37%。
抗氧化剂的筛选结果如图1b所示,谷氨酸钠的保护效果最好,随着谷氨酸钠浓度的升高,酵母存活率先上升后下降,1%的谷氨酸钠对酵母的保护作用最好,菌体存活率最高可达10.36%。而高于1%的抗坏血酸促进酵母细胞死亡,使存活率低于对照组。
图1c中结果表明,吐温80对桔梅奇酵母的保护作用优于阿拉伯树胶,其存活率可达到40%左右。随着加入吐温80浓度的增加,当浓度大于5%时,继续增加吐温80浓度并未显著提高酵母存活率。
如图1d所示,随着脯氨酸浓度的升高,酵母存活率先升高后降低,1%的脯氨酸对酵母细胞的保护最好,菌体存活率为9.69%。而氯化钙的加入不利于酵母的存活,其原因可能是氯化钙作为一种盐溶液,酵母长期保存在该溶液中时,蛋白质易发生变性,导致酵母死亡。
2.2 保护剂的响应面优化试验
根据单因素试验结果,采用四因素三水平法进行进一步优化,试验设计及结果如表2所示。
利用Design Expert软件对上述结果进行响应面分析,去掉不显著因子,二次拟合得到多元二次方程如下
=59.39-4.37-4.29+7.65-7.15-7.85
-9.092-6.372-6.302-10.682(4)
式中为制剂中酵母存活率的预测值,、、、分别为编码的自变量海藻糖、谷氨酸钠、吐温80、脯氨酸。
如表3所示,采用方差分析(ANOVA)检验显著性水平,模拟二次多项模型,模型的值为8.75(<0.01)是极显著的,失拟的值为5.55(=0.057)是不显著的,因此模型有效。三维响应面图和二维等高线图能够更直观地反映方差分析结果。图2a所示为海藻糖和脯氨酸对酵母存活率的影响,响应面对应的等高线图为椭圆形,说明海藻糖和脯氨酸对酵母存活率有相互影响,且影响显著(<0.05),图2b和图2c分别为谷氨酸钠和脯氨酸、吐温80和脯氨酸之间的相对互作用,均对酵母存活率的影响显著。
利用Design Expert软件对回归方程进行分析,响应面优化得到的最佳保护剂配方为:19.74%海藻糖、1.05%谷氨酸钠、4.24%吐温80、1.11%脯氨酸,液体制剂在25 ℃条件下保存7 d后桔梅奇酵母的存活率可达到53.75%。应用该保护剂配方,验证结果,得到的液体制剂中酵母存活率为54.96%(=3),与预测值相近。与对照(5.02%)相比,经响应面优化后酵母存活率提高了49.94%。
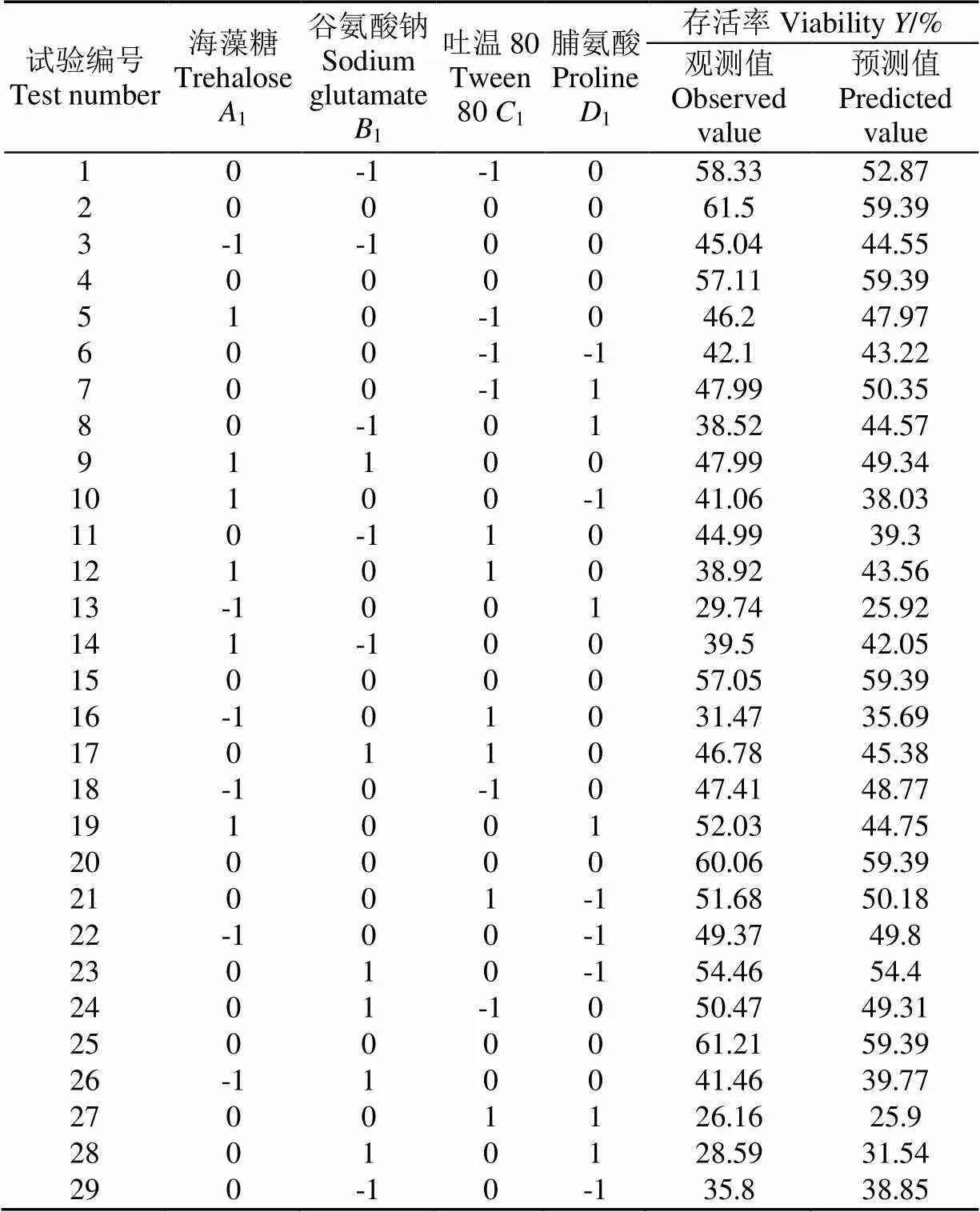
表2 桔梅奇酵母液体保护剂Box-Behnken试验设计及结果
注:1、1、1、1为、、、的编码值。
Note:1,1,1,1are code of,,,.
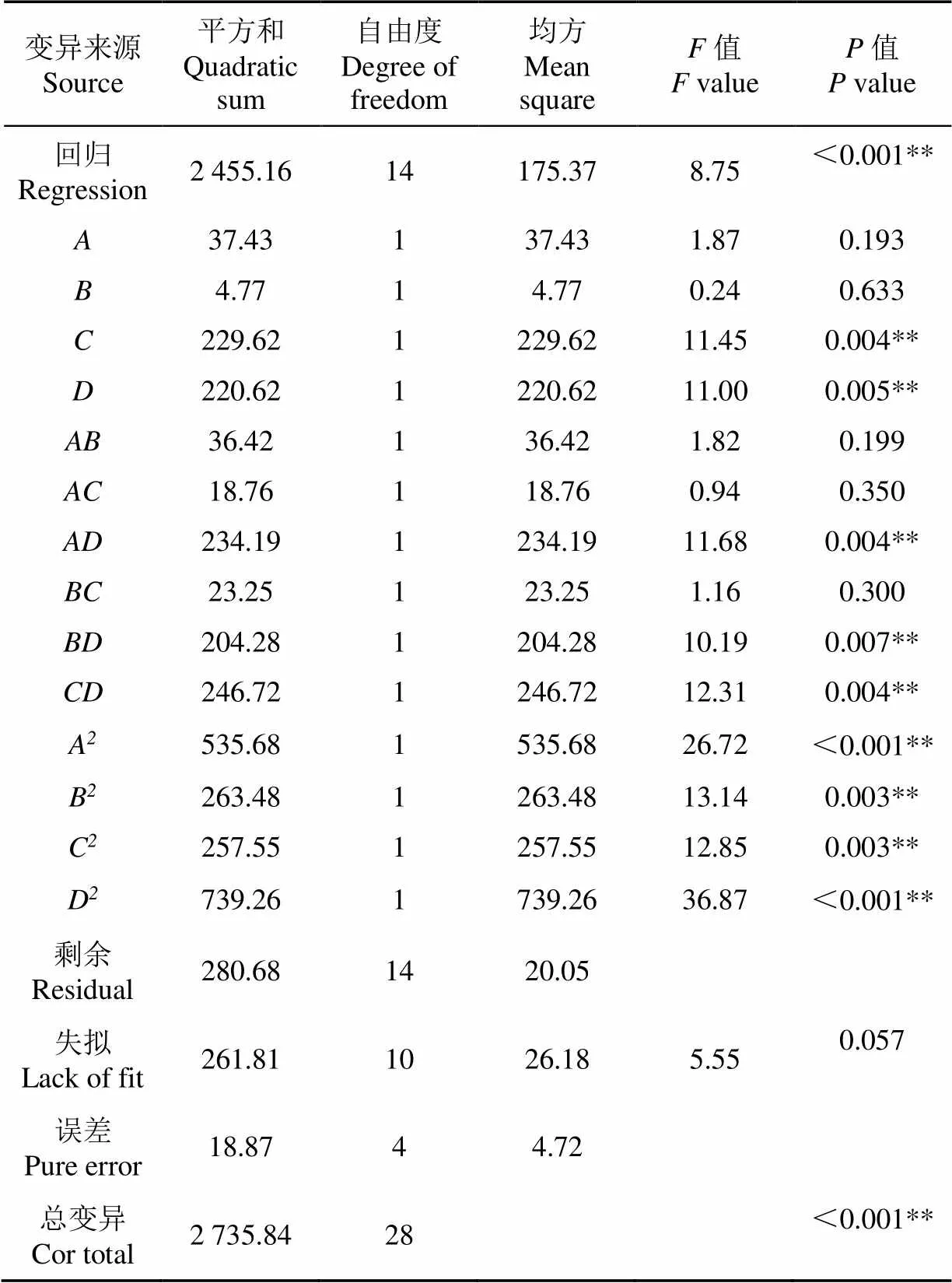
表3 二次多项模型的方差分析
注:“**”表示差异极显著(<0.01);“*”表示差异显著(<0.05)。
Note: “**”means difference was very significant (< 0.01); “*” means difference was significant (< 0.05).
2.3 不同温度条件下桔梅奇酵母液体制剂贮藏稳定性试验
不同温度条件下,液体制剂贮藏过程中酵母存活率的变化情况如图3所示。在贮藏过程中,酵母存活率均有不同程度的下降,随着贮藏温度的降低,酵母存活率下降幅度减缓。在贮藏30 d后,制剂在18和25 ℃贮藏后,酵母几乎全部死亡,而温度低于10 ℃时,酵母存活率仍大于60%,降低贮藏温度有利于维持酵母活性,延长液体制剂货架期。当温度为-20 ℃时,制剂的货架期可以达到90 d以上。
2.4 桔梅奇酵母液体制剂对柑橘果实采后主要病害病原菌的平板对峙试验
如图4a所示,液体制剂中的酵母与新鲜酵母对.、.、.-的菌丝生长均存在不同程度的抑制效果,能够产生较明显的抑菌圈,且抑菌圈大小大于12 mm,与新鲜酵母相比,液体制剂分别和这三种病原菌共培养时产生的抑菌圈大小均无显著性差异,酵母对.菌丝生长无显著抑制作用。
当酵母分别与四种病原菌共培养时,酵母均可产生红色色素带,其宽度如图4b所示,其中,与新鲜酵母相比,液体制剂中的酵母与.共培养时产生了更宽的色素带,说明液体制剂保护剂可促进此时的酵母产生更多色素。液体制剂中的酵母与其余三种病原菌共培养时色素带与新鲜酵母相比无显著性差异。
2.5 桔梅奇酵母在柑橘果实伤口处的生长动态
在25 ℃条件下,液体制剂中的桔梅奇酵母及新鲜酵母在果实伤口处的生长动态如图5所示。酵母在果实伤口处的动态变化呈现先急速增加,后缓慢下降的趋势。接种后0~1 d内,酵母数量迅速增加,接种后第3天酵母数量达到最大值,9.00×106CFU。接种第6天后,酵母数量略有下降。与新鲜酵母相比,液体制剂中的酵母在果实伤口处数量无显著差异。
2.6 桔梅奇酵母液体制剂对柑橘果实采后主要病害的控制效果
在图6、图7所示贮藏过程中,接种酵母后,可有效降低果实绿霉病、青霉病、酸腐病及炭疽病的发病率,液体制剂处理的柑橘果实发病率与新鲜酵母处理组的无显著差异,二者均低于对照组,且与之存在显著性差异(<0.05)。液体制剂处理后,四种病害的病斑直径与新鲜酵母处理组相比均无显著性差异,且都显著低于对照组(<0.05),可使发病率降低25.00%~48.33%。
以上结果显示,进行制剂化处理后能够有效保留桔梅奇酵母的细胞活力和生防效力,能够有效抑制柑橘果实中绿霉病、青霉病、酸腐病及炭疽病的发生和发展。
3 讨 论
活体微生物易受到环境因素和加工过程的影响而失活,为实现活菌制剂中微生物较高的存活率,添加适宜的保护剂是一种可行的解决方案[2]。有研究表明海藻糖有助于菌体抵御因外界环境温度变化引起的细胞膜损伤[23-25]。对糖类保护剂的筛选结果表明,海藻糖对.的保护效果最好。李侨飞[26]发现在液体制剂中,添加2.5%的海藻糖后对酵母的生长有明显促进作用。唐飞等[27]在单独使用海藻糖作为保护剂时可使海洋酵母存活率达到42%,而对照仅为3%。抗坏血酸、谷氨酸钠是食品工业中常用的抗氧化剂。其中谷氨酸钠可以通过抑制三酰甘油的氧化和自由基的形成来防止氧化带来的细胞膜不可逆损伤,从而达到保护菌体的作用[28]。对抗氧化剂的筛选结果表明谷氨酸钠对桔梅奇酵母的保护作用较好,Sun等[29-30]发现添加谷氨酸钠可使干燥后的植物乳杆菌菌体存活率达到85.12%。吐温80作为非离子型表面活性剂,可以吸附在菌体表面,改变菌体表面的亲疏水性[30]。John等[31]的研究表明表面活性剂对苜蓿根瘤菌菌悬液的均匀悬浮和稳定性起着重要作用。脯氨酸是一种细胞保护剂,能够诱导生物膜形成,提高细胞活力[19-20]。我们对增效剂的筛选结果显示,脯氨酸对.菌体的兼容性更好,不会对菌体造成不良影响,能够维持酵母较高的存活率。有研究表明,单一保护剂微生物菌体的保护作用有限,保护剂的复配可进一步提高菌体存活率[32]。在本文中,经过响应面优化试验后得到了.液体制剂保护剂的组成为海藻糖19.74%、谷氨酸钠1.05%、吐温80 4.24%、脯氨酸1.11%,可使酵母存活率提高至54.96%,这与吴锋[32]的研究结果类似。
良好的贮藏稳定性是制剂进行商业化应用的必要条件,较长的货架期使制剂保持较高的经济价值。实现这一目标可以通过优化配方、包装以及存储条件等途径来实现[33]。从图3发现降低贮藏温度更有利于液体制剂的储藏稳定。Melin等[23]研究发现毕赤酵母液体制剂在4 ℃条件下细胞活力最高,而且在常温和高温下制剂保存时间更短。由于在液体状态下,菌体更易受到氧化胁迫等作用导致制剂的货架期相对较短,降低贮藏温度、改变制剂配方是进一步提高菌体贮藏稳定性的主要途径。为了解液体制剂对柑橘果实采后主要病害的控制效果,在离体条件下,与新鲜酵母相比,液体制剂中的酵母分别与病原菌共培养时,抑菌圈和色素圈大小均无显著性差异,说明制剂的主要活性成分没有被破坏,仍可实现对柑橘采后病害的控制作用。在柑橘果实上,新鲜酵母对柑橘果实青、绿霉病,酸腐病和炭疽病均有显著的控制效果,这与实验室前期研究结果一致[5,34],说明酵母在控制柑橘采后病害的巨大应用潜力。
4 结 论
通过对桔梅奇酵母液体制剂保护剂进行筛选和优化,得到其最佳配方为海藻糖19.74%、谷氨酸钠1.05%、吐温80 4.24%、脯氨酸1.11%,在25 ℃条件下存放7 d后酵母存活率可从5.02%提高到54.96%。在10℃条件下贮藏30 d后,酵母存活率仍可达60%以上。将酵母进行制剂化处理后,在离体和在柑橘果实上均能够有效保留桔梅奇酵母的细胞活力和生防效力,对柑橘绿霉病、青霉病、酸腐病和炭疽病有显著控制效果。综上,本试验以桔梅奇酵母为主要活性成分制备的液体制剂对柑橘采后病害具有良好的控制效果,能够应用于柑橘果实采后病害的生物防治。
[1] 陈山乔,李丹丹,贾丽娜,等. 柑橘内在品质评价及保鲜技术研究进展[J]. 包装工程,2021,42(7):45-53.
Chen Shanqiao, Li Dandan, Jia Lina, et al. Research progress in evaluation methods and maintenance techniques of lnner citrus quality[J]. Packaging Engineering, 2021, 42(7): 45-53. (in Chinese with English abstract)
[2] Authority E F S. Conclusion on the peer review of the pesticide risk assessment of the active substancestrain O[J]. EFSA Journal, 2012, 10(11): 2944.
[3] Droby S, Wisniewski M, Teixido N, et al. The science, development, and commercialization of postharvest biocontrol products[J]. Postharvest Biology and Technology, 2016, 122: 22-29.
[4] Wang S, Ruan C, Yi L, et al. Biocontrol ability and action mechanism ofagainst-causing sour rot of postharvest citrus fruit[J]. Food Microbiology, 2020, 87: 103375.
[5] Liu Y, Wang W, Zhou Y, et al. Isolation, identification and in vitro screening of Chongqing orangery yeasts for the biocontrol ofon citrus fruit[J]. Biological Control, 2017, 110: 18-24.
[6] Mukherjee A, Verma J P, Gaurav A K, et al. Yeast a potential bio-agent: Future for plant growth and postharvest disease management for sustainable agriculture[J]. Applied Microbiology and Biotechnology, 2020, 104(4): 1497-1510.
[7] Liu J, Sui Y, Wisniewski M, et al. Review: Utilization of antagonistic yeasts to manage postharvest fungal diseases of fruit[J]. International Journal of Food Microbiology, 2013, 167(2): 153-160.
[8] De Corato U, Salimbeni R, De Pretis A, et al. Use of alginate for extending shelf life in a lyophilized yeast-based formulate in controlling green mould disease on citrus fruit under postharvest condition[J]. Food Packaging and Shelf Life, 2018, 15: 76-86.
[9] Santivarangkna C, Higl B, Foerst P. Protection mechanisms of sugars during different stages of preparation process of dried lactic acid starter cultures[J]. Food Microbiology, 2008, 25(3): 429-441.
[10] Torres R, Usall J, Teixido N, et al. Liquid formulation of the biocontrol agentby modifying water activity or adding protectants[J]. Journal of Applied Microbiology, 2003, 94(2): 330-339.
[11] Magalhaes R S S, Popova B, Braus G H, et al. The trehalose protective mechanism during thermal stress in: the roles of Ath1 and Agt1[J]. Fems Yeast Research, 2018, 18(6): 1-10.
[12] Sui Y, Wisniewski M, Droby S, et al. Responses of yeast biocontrol agents to environmental stress[J]. Applied and Environmental Microbiology, 2015, 81(9): 2968-2975.
[13] 李强. 一株防治水果采后病害拮抗酵母的分离、鉴定及制剂研究[D]. 镇江:江苏大学,2014.
Li Qiang. Resarches on Isolation, Identification and Biocontrol Efficacy of an Antagonistic Yeast and its Emulsification[D]. Zhenjiang: Jiangsu University, 2014. (in Chinese with English abstract)
[14] 郑国斌,俞学锋,李知洪,等. 一种布拉迪活性干酵母及生产方法: CN103374531A[P]. 2012-04-27.
[15] 李侨飞,张红印,杨其亚,等. 防治水果病害的生防酵母及生防制剂研究进展[J]. 食品科学,2018,39(1):291-296.
Li Qiaofei, Zhang Hongyin, Yang Qiya, et al. Progress in biocontrol yeast agents for preventing and treating diseases of fruits[J]. Food Science, 2018, 39(1): 291-296. (in Chinese with English abstract)
[16] Qiu X, Zhang J, Zhou J, et al. Stress tolerance phenotype of industrial yeast: industrial cases, cellular changes, and improvement strategies[J]. Applied Microbiology and Biotechnology, 2019, 103(16): 6449-6462.
[17] Gramisci B R, Cecilia Lutz M, Lopes C A, et al. Enhancing the efficacy of yeast biocontrol agents against postharvest pathogens through nutrient profiling and the use of other additives[J]. Biological Control, 2018, 121: 151-158.
[18] Wang Y, Ren X, Song X, et al. Control of postharvest decay on cherry tomatoes by marine yeastand calcium chloride[J]. Journal of Applied Microbiology, 2010, 109(2): 651-656.
[19] Liu Y, Yi L, Ruan C, et al. Proline increases pigment production to improve oxidative stress tolerance and biocontrol ability of[J]. Frontiers in Microbiology, 2019, 10: 1273.
[20] Tsolmonbaatar A, Hashida K, Sugimoto Y, et al. Isolation of baker's yeast mutants with proline accumulation that showed enhanced tolerance to baking-associated stresses[J]. International Journal of Food Microbiology, 2016, 238: 233-240.
[21] 食品安全国家标准. 食品微生物学检验霉菌和酵母计数:GB 4789. 15—2016[S]. 北京:中国标准出版社,2016.
[22] Parafati L, Vitale A, Restuccia C, et al. Biocontrol ability and action mechanism of food-isolated yeast strains againstcausing post-harvest bunch rot of table grape[J]. Food Microbiology, 2015, 47: 85-92.
[23] Melin P, Hakansson S, Schnurer J. Optimisation and comparison of liquid and dry formulations of the biocontrol yeastJ121[J]. Applied Microbiology and Biotechnology, 2007, 73(5): 1008-1016.
[24] 张云光,岳田芳,梁莲华,等. 海藻糖在微生态制剂中的应用[J]. 广西轻工业,2010,26(8):4-6.
Zhang Yunguang, Yue Tianfang, Liang Lianhua, et al. Application of trehalose in microecological preparations[J], Light Industry Science and Technology, 2010, 26(8): 4-6. (in Chinese with English abstract)
[25] Cray J A, Stevenson A, Ball P, et al. Chaotropicity: A key factor in product tolerance of biofuel-producing microorganisms[J]. Current Opinion in Biotechnology, 2015, 33: 228-259.
[26] 李侨飞. 拟粉红锁掷孢酵母Y16控制葡萄采后病害及其机制和制剂化研究[D]. 镇江:江苏大学,2017.
Li Qiaofei. Biocontrol of Postharvest Diseases of Table Grapes byY 16 and Study on its Mechanism and Preparation[D]. Zhenjiang: Jiangsu University, 2017. (in Chinese with English abstract)
[27] 唐飞,王一非,齐学明,等. 冷冻保护剂和储藏条件对海洋酵母冻干粉活性的影响[J]. 食品与发酵工业,2012,38(2):33-38.
Tang Fei, Wang Yifei, Qi Xueming, et al. Effects of cryoprotectants and storage conditions on the survivial and biocontrol-activity of freeze-dried[J]. Food and Fermentation Industries, 2012, 38(2): 33-38. (in Chinese with English abstract)
[28] Polomska X, Wojtatowicz M, Zarowska B, et al. Freeze-drying preservation of yeast adjunct cultures for cheese production[J]. Polish Journal of Food and Nutrition Sciences, 2012, 62(3): 143-150.
[29] 侯同刚,张跃冬,陈秀芳,等. 非离子表面活性剂对生物丁醇发酵的影响[J]. 生物工程学报,2014,30(5):784-792.
Hou Tonggang, Zhang Yuedong, Chen Xiufang, et al. Effect of non-ionic surfactants on butanol production withATCC 824[J]. Chinese Journal of Biotechnology, 2014, 30(5): 784-792. (in Chinese with English abstract)
[30] Sun H, Hua X, Zhang M, et al. Whey protein concentrate, pullulan, and trehalose as thermal protective agents for increasing viability ofstarter by spray drying[J]. Food Science of Animal Resources, 2020, 40(1): 118-131.
[31] John R P, Tyagi R D, Brar S K, et al. Development of emulsion fromfermented starch industry wastewater for application asseed coat[J]. Engineering in Life Sciences, 2010, 10(3): 248-256.
[32] 吴锋. 膜醭毕赤酵母Y4对桃果采后软腐病的控制及其制剂化研究[D]. 镇江:江苏大学,2019.
Wu Feng. Study on the Biological Control of Postharvest Disease of Peaches byY4 and the Preparation of the Yeast[D]. Zhenjiang: Jiangsu University, 2019. (in Chinese with English abstract)
[33] Gotor-Vila A, Usall J, Torres R, et al. Formulation of the biocontrol agentCPA-8 using different approaches: liquid, freeze-drying and fluid-bed spray-drying[J]. Biocontrol, 2017, 62(4): 545-555.
[34] 刘椰. 拮抗酵母新种鉴定及其对柑橘果实采后主要病害的防治机理研究[D]. 重庆:西南大学,2019.
Liu Ye. Identification of a Novel Antagonistic Yeast Species and its Mechanisms in Yeast Species and its Mechanisms in Diseases of Citrus Fruit[D]. Chongqing: Southwest University, 2019. (in Chinese with English abstract)
Preparation and application of liquid bioformulation ofon citrus fruits
Chen Liwei1, Zhang Hongyan1, Deng Lili1,2, Zeng Kaifang1,3※
(1.,,400715,; 2.,,400715,; 3.,400712,)
Antagonistic yeast has widely expected to replace chemical fungicides, serving as an effective biological agent to control postharvest diseases of citrus., a new species ofspp, isolated from citrus leaves and identified laboratory, was efficient to control postharvest green mold and sour rot caused byandon citrus fruit, indicating great application and development value. However, the unstable effect of biocontrol agents and the unclear mechanism of biocontrol have led to a low success rate of commercial application of antagonistic yeast. Therefore, it is highly urgent to develop the antagonistic yeast biological agents with long shelf life and stable control effect for the commercialization of. In this study, an attempt was made to explore the preparation of liquid bioformulation withas the main active ingredient. Single factor and response surface tests were carried out to optimize the formulation of the protective agent for liquid bioformulation. An in vitro and in vivo test was also conducted to further evaluate the control effect of formulation on the main postharvest diseases of citrus fruits, particularly for the application of liquid preparation. The results showed that four protective agents were screened via a single factor test, including trehalose, sodium glutamate, Tween 80, and proline. The formula of the protective agent was selected: trehalose 19.74%, sodium glutamate 1.05%, Tween 80 4.24%, proline 1.11%, where the best protective effect on, and the survival rate of yeast increased from 5.02% to 54.96%. The storage stability of liquid bioformulation showed that the survival rate ofwas still more than 60% after 30 days of storage when the temperature was lower than 10 ℃. More importantly, the shelf life of preparation reached more than 90 days, when the storage temperature was -20 ℃. As such, a relatively low storage temperature was beneficial to the longer shelf life of bioformulation. In vitro and fruit tests were carried out to verify the application effect of preparation. It was found that there was no significant change in the inhibitory effect of liquid bioformulation on postharvest pathogen and pigment production capacity of, compared with fresh yeast, where the inhibition zone reached more than 8 mm. There was also no significant difference in the number of fresh and liquid yeast at the fruit wound, both of which grew well at the wound. Fresh yeast performed remarkable control effects on blue and green mold, sour rot, and anthrax on citrus fruits, while liquid preparation presented no significant difference, compared with fresh yeast. Specifically, the formulation reduced the incidence of four citrus postharvest diseases by 25.00%-48.33%. Consequently, the preparation ofcan widely be expected to effectively retain cell viability and biocontrol efficacy. The liquid bioformulation withas the main active ingredient demonstrated an excellent control effect on postharvest citrus diseases. The finding can provide strong theoretical and practical support to the application ofin the biological control of postharvest citrus diseases.
Agricultural products; postharvest disease;; citrus; biological control
陈力维,张鸿雁,邓丽莉,等. 桔梅奇酵母液体制剂的制备及其在柑橘果实上的应用[J]. 农业工程学报,2021,37(18):299-306.doi:10.11975/j.issn.1002-6819.2021.18.034 http://www.tcsae.org
Chen Liwei, Zang Hongyan, Deng Lili, et al. Preparation and application of liquid bioformulation ofon citrus fruits[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(18): 299-306. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.18.034 http://www.tcsae.org
2021-05-29
2021-08-20
重庆市技术创新与应用发展专项重点项目(cstc2019jscx- dxwtBX0027)
陈力维,研究方向为农产品加工及贮藏工程。Email:chenliwei013211@163.com
曾凯芳,博士,教授,博士生导师,研究方向为果蔬贮藏与物流保鲜。Email:zengkaifang@163.com
10.11975/j.issn.1002-6819.2021.18.034
TS255.3
A
1002-6819(2021)-18-0299-08

