体外紫云英苷抑制小鼠BMM细胞向破骨分化
刘晓亮 朱振安
在人工关节置换领域中,骨吸收活动亢进而造成的假体周围骨溶解、骨缺损是关节置换手术面临的重要挑战之一[1, 2]。而破骨细胞是维持骨吸收作用的主要细胞,因此如何通过抑制破骨细胞分化从而调节骨量稳定是当前防治人工关节假体周围骨溶解的研究重点。
紫云英苷(astragalin,C21H20O11,MW: 448.4g/mol),是一种广泛存在于植物中的类黄酮化合物。许多研究表明类黄酮化合物具有能够促进成骨细胞分化、抑制骨关节内的炎性反应、抑制破骨细胞分化等生理作用[3, 4]。以往的研究中,紫云英苷在骨关节系统中被验证具有抑制骨关节炎、促进成骨分化的功效[5~7]。然而紫云英苷对破骨细胞分化的影响尚不得而知。因此,本研究通过使用核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB,RANKL)刺激C57BL/6小鼠的骨髓源巨噬细胞(bone marrow-derived macrophage, BMM)向破骨细胞分化,并以此为基础研究了紫云英苷对小鼠BMM细胞向破骨细胞分化的影响。
材料与方法
1.实验试剂:CCK-8试剂盒购自日本Dojindo Molecular Technology公司,细胞因子M-CSF、RANKL购自美国R&D Systems公司,TRAP染色试剂盒、鬼笔环肽、DAPI荧光染液购自美国Sigma-Aldrich公司,紫云英苷(No.MB7087)购自大连美仑生物技术有限公司,Real-time PCR 试剂盒与RT-PCR反转录试剂盒购自日本TaKaRa公司,TRAP、NFATc1、CTSK、GAPDH引物购自生工生物(上海)股份有限公司。
2.实验动物:4~6周龄雄性C57BL/6 小鼠,购自上海市实验动物中心西普尔-必凯实验动物有限公司[生产许可:SCXK(沪)2013-0016;使用许可:SYXK(沪)2018-0026]。无特定病原环境下饲养。饲养规范遵循上海生命科学院实验动物指南及上海交通大学医学院相关规定执行。
3.细胞收集与培养:取4~6周龄的小鼠,处死后使用75%的乙醇溶液浸泡小鼠全身消毒20min。分离出小鼠的股骨与胫骨,使用细胞培养基反复冲洗股骨胫骨的髓腔。将冲洗得到的骨髓细胞与培养基混合液使用筛网过滤,离心后使用15ml含30ng/ml M-CSF的培养基重悬细胞,并接种于T75培养瓶中,37℃、饱和湿度、5% CO2的细胞培养箱中培养48h。48h后使用含30ng/ml M-CSF的培养基换液并弃去未贴壁的细胞与残留的小鼠软组织,即得原代BMM细胞。
4.CCK-8检测:将BMM细胞以1×104个/孔的密度种植于96孔板中,在孔中加入含不同浓度梯度的紫云英苷的培养基(0、12.5、25、50、100、200、400、800μmol/L)进行培养。在培养箱中培养48h之后,在每个孔内换入含10μl CCK-8试剂的100μl培养基,并放入培养箱内继续培养2h,之后使用吸光度酶标仪以650nm为参照,在450nm波长下测定孔内的吸光度(A)。
5.抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase, TRAP)染色:将获取的BMM细胞加入胰酶消化并重悬后,以8×103个/孔的浓度接种至96孔板中,在培养箱内培养24h。配置含RANKL与不同浓度紫云英苷的培养基(0、50、100、200μmol/L),培养5天后进行镜下观察,当发现空白组细胞融合为多核巨细胞时使用TRAP染色试剂盒进行染色。将96孔板内的细胞培养基吸取出,并用PBS溶液小心洗涤孔内的细胞3遍;之后使用移液枪吸取50μl 4%多聚甲醛,滴入96孔板内,固定细胞20min;20min后吸取并弃去固定液,再次使用PBS清洗孔内细胞,待培养孔风干干燥后;将配置好的TRAP工作液200μl滴入孔内,在避光的条件下37℃恒温孵育2h;2h后使用移液枪吸取工作液,再次使用PBS清洗板孔;使用光学显微镜观察细胞胞质区,观察到的红色团块即为TRAP阳性的破骨细胞。
6.F-actin环荧光染色:取96孔板孔径大小的牛骨片,使用75%乙醇溶液浸泡并使用紫外照射牛骨片正反面2h消毒,使用双抗洗涤后浸泡入无血清培养基内备用。将获取的牛骨片平铺在96孔板孔底部,将BMM细胞收集后种植于96孔板内,等待其附着于牛骨片上,加入对应培养基培养,当光镜下观察到无骨片的孔内出现破骨细胞时,再培养1天后将牛骨片取出,以备后续观测。骨片取出后使用无菌PBS溶液清洗,每次10min,重复3次,之后使用4%多聚甲醛固定骨片10min,罗丹明鬼笔环肽染液于避光处进行荧光染色30min,染色结束后使用DAPI染液染色5min,最后使用激光共聚焦显微镜进行摄片观察。
7.实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR) 检测:将收集得到的BMM细胞以1×105个/孔的密度种植于6孔板中,加入含有浓度梯度的紫云英苷破骨细胞诱导培养基(M-CSF 30ng/ml,RANKL 50ng/ml),在培养箱内培养5天,提取总RNA。6孔板每孔加入350μl裂解液和350μl 70%乙醇,使用1ml移液枪吹打混匀后移至红色柱内;多次离心后弃去柱子下部液体;更换下面的柱子,将剩余柱子放入1.5ml的EP管内,加入30μl的DEPC水;最后4℃ 12000r/min下离心1min,在1.5ml EP管内收集得到总RNA。使用反转录试剂盒进行反转录反应(37℃ 15min; 70℃ 10min),得到cDNA。使用得到的cDNA与破骨分化基因引物(TRAP, CTSK, NFATc1)进行聚合酶链式反应。相关引物序列如下:TRAP:上游引物: 5′-TGGATTCATGGGTGGTGCTG-3′,下游引物:5′-AGCCACAAATCTCAGGGTGG-3′;CTSK:上游引物:5′-CACCCTTAGTCTTCCGCTCA-3′,下游引物:5′-CTTGAACACCCACATCCTGCT-3′;NFATc1:上游引物:5′-CATGCGAGCCATCATCGACT-3′,下游引物:5′-AGTTATGGCCAGACAGCACC-3′;GAPDH:上游引物:5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物:5′-TGTAGACCATGTAGTTGAGGTCA-3′。
8.统计学方法:采用SPSS 17.0统计学软件对数据进行统计分析,通过两样本t检验进行两组间数据分析,以P<0.01为差异有统计学意义。
结 果
1.紫云英苷对BMM细胞无明显细胞毒性:CCK-8检测结果表明紫云英苷仅在高浓度时(400、800μmol/L)对BMM细胞的增殖出现了明显的抑制作用(P<0.01)。而实验中常规使用的紫云英苷浓度为100μmol/L,因此紫云英苷的使用不会对BMM细胞产生细胞毒性,也不会对紫云英苷在破骨细胞分化方面的研究产生干扰(图1A)。

图1 不同浓度的紫云英苷对小鼠BMM细胞的毒性作用与TRAP染色A.小鼠BMM细胞的CCK-8活性检测(相对于0μmol/L组);B.每孔内TRAP阳性破骨细胞计数;C.TRAP阳性破骨细胞染色(×400)。与0μmol/L组比较,*P<0.01
2.紫云英苷体外抑制TRAP阳性细胞形成:BMM细胞在RANKL的作用下能够分化为破骨细胞,然而在紫云英苷的作用下,BMM诱导分化为破骨细胞的作用被抑制,50μmol/L的紫云英苷将BMM分化的破骨细胞数量显著降低(P<0.01,图1B),而在200μmol/L下过半的BMM的破骨分化都被抑制(图1B),破骨细胞的数量在200μmol/L作用下显著减少(P<0.01)。紫云英苷不仅在低浓度时对破骨细胞分化有抑制作用,在高浓度下(200μmol/L)紫云英苷的抑制作用显著增强,TRAP阳性的细胞数量显著下降(P<0.01,图1)。
3.紫云英苷抑制F-actin环形成:在RANKL的作用下,骨片上形成了大量的F-actin环(图2A),证明RANKL诱导了破骨细胞的分化与骨吸收活动。在紫云英苷的作用下,F-actin环的数量显著下降(P<0.01,图2B),同时F-actin环的面积也相应减小(图2C),且减少的幅度均与紫云英苷的浓度呈正相关。
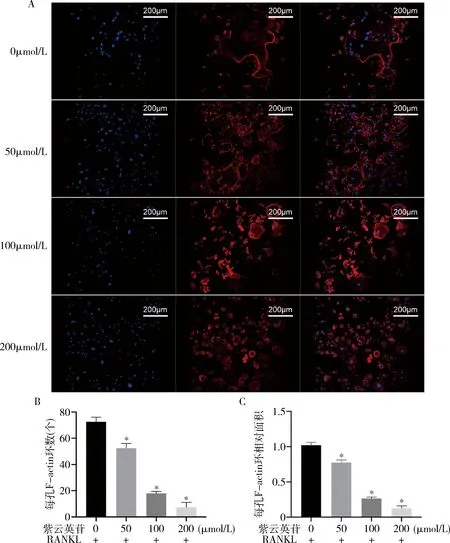
图2 不同浓度的紫云英苷处理下小鼠BMM形成的F-actin环A.F-actin环共聚焦荧光图(罗丹明鬼笔环肽 DAPI,×400);B.每孔F-actin环数;C.每孔相对F-actin环面积。与0μmol/L组比较,*P<0.01
4.紫云英苷抑制破骨分化基因表达:qPCR结果显示在RANKL的作用下,BMM细胞中成功检测到了破骨分化相关的基因表达,RANKL成功诱导了BMM细胞向破骨细胞的分化。同时,在紫云英苷的作用下,破骨细胞相关基因的表达相对于0μmol/L均下降(图3), 并且降低的效果呈现出浓度相关性,在低浓度时(50μmol/L)对破骨分化的抑制效果较低,下降的相对幅度不如100、200μmol/L组明显,而在高浓度下(200μmol/L)紫云英苷对破骨相关基因表达的降低效果更加显著(P<0.01)。

图3 RT-PCR检测破骨分化相关基因的表达A.TRAP;B.CTSK;C.NFATc1。与0μmol/L组比较,*P<0.05,**P<0.01
讨 论
破骨细胞的异常激活造成骨吸收作用的亢进,破骨细胞分化活动在多种疾病中具有着重要作用[8,9]。类黄酮化合物对破骨细胞分化活动的抑制在多项研究中被报道,紫云英苷作为黄酮醇苷类化合物,具有潜在的抑制破骨细胞分化、维持骨量稳定的能力,研究紫云英苷化合物对破骨细胞分化的影响有利于发掘治疗的新方案[4,10,11]。
本实验使用C57BL/6小鼠提取具有破骨细胞分化潜力的小鼠BMM细胞,使用RANKL诱导小鼠BMM向破骨细胞分化,并进一步使用紫云英苷研究其对破骨细胞分化的影响。CCK-8实验显示紫云英苷具有良好的生物相容性,对小鼠BMM细胞没有明显的细胞毒性,在TRAP染色中,紫云英苷显著抑制了TRAP阳性细胞的数目,TRAP阳性为破骨细胞分化的标志,显示紫云英苷抑制了RANKL诱导的破骨细胞分化。之后通过进一步的RT-PCR检测破骨相关基因TRAP、NFATc1、CTSK的表达,验证了基因层面上紫云英苷对破骨细胞分化的抑制作用。综合以上实验从体外的角度验证了紫云英苷抑制破骨细胞分化的作用。
破骨细胞的分化与多种因素有关,与多种细胞与信号通路有联系,破骨细胞的增殖与分化受细胞因子M-CSF和RANKL的调控[12]。传统的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路与核因子κB(nuclear factor κB, NF-κB)通路是RANKL破骨分化信号转导的主要信号通路[13~15]。同时它们也是介导多种外部刺激与炎性反应的重要通路,破骨细胞的激活还与RANKL-RANK-OPG系统的平衡有关[16]。RANK表达于单核-吞噬细胞表面,在破骨细胞前体细胞中高度表达,RANKL与RANK的结合是破骨细胞分化的重要核心,而OPG与RANK竞争性结合RANKL位点从而调控破骨细胞的分化[8, 9]。紫云英苷抑制破骨细胞分化的机制及与其他信号通路之间的作用仍亟待开展进一步的研究,期待为未来骨关节疾病的预后与治疗带来新的思路。

