MicroRNA在昆虫中的研究进展
邓昌鑫,何倩毓
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
MicroRNA(miRNA)是一类由内源基因编码的长度约为21~24 nt的非编码RNA分子,它能够通过抑制靶基因的翻译或降解靶基因的mRNA来参与基因转录后的调控过程。研究表明,miRNA通过对基因的调控,在组织生长、生殖细胞发育、激素作用以及中枢神经系统的发育和活动等几乎所有的生物学过程中均发挥着重要的作用[1]。动物中大概约有50%以上编码蛋白基因的表达受到miRNA的调控。miRNA最初是由Lee等[2]在研究秀丽隐杆线虫Caenorhabditis elegans中发现的,它的名称是lin-4,长度为22 nt。2000年,另一个小分子RNA—let-7被发现[3]。let-7可以与lin-41基因的mRNA 3'端非翻译区(3'untranslation region,3'UTR)结合,从而抑制lin-41基因的表达。随着更为深入的研究,人们发现这是一类长约22 nt,能够使靶基因发生转录后沉默的小分子非编码RNA,于是将其命名为microRNA。
miRNA与siRNA(small interfering RNA)均具有沉默靶基因功能,但与siRNA不同的是:siRNA一般都是外源引入的,而miRNA一般是生物体自身产生的[4]。近几年的研究表明,miRNA在昆虫中广泛存在,是调节昆虫变态发育与生殖的重要因子。因此,在简要介绍miRNA生物合成、调控机制及其靶基因和验证的基础上,着重介绍近年来miRNA在昆虫变态发育与生殖调控中的研究进展。
1 miRNA的生物合成
miRNA的生物合成一般可分为4个过程:转录、细胞核加工、核输出、细胞质加工。在RNA聚合酶II的参与下,miRNA首先在细胞核中被转录形成miRNA的初级转录产物pri-miRNA。随后pri-miRNA被核糖核酸酶Drosha和Pasha识别并剪切,形成发夹状的前体miRNA(pre-miRNA)。pre-miRNA被核转运受体exportin-5识别,与exportin-5及其辅因子RanGTP形成复合体后被转运到细胞质,随后被核糖核酸酶Dicer剪切形成3′端带有2个游离核苷酸的miRNA双链复合体[5-6]。该miRNA双链复合体中的一条链(miRNA)与Argonaute(Ago)一起构成RNA介导的沉默复合物(RISC)[7-9],而另一条链(miRNA*)通常被降解(图1)[10-12]。但最新的研究发现miRNA*并不会被降解,而是可通过与不同的Ago蛋白结合后,和成熟的miRNA一样在调控基因表达中发挥着重要功能[13]。
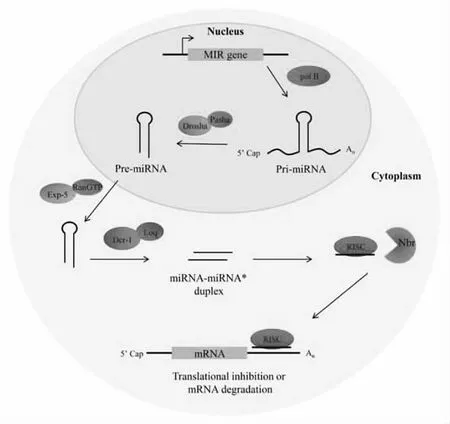
图1 miRNA的生物合成过程(引自文献[12])Fig.1 miRNA biosynthesis process(cited from literature[12])
2 miRNA对靶基因的调控机制
研究发现,miRNA对靶基因表达水平的调控主要通过剪切降解和抑制翻译等作用方式实现。miRNA对靶基因调控的主要过程是RISC复合物在miRNA的指导下通过碱基互补配对与靶基因的mRNA的3'UTR区结合后,再通过阻遏翻译或降解靶基因mRNA,实现在转录后水平上抑制靶基因的表达[14]。然而,miRNA究竟是通过阻遏翻译还是降解靶基因mRNA来实现对靶基因的调控主要取决于miRNA与其作用靶标的结合程度。当miRNA与其靶标mRNA完全或近乎完全互补时,主要引起mRNA的降解;当两者不完全互补时,主要是通过抑制靶标mRNA的翻译起作用[15]。在动物中,miRNA主要通过翻译抑制的作用方式来实现对靶基因的调控,而在植物中,其主要作用方式是对靶基因mRNA进行降解。然而,近些年在植物中发现了抑制靶基因mRNA翻译的miRNA[16-17],动物包括昆虫中也存在靶基因mRNA被降解的情况[18-21]。果蝇中的研究发现,miRNA介导的基因沉默首先倾向于抑制翻译,而后通过mRNA的腺苷酸化和衰变而得以巩固[22]。随着研究的不断深入,人们发现miRNA与其靶基因的结合关系并非唯一:一个miRNA可以作用于一个或几个不同的靶基因mRNA,而一个靶基因mRNA序列上也可以存在多个miRNA的靶位点[23-24]。此外,miRNA作为一类重要的转录后调控因子,本身也受其他基因的调控。研究发现,在一些miRNA的启动子区域存在着众多转录因子的结合位点,而这些转录因子又是miRNA的主要靶标。不仅如此,这些转录因子的启动子区域又存在着响应激素的活性位点,这样就构成了一个精妙的反馈通路,增强了生物对外界环境的适应能力[25-27]。如果蝇miR927可通过抑制JH初级反应基因Kr-h1(Krüppel homolog1)的表达而调控果蝇幼虫至蛹的变态发育,同时miR-927自身的表达又受到JH及其受体Met的抑制,从而形成正反馈调控机制[27]。由于miRNA对mRNA调控及自身调控方式的多样化,使miRNA的功能更丰富,也让miRNA对靶基因的调控变得更为复杂,同时为基因的调控方式和功能的研究带来了新的思路、开辟了新的领域。
3 miRNA及其靶基因的预测及验证
有关miRNA的鉴定方法,目前应用最广的是生物信息学研究法。生物信息学预测miRNA的方法,首先是根据miRNA的结构特征在基因组序列中预测可能的miRNA。这些算法根据miRNA前体序列的发夹结构特征在基因组非编码区域和非重复区域中进行miRNA预测,然后根据物种的进化保守性过滤候选miRNA。其中,已知的miRNA前体在搜索算法中起着重要作用,利用已知的miRNA的结构可用于程序学习过程的训练从而区分真实的预测和假阳性。目前,成千上万的miRNA通过生物信息学方法已被预测出。随着miRNA数量的不断增多,许多数据库也随之建立,其中miRBase[28](http://www.mirbase.org/)数据库是miRNA的主要在线存储库,数据库中的每个条目均代表miRNA转录本的预测发夹部分,其中包含有关成熟miRNA序列的位置和序列的信息。除miRBase数据库外,Rfam[29]是用于RNA注释的系统,其中包含miRNA家族信息;miRIAD[30]被设计来托管基因内编码的miRNA及其宿主基因的信息;而mirtronPred[31]则可以从内含子序列中预测mirtrons;mirSTP[32]则是用于识别miRNA转录起始位点(transcription start sites,TSS)的程序;MetaMirClust[33]提供有关miRNA簇及其保存的全面信息。有通过生物信息学方法预测出miRNA后,可进一步通过实验方法,例如高通量测序等方法鉴定目标miRNA。这种方法比用经典正向遗传学识别新型miRNA的方法要快得多。随着下一代测序技术(Next-Generation Sequencing,NGS)的发展,miRNA现在正以惊人的速度、系统地被发现。通过这些生物实验手段发现的miRNA对计算方法发现的miRNA进行了极大的补充。
发现miRNA,确定其靶标并进一步推断miRNA功能一直是理解miRNA生物学过程及其在疾病发展中的作用的关键策略。在缺乏高通量识别miRNA靶标的生物学方法的情况下,许多miRNA靶标预测的计算方法已被开发。例如:mirSVR[34],PicTar[35],TargetScan[36]等。不同的miRNA靶标预测算法使用不同的技术和标准来预测靶标,包括碱基配对、靶标位点的进化保守性等。通常,miRNA靶标预测算法使用的模式和标准的不同会对算法的输出和性能产生重大影响。选择标准的微小变化会导致预测中的巨大差异,靶标预测算法中性能最佳的是TargetScan和PicTar[37],他们的预测主要限于3'UTR中的保守位点,但其假阳性率为68%[38]。在昆虫miRNA研究中,靶基因预测主要使用的工具有miRanda[39-43](http://www.microrna.org/microrna/),microT-CDS[44](http://www.microrna.gr/microT),RNAhybrid[45](https://bibiserv.cebitec.uni-bielefeld.de/mahybrid),TarBase[46](http://carolina.imis.athena-innovation.gr/),RNA22[46](https://cm.jefferson.edu/rna22)以及TargetScan[47](http//:www.targetscan.org/)等。Alexiou等[48]做过一项评估,miRanda[49],miRBase[50],PicTar,PITA[51],TargetScan这些算法的精度为50%左右,灵敏度范围为6%~12%。因此,进行预测时可以用多个软件共同预测来提高准确率。尽管这些预测工具有其局限性,但在实验中也有着广泛的应用。目前这些预测工具根据基因组数据已完成了许多物种的miRNA靶标预测,并将结果储存到数据库,使得研究人员可以在数据库进行下载或查询。最近,一些新颖的鉴定miRNA靶标的生化方法已被开发,从而可深入了解miRNA的结合位点。例如,通过交联免疫沉淀法(HITS-CLIP)分离RNA的高通量测序技术,可直接鉴定miRNA靶标[52]。随着大量miRNA被鉴定以及miRNA靶基因被预测,有关miRNA的研究已迅速转向推断miRNA在特定生物学条件下的功能和调控机制。
4 miRNA在昆虫变态发育中的作用
昆虫的变态主要由保幼激素(juvenile hormone,JH)和蜕皮激素(20-hydroxyecdysone,20E)协同调控。通常,20E促进蜕皮,而JH阻止变态;因此,当20E与JH共同作用时,使得昆虫保持幼虫状态,而在JH几乎不存在的情况下20E会引发变态[53]。在分子水平上,这两种激素都是通过一系列转录因子来实现对昆虫变态发育的调控。通常情况下,20E与其异源二聚体受体蜕皮激素受体(EcR)和超螺旋体(USP)结合后形成20E受体复合物,该复合物随后激活下游转录因子的级联表达,最终诱导昆虫从幼虫到蛹的变态[54-55]。保幼激素则通过其核受体异源二聚体Met(Methoprene tolerant)/SRC(steroid receptor coactivator)启动转录因子Kr-h1的表达,Kr-h1抑制Br(Broad)表达而发挥阻止变态或“维持原状”的作用[56-57]。Kr-h1也可通过抑制E93的表达而阻止成虫特征的出现[58-59]。简而言之,在最后一个幼龄期开始时,JH的产生停止,Kr-h1转录下降,E93的表达增加,这些变化共同促进了变态的发生。
近年来,昆虫中miRNA的研究表明miRNA在调节昆虫变态方面也具有重要的作用[60]。目前,果蝇中已鉴定获得8个与变态相关的miRNA(miR-100、miR-125、let-7、miR-34、miR-14,miR-8,miR-965,miR-252),其中miR-100、miR-125和let-7的表达受20E和Br的促进,而miR-34受20E和Br的负调控。JH则正好具有与20E相反的作用[61]。研究发现miR-100、miR-125和let-7缺失的果蝇突变体在变态时出现翅发育缺陷,且成虫的神经肌肉具有典型的幼虫特征[62-63]。同样,miR-252的表达也受20E的促进,其在果蝇蛹和成体发育阶段也有着重要的作用。在果蝇幼虫脂肪体中过量表达miR-252导致脂肪体细胞的大小和数量降低,从而导致幼虫及成虫虫体变小。此外,miR-252的过表达也会引起幼虫到蛹转变的延迟[64]。家蚕中,Ling等[65]利用miRNA海绵(miRNA sponge)技术以及UAS/Gal4系统超表达let-7 sponge降低let-7的表达量,导致家蚕Bombyx mori在幼虫蜕皮以及幼虫至蛹转变过程中出现发育停滞,并且20E信号通路中的FTZ-F1(ftz transcription factor 1)和E74的表达量在let-7 sponge转基因家蚕中显著上升,表明let-7可能通过作用于FTZ-F1和E74调控家蚕的蜕皮和变态。此外,miRNA可调控EcR(ecdysone response)的表达而反向调控蜕皮激素的信号传导形成正反馈调节。如家蚕中鉴定发现miR-281通过抑制20E受体EcR-B的表达而参与调控家蚕的变态发育。在家蚕四龄幼虫至蛹的发育阶段,马氏管中miR-281与EcR-B的表达模式正好相反,且miR-281的表达又受20E的抑制,这就导致在变态过程中,由于20E的抑制,miR-281的表达显著降低,使得EcR-B达到较高的表达水平,最终促进幼虫至蛹的转变[66]。在不完全变态昆虫德国小蠊Blattella germanica和飞蝗Locusta migratoria中的研究发现,RNA干扰miRNA合成途径中的核糖核酸酶Dicer-1的表达,可抑制末龄若虫正常羽化成成虫,导致末龄若虫蜕皮后形成超龄若虫或若虫-成虫中间体,说明miRNA在不完全变态昆虫的变态发育中也发挥重要的作用[67-68]。高通量测序鉴定发现在德国小蠊倒数第二龄期和末龄若虫期存在61个典型的miRNA,其中miR-253在倒数第二龄若虫期高表达而在末龄若虫期表达量显著降低,而let-7、miR-100以及miR-125的表达模式正好相反[69]。降低let-7和miR-100的表达可导致成虫翅明显变小、翅脉畸形,类似于Br缺失的表型[70]。Lozano等[71]研究发现Dicer-1的缺失导致Kr-h1的表达升高,而若在Dicer-1表达降低的同时也干扰Kr-h1的表达则可使德国小蠊正常变态。进一步研究表明Kr-h1的3′UTR中含有miR-2的结合位点,对Dicer-1缺失的虫体添加miR-2类似物可保证幼虫至成虫的正常变态,说明miR-2通过降解Kr-h1的mRNA参与JH信号通路而调控德国小蠊的变态发育。近期,Song等[72]在飞蝗中的研究发现let-7和miR-278可通过与Kr-h1的CDS区域结合而降低Kr-h1的表达,导致飞蝗若虫提前变态以及成虫卵巢的发育和卵母细胞的成熟受阻。miRNA除了通过作用激素信号通路分子调控昆虫变态发育,最新家蚕中的研究发现miR-14可通过同时靶向20E上游合成途径中的相关重要分子,快速降低蜕皮后虫体20E的滴度,实现对家蚕蜕皮发育的调控[73]。
5 miRNA在昆虫生殖过程中的作用
目前有关miRNA调节昆虫生殖的报道还比较少,研究成果主要是通过RNA干扰Dicer1、Ago1等与miRNA生物合成及功能执行有关的基因,以及利用高通量测序鉴定与生殖相关的miRNA,然后通过预测其靶基因进而分析miRNA的功能,构建miRNA与mRNA的相互作用网络。在果蝇中对Dicer1进行缺失突变,阻断miRNA生物合成途径,能够显著抑制果蝇卵母细胞的成熟,说明miRNA在果蝇卵母细胞成熟过程中发挥着重要的调控作用[74]。Ago1在果蝇卵母细胞及卵泡细胞中表达水平较高,Ago1缺陷型和缺失突变个体的卵小管仅含8个滋养细胞而没有卵母细胞,这与Dicer1突变体的表型相似,表明Ago1以及依赖于Ago1的miRNA是果蝇卵母细胞形成所必需的[75]。果蝇中dFmr1蛋白能抑制卵巢中GSCs的分化从而维持其干细胞特性,bantam能够与dFmr1蛋白相互作用抑制GSCs分化,这对卵巢中GSCs的维持起着重要的作用[76]。近年来,对其他昆虫的研究也表明miRNA在昆虫生殖过程中发挥重要作用。埃及伊蚊Aedes aegypti中的研究发现,在脂肪体的离体培养基中同时添加20E和氨基酸能促进miR-275的表达,而单独使用20E或氨基酸并不能达到类似的效果。利用miRNA抑制剂干扰miR-275的表达,可导致蚊子出现对血液的消化障碍,进而影响卵的成熟[77]。同样,伊蚊中特异性的miRNA-1890可通过作用于JH调控的丝氨酸蛋白酶JHA15而调控卵巢发育和卵黄沉积[78]。与miRNA在昆虫变态发育中的研究相比,昆虫生殖阶段miRNA的功能研究仍处于起步阶段。目前依然是以模式昆虫果蝇为主,在非模式昆虫中也是以miRNA的大规模测序、生物信息学分析和靶基因预测为主。这表明对昆虫生殖相关的miRNA研究有待进一步的深入,包括研究昆虫种类的广度,miRNA靶基因的鉴定,miRNA功能的研究,miRNA的调控机制等。
6 小结与展望
有关昆虫miRNA的研究受到了越来越多的重视,在不同种类昆虫中发现了一系列的miRNA。从miRNA的生物合成,miRNA对靶基因的调控机制,miRNA及其靶基因预测以及miRNA在昆虫变态发育和生殖过程中的作用等方面的研究进行综述。目前,miRbase数据库收录了来自不同物种的28 645条miRNA[79],与其他物种相比,昆虫miRNA的报道还比较少,已阐明功能的昆虫miRNA更少。此外,有关昆虫miRNA的研究目前主要集中于少数几个昆虫,如果蝇、家蚕、埃及伊蚊、德国小蠊、飞蝗等,这可能是因为许多非模式昆虫缺乏基因组信息,遗传学手段受限,以及miRNA自身功能的特点与研究的技术局限等原因。相信随着昆虫miRNA测序技术的发展和昆虫基因组信息的不断丰富,更多的miRNA将会被鉴定,miRNA在昆虫发育过程中的作用也将被进一步揭示。近几年,研究人员已通过构建miRNA转基因动物来研究相关基因的功能,取得了一些重要的进展[80-81]。有许多研究表明昆虫miRNA的序列结构保守性较强。如bantam,在果蝇的翼盘和眼部发育中具有促进细胞增殖的作用[82],后来在许多其他昆虫中也被发现,它的成熟序列在不同昆虫中的同源性高达90%,仅仅会在第10~12位核苷酸会产生差异。因此许多昆虫中发现的高度特异性miRNA可以作为重要的靶标,一方面可为农业害虫的防治和病毒携带媒介昆虫的预防提供全新的策略;另一方面,也为益虫抗逆新品种提供有益的参考。此外,昆虫中保守家族miRNA功能的研究将为哺乳动物及人类相关miRNA功能的研究提供重要的依据,对人类疾病有关miRNA方面研究有着十分重要的作用。所以说miRNA有着十分光明的前景。希望可以为之后的昆虫miRNA的研究提供借鉴和参考。

