低氧训练对肥胖大鼠大脑皮质脑源性神经营养因子及酪氨酸激酶受体B的调节作用
沈钰琳 路瑛丽 王雪冰,2 汪涵 冯连世
1 国家体育总局体育科学研究所(北京100061)
2 广西大学体育学院(南宁530004)
肥胖是造成高血糖、高血脂、高血压和大脑认知功能减退等多种慢性病的主要原因之一,直接影响内分泌、心血管及中枢神经系统功能[1-4]。肥胖者脑组织损伤主要位于大脑额叶和颞叶,当身体质量指数(body mass index,BMI)超出正常范围时,脑内白质和灰质密度都会下降,且其减少程度与BMI升高程度成正相关[5-6]。有研究显示,低氧训练能够有效控制大鼠体重,降低体脂,改善肥胖大鼠脂代谢[7-8]。慢性间歇性低压低氧可改善癫痫大鼠的学习记忆能力,并对海马突触超微结构起到一定的保护作用[9]。陈耕春等[10]利用低氧仪模拟高原训练的方法分别对小鼠和人做了间歇性低氧训练实验,发现间歇性低氧训练对改善脑组织的抗缺氧能力、提高缺氧条件下的神经反应能力有明显效果。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养素家族中最活跃的成员之一,是大脑的重要调节因子,起到支持现有神经元的存活、新神经元的生长和分化,以及加强神经连接的作用,在前脑、海马、基底核等部位表达活跃[11-14]。酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)是BDNF 的功能性受体,BDNF对神经元的保护及促进再生作用通过与TrkB 结合后启动细胞内信号转导途径而产生,BDNF/TrkB 信号通路对保护中枢神经系统功能有重要作用[15-17]。肥胖会促使细胞分泌肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)等前炎性细胞因子参与机体的炎症反应,增多的炎症因子可透过血脑屏障,造成中枢神经系统炎性损伤[18]。Zhang 等[19]研究发现,脂多糖诱导的炎症可导致小鼠大脑BDNF 下降引起抑郁样行为。抑制TNF-α的分泌可维持抑郁症大鼠海马BDNF 水平从而预防应激性记忆障碍[20]。海马中高水平的炎症因子会降低BDNF/TrkB 的表达,降低对神经元的保护作用[21],通过增强AMPK/BDNF途径可起到抗海马神经炎症的作用[22]。可见BDNF/TrkB 途径与炎症反应具有相关性。目前有关低氧训练是否可以通过影响肥胖大鼠大脑皮质BDNF及其受体TrkB的表达进而改善中枢神经系统功能的研究鲜见报道。因此,本研究通过高脂饮食喂养建立肥胖大鼠模型,探讨低氧训练对肥胖大鼠大脑皮质BDNF 及其受体TrkB 的影响作用,为低氧训练改善肥胖大鼠中枢神经系统功能提供理论依据。
1 材料与方法
1.1 实验动物
出生3 周龄的离乳雄性SD 大鼠100 只,购自北京维通利华实验动物技术有限公司,体重60~90 g。饲养条件为自然光照,温度21℃~23℃,湿度40%~60%,自由饮食。适应性喂养普通饮食1 周后,随机分为普通饮食组和高脂饮食组,分别给予普通饮食(科澳协力SPF 级繁殖鼠料,H2O 7.08 gm%、粗蛋白22.10 gm%、粗脂肪5.28 gm%、粗灰分5.20 gm%、粗纤维4.12 gm%、无氮浸出物52.00 gm%、钙1.24 gm%、磷0.92 gm%、赖氨酸1.34 gm%、蛋氨酸和胱氨酸0.72 gm%)和高脂饮食(Research Diets- D12451,H2O 14.19 gm%、酪蛋白20.00 gm%、胱氨酸0.30 gm%、玉米粉7.28 gm%、麦芽糖糊精10.00 gm%、蔗糖17.28 gm%、纤维素5.00 gm%、豆油2.5 gm%、猪油17.75 gm%、无机盐1.00 gm%、磷酸钙1.30 gm%、碳酸钙0.55 gm%、柠檬酸钾1.65 gm%、维生素1.00 gm%、重酒石酸胆碱0.20 gm%)喂养10周。
1.2 实验分组
根据肥胖大鼠建模标准:高脂饲料组大鼠体重超过普通饲料组20%属于建模成功大鼠[23],筛选出50 只大鼠继续喂养高脂饲料。通过2 周适应性训练(速度从16 m/min 梯度递增到25 m/min,运动时间从20 min/d递增到60 min/d),挑选32只肥胖大鼠,随机分为常氧安静组(normal oxygen control group,NC 组)、常氧训练组(normal oxygen training group,NT 组)、低氧安静组(hypoxic control group,HC组)、低氧训练组(hypoxic training group,HT组),每组8只。NC组和NT组统称为常氧组(N 组),HC 组和HT 组统称为低氧组(H组),NC组和HC组统称为安静组(C组),NT组和HT组统称为训练组(T 组)。低氧安静和低氧训练组在综合环境实验室完成实验,采用天津森罗科技股份有限公司的低氧发生仪(GA15FF-13 型双螺杆空气压缩机,CA-200AT型制氮机),形成常压低氧实验环境,低氧组大鼠在13.6% O2浓度(相当于3500 米海拔高度)下生活和训练。训练组大鼠于水平跑台进行有氧耐力训练,根据前期研究成果常氧组训练强度为25 m/min,低氧组训练强度为20 m/min,自然光照下每天白天运动1小时,每周5天,共4周[24]。
1.3 取材
训练第4 周末,各组大鼠禁食禁水12 h,称重,给予10%水合氯醛溶液(0.3 ml/100 g)腹腔注射麻醉,腹主动脉取血,断头。迅速放在冰袋上取同侧大脑皮质,PBS漂洗后置于冻存管,放入液氮罐内冷冻,随后将样品转入-80℃冰箱中保存待测。将一部分大脑皮质用于实时荧光定量PCR(real time quantitative PCR,RTqPCR)检测,另一部分用于Western Blot 和ELISA 检测。
1.4 试剂与仪器
兔抗大鼠BDNF 多克隆抗体(Abcam 公司,型号Ab108319),兔抗大鼠p-TrkB 多克隆抗体(Immunoway公司,型号YP1247),山羊抗兔IgG(Jackson 公司,型号111-035-003),兔抗大鼠TrkB 多克隆抗体(CST 公司,型号4603),小鼠抗β-actin单克隆抗体(CST公司,型号4967),TNF-αELISA 试剂盒(eBioscience 公司,型号85-88-7340-22),IL-1β ELISA 试剂盒(eBioscience 公司,型号85-BMS630),IL-6 ELISA试剂盒(eBioscience公司,型号85-BMS625),逆转录试剂盒(TaKaRa公司,型号2641A),Premix Taq™(Ex Taq™Version 2.0)试剂盒(TaKaRa公司,型号RR003Q),实时荧光定量PCR系统(Roche公司,Roche LightCycler®480II)。
1.5 RT-qPCR实验
将大脑皮质置于匀浆器(预先用DEPC 处理)中研磨。加入Trizol 提取样品RNA,最后加入100 μl 无RNase 的水,溶解RNA。用分光光度计读取OD260/OD280比值及RNA 浓度。根据逆转录试剂盒说明书条件将提取的RNA 取1 μg 逆转录成cDNA。按照Premix Taq™(Ex Taq™Version 2.0)的说明书,配制10 μl的反应体系。PCR反应条件:95℃5 min预变性后,95℃10 s,60℃ 30 s,72℃ 30 s,40 个循环。使用Roche LightCycler®480II 实时荧光定量PCR 系统进行扩增并对结果进行分析。引物序列如表1。结果使用2-△△CT法表示目的基因相对表达量。
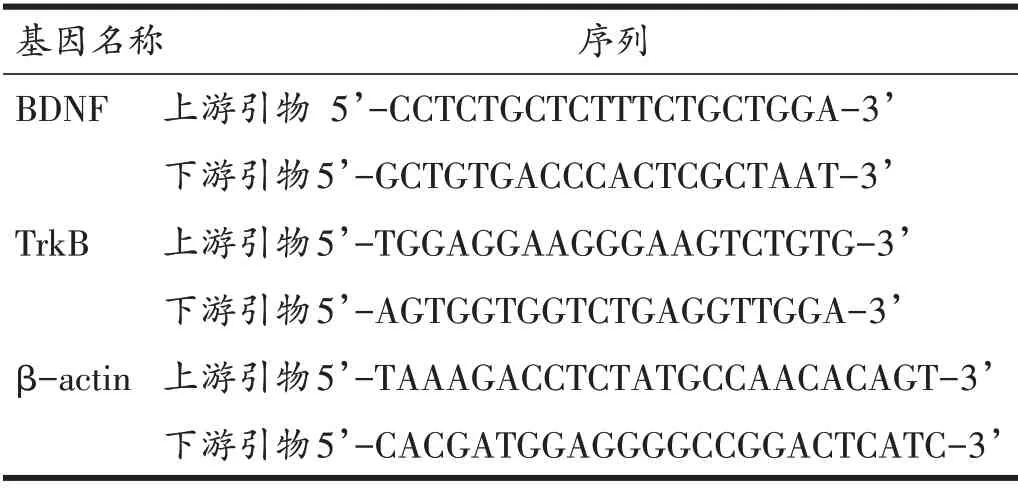
表1 引物序列
1.6 Western Blot实验
将大脑皮质置于组织匀浆器中研磨,预冷RIPA蛋白抽提试剂,加入蛋白酶抑制剂(cocktail);12000 rpm(4℃)离心15 min。取上清,进行BCA 蛋白定量。SDS-PAGE 电泳,转膜,兔抗BDNF IgG(1∶1000),兔抗TrkB IgG(1∶1000),兔抗p-TrkB IgG(1∶500)4℃孵育过夜,TBST 清洗3×10 min,山羊抗兔IgG-HRP(1∶10000)室温震荡孵育1 h,清洗3×10 min。ECL滴加到膜的蛋白面,反应3~5 min;胶片曝光:10 s~5 min(曝光时间随不同光强度而调整),显影2 min,定影。通过Image-Pro Plus 图像分析软件读取目的条带的光密度扫描值,以各组条带β-actin 的扫描值标化其相应组待测因子的蛋白表达量。
1.7 酶联免疫吸附实验(ELISA)
取各组大鼠大脑皮质加入PBS 于冰上研磨,4℃条件下12000 r/min离心15 min,取上清。从冰箱内取出试剂盒,置于室温下平衡30 min。核算样本所需的已包被抗体的酶标板孔数目,每个样品做2个平行管,参照ELISA试剂盒说明书完成各步骤操作。用酶标仪在450 nm 测定吸光值。绘制标准曲线,根据样本吸光值,计算样本中TNF-α、IL-6和IL-1β的浓度。
1.8 统计学分析
应用SPSS 21.0统计软件进行统计学分析,所有统计数据结果以均数± 标准差(±s)表示,采用2(氧气含量:常氧、低氧)×2(运动方式:安静、训练)双因素组间方差分析,对主效应和交互作用显著性进行Bonferroni 检验,当交互作用显著时进行Post hoc 事后检验。P<0.05为有统计学意义。
2 结果
2.1 不同运动方式和氧气含量对肥胖大鼠大脑皮质BDNF、TrkB mRNA表达的影响
图1结果显示,对于大鼠大脑皮质BDNF mRNA而言,运动方式的主效应显著,F(1,28)=82.39,P<0.001,其中T 组(1.70 ± 0.34)显著高于C 组(0.98 ± 0.13),P<0.001。氧气含量的主效应显著,F(1,28)=4.59,P=0.041,其中H 组(1.42 ± 0.52)显著高于N 组(1.25 ±0.35),P=0.041。氧气含量×运动方式交互作用显著,F=7.09,P=0.013,NT 组(1.50 ± 0.32)显著高于NC 组(1.00 ± 0.00),P<0.001;HT 组(1.89 ± 0.24)显著高于HC 组(0.95 ± 0.19),P<0.001;HT 组显著高于NT 组,P=0.002。
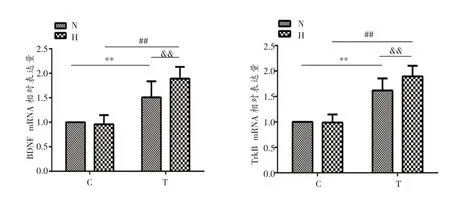
图1 各组大鼠大脑皮质BDNF、TrkB mRNA表达
对于TrkB mRNA表达结果而言,运动方式的主效应显著,F(1,28)=148.49,P<0.001,其中T 组(1.76 ±0.26)显著高于C组(0.99 ± 0.11),P<0.001。氧气含量的主效应显著,F(1,28)=4.53,P=0.042,H 组(1.44 ±0.50)显著高于N 组(1.30 ± 0.36),P=0.042。氧气含量×运动方式交互作用显著,F(1,28)=5.33,P=0.029,NT 组(1.62 ± 0.24)显著高于NC 组(1.00 ± 0.00),P<0.001;HT 组(1.90 ± 0.21)显著高于HC 组(0.99 ±0.16),P<0.001;HT 组显著高于NT 组,P=0.004。这表明训练和低氧环境都能显著提高大鼠大脑皮质BDNF、TrkB mRNA 的表 达,HT 组 较HC 组和NT 组BDNF、TrkB mRNA显著升高。
2.2 不同运动方式和氧气含量对肥胖大鼠大脑皮质BDNF、TrkB和p-TrkB蛋白表达的影响
图2 结果显示,对于大鼠大脑皮质BDNF 蛋白而言,运动方式的主效应显著,F(1,28)=105.48,P<0.001,其中T 组(0.47 ± 0.08)显著高于C 组(0.26 ±0.04),P<0.001。氧气含量的主效应呈边缘显著,F(1,28)=4.59,P=0.062,其中H组(0.39 ± 0.13)略高于N组(0.35 ± 0.11)。氧气含量×运动方式交互作用不显著,F(1,28)=1.35,P=0.255。

图2 各组大鼠大脑皮质BDNF、TrkB和p-TrkB蛋白的表达
TrkB蛋白表达结果显示,运动方式F(1,28)=0.35,P=0.559 和氧气F(1,28)=0.01,P=0.981 主效应及氧气含量×运动方式交互作用F(1,28)=0.24,P=0.625 均不显著。对于p-TrkB 蛋白而言,运动方式的主效应显著,F(1,28)=98.03,P<0.001,其中T组(1.76 ± 0.31)显著高于C 组(1.32 ± 0.63),P<0.001。氧气含量的主效应不显著,F(1,28)=1.08,P=0.307,H组(1.32 ± 0.63)略高于N 组(1.22 ± 0.52)。氧气含量×运动方式交互作用不显著,F(1,28)=1.52,P=0.228。这表明训练能显著提高大鼠大脑皮质BDNF和p-TrkB蛋白的表达,T组显著高于C组。
2.3 不同运动方式和氧气含量对肥胖大鼠大脑皮质炎症因子的影响
图3结果显示,对于大鼠大脑皮质TNF-α而言,运动方式的主效应显著,F(1,28)=5.18,P=0.031,其中T组(27.28 ± 12.72)显著低于C 组(40.84 ± 19.50),P=0.031。氧气含量的主效应不显著,F(1,28)=0.64,P=0.429,H 组(31.67 ± 17.22)略 低于N 组(36.45 ±18.21)。氧气含量×运动方式交互作用不显著,F(1,28)=0.01,P=0.975。

图3 各组大鼠大脑皮质TNF-α、IL-1β和IL-6的表达
对于大鼠大脑皮质IL-1β而言,运动方式的主效应显著,F(1,28)=10.47,P=0.003,其中T组(5.86 ± 1.14)显著低于C 组(7.82 ± 2.05),P=0.003。氧气含量的主效应不显著,F(1,28)=0.105,P=0.748。氧气含量×运动方式交互作用不显著,F(1,28)=0.04,P=0.849。
对于大鼠大脑皮质IL-6 而言,运动方式的主效应显著,F(1,28)=67.92,P<0.001,其中T 组(35.77 ±7.91)显著低于C 组(57.71 ± 8.07),P=0.003。氧气含量的主效应不显著,F(1,28)=3.22,P=0.083。氧气含量×运动方式交互作用不显著,F(1,28)=1.84,P=0.186。这表明训练能显著降低大鼠大脑皮质TNF-α、IL-1β和IL-6的表达,T组显著低于C组。
3 讨论
本研究结果显示,氧气浓度×运动方式在BDNF 和TrkB mRNA 表达上具有显著交互作用,低氧训练和常氧训练都能有效提高肥胖大鼠大脑皮质BDNF 和TrkB mRNA 表达,且低氧训练组BDNF和TrkB mRNA表达水平较常氧训练组显著升高,表明低氧训练在提高肥胖大鼠大脑皮质BDNF和TrkB mRNA表达上比常氧训练更具优势。BDNF 与中枢神经系统功能存在密切关系,它能防止神经元损伤死亡、改善神经元的病理状态、促进受损伤神经元再生及分化,维持成熟的中枢及周围神经系统的神经元生存和正常生理功能,调控突触可塑性[25]。疾病导致认知能力减退时,会引起大脑和血液中的BDNF 表达下降[26-27]。低氧预适应能够上调BDNF 的表达并增加其与TrkB 受体的结合,激活BDNF/TrkB信号通路,对小鼠产生神经保护作用[28]。此外,运动对中枢神经系统功能恢复具有促进作用[29-31],有氧运动可激活糖尿病大鼠海马BDNF/TrkB 信号通路,提高肥胖大鼠前额叶神经BDNF 等可塑性相关蛋白质表达,保护大脑功能[32-33]。急性间歇性缺氧结合运动训练疗法可通过改变脊髓血管内皮生长因子(vascular endothelial growth factor,VEGF)、BDNF 和TrkB 的磷酸化及非磷酸化形式的表达,诱导脊髓损伤后细胞的可塑性,促进脊髓损伤大鼠前肢运动功能的恢复[34]。BDNF 及其受体TrkB 可能是肥胖导致中枢神经系统功能改变的重要靶点。本研究发现,低氧环境和跑台训练均能上调肥胖大鼠大脑皮质BDNF 和TrkB mRNA的表达,且这两个因素具有显著交互作用,表明与常氧训练相比,低氧训练对肥胖大鼠大脑皮质BDNF和TrkB mRNA 转录水平的调控作用更为显著。在蛋白水平的表达上,各组大鼠大脑皮质TrkB 表达无显著差异,其变化体现在磷酸化水平的表达。其原因是由于TrkB 翻译后修饰的方式主要为磷酸化,当BDNF 与其功能性受体TrkB 结合后,TrkB 经历磷酸化转移,之后激活相关的蛋白激酶,从而磷酸化其下游底物,从而启动TrkB 信号通路级联过程[35]。训练组BDNF 和p-TrkB 的蛋白表达较安静组显著升高,低氧训练组比常氧训练组均值略有升高,但是未发现显著的统计学差异。氧气浓度×运动方式无显著交互作用,说明训练可以提高肥胖大鼠大脑皮质BDNF和p-TrkB蛋白表达水平,但低氧条件未对BDNF 和p-TrkB 蛋白表达产生显著效果。造成这一结果的原因可能是蛋白质合成从转录到翻译修饰需要经过一系列复杂的过程,在翻译过程中低氧环境的暴露时间、氧气浓度、训练周期等条件因素没有对BDNF 和p-TrkB 蛋白的调控产生显著影响,其具体机制仍有待进一步研究。
肥胖也被视为一种慢性炎症状态,会引起脂肪组织含量增加,脂肪组织中的脂肪细胞和巨噬细胞会分泌TNF-α、IL-1β和IL-6等多种炎性因子,引发慢性炎症和氧化应激,进而影响大脑发育[36-37]。研究显示,高脂饮食会导致大鼠海马和血液中的促炎细胞因子TNF-α和IL-6分泌增多,从而降低BDNF的表达,影响神经功能[38]。运动对炎症有抑制作用,有氧运动可以降低胰岛素抵抗小鼠炎症因子IL-1β、IL-18的表达[39];低氧训练可以有效降低肥胖大鼠血清中TNF-α和IL-6的表达[40]。本研究发现,训练组大鼠大脑皮质TNF-α、IL-1β和IL-6较安静组显著下降;但低氧训练和常氧训练相比,TNF-α、IL-1β和IL-6表达量无显著性差异,低氧训练组TNF-α、IL-1β表达较常氧训练组略下降,表明在本实验中训练的主效应显著,氧气浓度对肥胖大鼠大脑皮质炎症因子的调控没有显著效果。之前的研究显示,低氧环境对机体炎症因子的表达存在不同的影响作用,蒲小燕等发现,在模拟海拔2200 m 和4200 m 低氧环境中暴露30 天使小鼠血清中的TNF-α、IL-6 分泌增多[41]。也有报道显示,每天6 h的间歇性低压低氧(海拔4000 m)预处理能够降低大鼠血清TNF-α的表达[42]。以上研究结果可以看出,低氧环境对机体炎症因子的作用可能受氧气浓度、低氧暴露时间、大气压力、机体对低氧环境的适应性等因素的影响而产生不同的效果。本研究结果表明,本实验中设置的低氧环境对肥胖大鼠大脑皮质炎症因子无显著影响,低氧训练和常氧训练均能显著降低肥胖大鼠大脑皮质TNF-α、IL-1β和IL-6的表达,抑制炎症因子的分泌,控制大脑的炎症反应,减少对神经元的刺激。
4 结论
运动训练能够减少肥胖大鼠大脑皮质炎症因子TNF-α、IL-1β和IL-6 的分泌,促进大脑皮质BDNF 及其受体TrkB 的表达,从而提高神经营养作用。低氧训练在提高肥胖大鼠大脑皮质BDNF和TrkB mRNA的表达上较常氧训练更具优势。

