69例室间隔缺损胎儿遗传学检测及随访观察
胡辉 ,沈双双 ,蓝小芳 ,张向东 ,徐夏苑 ,靳春雷 ,雷永良 ,刘姣 *
(1.丽水市妇幼保健院,浙江 丽水 323000;2.金华市妇幼保健院,浙江 金华 321000)
室间隔缺损(VSD)是儿童最常见的先天性心脏病(CHD),占新生儿心脏畸形的25%~30%,患病率1.7%~3.0%[1]。目前已知染色体非整倍体和染色体拷贝数变异(CNV)可导致CHD[2],但上述病因与轻微先天性心脏病(如单纯型VSD)之间的关联无法确定。染色体微阵列分析(CMA),如单核苷酸多态性微阵列分析(SNP array),可同时检测全基因组水平上染色体异常和亚微观基因组失衡,已被推荐用于胎儿结构异常的遗传学一线检测[3]。本研究应用传统的染色体G显带核型分析联合SNP array分析VSD胎儿遗传学病因,并观察VSD胎儿的妊娠结局及预后,旨在探讨VSD的遗传学病因及CMA技术在VSD胎儿中的应用价值。
1 资料与方法
1.1 一般资料 选择2016年1月-2019年12月经产前诊断中心超声诊断为VSD 69例胎儿,其中丽水市妇幼保健院43例,金华市妇幼保健院26例。纳入标准:(1)产前超声诊断为VSD胎儿;(2)孕妇及家属均对研究知情。排除标准:(1)孕妇有遗传性疾病家族史;(2)孕妇合并严重妊娠期疾病或接触不良环境者;(3)临床资料不完整者;(4)配合度低,难以随访及完成数据收集者。根据“是否合并其他心脏结构异常”分为单纯型VSD组(33例)和非单纯型VSD组(36例),后者包括法洛氏四联症8例、合并肺动脉狭窄6例、合并房间隔缺损4例、完全性房室间隔缺损3例、合并三尖瓣返流3例及合并其他畸形12例。两组妊娠期间均无感染、严重妊娠期高血压及糖尿病等病史。两组孕妇年龄、胎儿孕周差异均无统计学意义(P>0.05)。详见表1。本研究经上述两家医院各自伦理委员会审批通过,且妇知情同意。
表1 两组一般资料比较(±s)
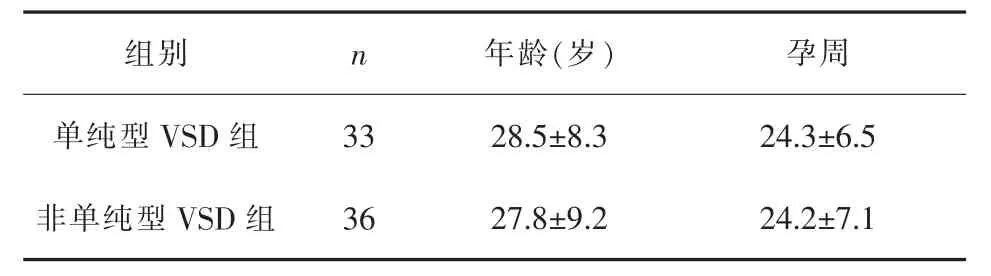
表1 两组一般资料比较(±s)
组别 n 年龄(岁) 孕周单纯型 VSD 组 33 28.5±8.3 24.3±6.5非单纯型 VSD 组 36 27.8±9.2 24.2±7.1
1.2 方法 对所有胎儿进行染色体核型分析和SNP array检测,根据接受产前诊断的孕周分别通过羊水路径、脐血路径获取胎儿样本,并收集胎儿父母外周血备用。分析候选致病基因并对生产结局和胎儿发育情况进行随仿。记录是否合并心脏外结构异常或超声软指标异常,包括NT异常、单脐动脉、脉络膜囊肿等。
1.2.1 染色体分析 (1)染色体核型分析。孕26周以下在无菌条件下抽取20mL羊水,采用胰蛋白酶消化法常规行羊水细胞培养、收获、制片,G显带;孕26周以上取1~2mL脐血标本接种培养、收获、制片、G显带,显微镜下计数20个细胞,如果发现性染色体异常应加倍计数,如怀疑嵌合体,则加数到100个细胞,分析5个核型。(2)CMA。①基因组DNA提取:采用德国Qiagen DNA试剂盒提取羊水、脐血或外周血基因组DNA。②CMA检测:采用美国Affymetrix公司的SNP array检测平台和Cyto Scan 750 K芯片检测的标准操作流程,分别进行基因组DNA的消化、连接、扩增、纯化、片段化、标记、杂交、洗涤及扫描,应用ChAS软件进行数据分析。检测 CNV 依据 DGV、OMIM、UCSC、DECIPHER 等公共数据库进行比对分析,同时依据CNV检测出性质,分成致病性CNV、可能致病CNV、临床意义不明CNV(VOUS)、可能良性CNV与良性CNV。由于样本量限制,本研究将可能致病CNV、临床意义不明 CNV及可能良性 CNV归类于 VOUS,对VOUS胎儿父母外周血样本进一步行SNP array检测,明确胎儿CNV来源以协助判断CNV的性质。比较两组染色体核型异常情况,以及致病性CNV、VOUS、良性CNV与未发现CNV的构成情况。
1.2.2 候选基因的筛选 使用以下标准:(1)在正常胎儿心脏组织和细胞系中有蛋白表达。使用Proteomics DB 数据库(https://www.proteomicsdb.org/)、Eurexpress数据库(http://www.eurexpress.org/ee/)、小鼠基因组信息学数据库中的基因表达数据库(http://www.informatics.jax.org/expression.shtmL);(2)参与心脏系统发育相关通路的基因和心血管系统发育过程中富集的基因。使用Netpath数据库(http://www.netpath.org/);(3)有先天性心脏病相关基因的文献;(4)小鼠基因组信息数据库中显示心血管表型异常的基因;(5)基因剂量敏感性查询。使用ClinGen数据库(https://dosa ge.clinicalgenome.org/index.shtmL)、ExAC 数 据 库 (http://exac.broadinstitute.org)。
1.2.3 随访情况 (1)引产情况。观察并记录所有胎儿妊娠结局和引产数。(2)合并心外异常情况。(3)VSD自然闭合。1周岁前复查幼儿心脏超声,比较两组幼儿VSD自然闭合情况。(4)发育情况。1周岁时,依据《WHO儿童生长发育标准(2006年版)》[4]行体格发育评估,包括头围、体质量、身高。其中一项小于同性别、同年龄儿童中位数减2个标准差评为“体格发育落后”。运用《0-6岁儿童神经心理发育量表》[5]进行智力评估,从大运动、精细动作、适应能力、语言、社交行为五个方面进行评估,计算发育商(DQ),DQ<70,评为“智力低下”。比较两组体格发育落后和智力发育落后的情况。
1.3 统计学处理 统计学分析采用SPSS 22.0统计软件进行数据分析,计数资料以百分率表示,组间差异比较采用χ2检验或Fisher’s检验。
2 结果
2.1 遗传学检测 69例VSD的胎儿中,10例(14.5%)染色体核型异常,其中染色体数目异常7例(18-三体综合征4例、21-三体综合征3例),染色体结构异常3例,两组染色体数目及结构异常比较差异无统计学意义(P>0.05),其余59例行CMA分析,发现两组致病性 CNV、VOUS、良性 CNV检出率差异均无统计学意义(P>0.05),详见表2。
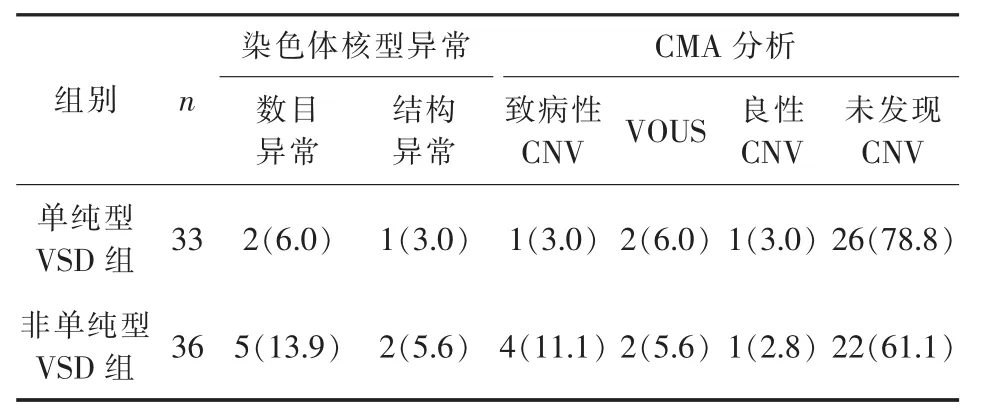
表2 两组室间隔缺损胎儿的遗传学检测结果[n(%)]
2.2 CMA分析
2.2.1 染色体核型结构异常患儿CMA分析 3例核型结构异常片段的大小及精确位点,其中1例(编号1)染色体异常片段包含Wolf-Hirshhorn综合征的关键区域;1例(编号3)染色体异常片段包含1q43-q44缺失综合征的关键区域。详见表3。

表3 染色体核型结构异常VSD胎儿CMA结果
2.2.2 染色体结构正常患儿CMA分析 核型正常的VSD胎儿中检测出CNV 11例(15.9%),其中7例通过父母验证发现2例来源于母亲;11例中致病性 CNV 5例(7.2%),VOUS占4例(5.8%);良性CNV有2例(2.9%)。致病性CNV中4例为已知的微缺失/微重复综合征(16p13.11微缺失综合征、DiGeorge综合征、22q11.2远端缺失综合征、1p36缺失综合征),另1例致病性CNV丢失片段大于10Mb,缺失片段包含多个已知致病基因。详见表4。

表4 染色体核型结构正常检出CNV胎儿CMA结果
2.3 候选基因的筛选 本文分析了与CHD相关的致病性CNV中以显性方式发挥作用的基因,通过基因功能富集分析筛选出7个CHD候选基因,其 中 TBX1、CRKL、DGCR6、MAPK1 位 于 22q11.2区段上;PRDM16、SKI、MYH11 分别位于 1p36.32、1p36.33-p36.32、16p13.11区段上。详见表5。

表5 CHD候选基因
2.4 随访及预后 69例VSD胎儿中共24例引产,非单纯型VSD组引产率52.8%(19/36)明显高于单纯型VSD组15.2%(5/33),差异有统计学意义(P<0.05)。合并心外异常率两组差异无统计学意义(P>0.05)。非单纯型VSD组17例胎儿分娩并存活,单纯型VSD组28例胎儿分娩并存活;随防至幼儿1周岁,VSD自然闭合者单纯型VSD组占10例(30.3%),非单纯型VSD组占2例(5.6%),单纯型VSD组自然闭合率高于非单纯型VSD组,差异有统计学意义(P<0.05)。1周岁时幼儿体检共发现体格发育落后3例,智力发育落后2例,两组体格、智力发育落后情况比较差异均无统计学意义(P>0.05)。 详见表 6。

表6 两组随访情况[n(%)]
3 讨论
高达90%的18-三体综合征患者合并CHD,其最常见的心脏缺陷类型为间隔缺损和动脉导管未闭[6]。在21-三体综合征患者中,VSD发生率为14%~27%[7]。本研究中经染色体核型分析也发现,最易合并VSD的非整倍体异常为18-三体综合征和21-三体综合征。与传统的核型分析相比,CMA在检测和识别CNV方面均具有较高的准确性和分辨率,越来越多的研究推荐将CMA用于CHD产前诊断[8]。利用CMA检测可进一步明确染色体核型结构异常片段的大小及精确位点。本研究明确1号病例和3号病例染色体结构异常片段分别包含Wolf-Hirshhorn综合征和1q43-q44缺失综合征的关键区域。在核型正常的胎儿中CMA额外检测出核型无法识别的16p13.11微缺失综合征、DiGeorge综合征、22q11.2远端缺失综合征,进一步证明这些微缺失、微重复综合征也是VSD的重要遗传学病因,通过父母验证有助于致病性的判定及明确致病性CNV的来源。CMA额外提高7.2%VSD病因检出率,提示该技术适用于VSD的遗传学病因诊断。本研究结果显示单纯型VSD组较非单纯VSD组核型数目及结构异常率无显著性差异。非单纯VSD组致病性CNV较单纯型VSD无增加,结果与邓琼等[9]研究一致。
研究发现,全基因组CNV可影响基因的剂量水平或改变基因功能,与CHD密切相关[10]。由于CNV可改变多个连续基因的剂量,不仅导致CHD,还可引起其他脏器的发育异常。通过数据库和文献检索分析致病性CNV中包含的基因,综合分析基因单倍剂量敏感性、基因在人体和动物模型中的定位及文献报道基因功能等资料有助于CHD候选基因的筛选。本研究共发现7个CHD候选基因。病例5为22q11.2片段缺失导致的DiGeorge综合征,该病临床表型包括CHD、颅面部畸形、神经系统障碍、胸腺发育不良或缺如等。DiGeorge综合征患者中CHD的发病率约为60%~80%[11],最常见的CHD类型为法洛氏四联症,而VSD是法洛氏四联症的缺陷之一。22q11.2区段包含50多个基因,其中与心脏细胞增殖发育有关的TBX1基因是以往研究的焦点,被认为是该病最主要的致病基因。近年来越来越多报道显示,除了TBX1以外,CRKL、DGCR6也是导致22q11.2缺失综合征患者心脏表型的重要病因。TBX1+/-,CRKL+/-的复合杂合变异小鼠通常会出现更严重的心脏缺陷[12],表明TBX1和CRKL基因可能存在相互作用,共同影响心脏发育。在鸡模型研究中,发现逆转录病毒介导的反义转导对神经嵴细胞DGCR6的抑制导致了与DGS相似的严重心血管异常的高发,提示DGCR6可能作为TBX1的转录调节因子而发挥作用[13]。病例6为22q11.2远端缺失综合征,以往研究显示本病最常见的CHD类型为VSD,位于LCR22-4和LCR22-5之间的MAPK1基因被认为是引起心脏发育异常的致病基因[14]。在马凡综合征小鼠模型中,MAPK1被激活,而通过选择性抑制MAPK1激活可改善小鼠主动脉生长[15]。1p36缺失综合征和16p13.11微缺失综合征所缺失片段中包含的PRDM16[16]、SKI[17]及MYH11[18]基因,上述基因在动物实验中被证实为参与心脏发育的剂量敏感基因,可能是CHD的候选基因,部分可能与VSD发育有关,具体机制有待进一步研究。本研究显示,CMA检测较传统的核型分析可明确染色体异常片段的大小及精确位点。并可通过基因富集和路径分析来了解CNV及相关基因与心脏发育的潜在相关性,初步筛选出CHD潜在的候选基因。
随访结果显示,两组合并心外异常率无差异,而非单纯VSD组引产率较单纯VSD组增加,可能因非单纯VSD合并其他严重的心脏畸形,增加了预后不良的风险,影响孕妇继续妊娠的信心。研究结果显示,1岁内单纯型VSD自然闭合率达30.3%,可见部分室间隔延迟闭合可能属于正常的变异。以往认为VSD对患儿出生后体格发育有较大的影响,而本研究发现,仅3例VSD患儿体格发育落后,可能与医疗水平的发展、VSD得到及时修补、生活卫生环境的改善等综合因素有关。本研究中两组各1例出现智力发育落后情况,说明VSD患儿有合并智力低下的可能,其机制有待进一步研究。
存在VSD的胎儿应进一步分析其染色体情况并行CMA检查,明确是否合并致病基因型,加强随访,为产前诊断提供更准确的依据。

