卵巢癌细胞中YTHDF2通过miRNA-146a调控EGFR的表达


摘要:N6-腺苷酸甲基化(m6A)修饰是真核细胞中RNA最常见的一种修饰方式,YTHDF2是m6A修饰系统发挥重要作用的基因。文章通过生物信息学和分子生物学实验结合的方法,验证了YTHDF2通过miRNA-146a对EGFR基因表达的分子调控机制,该信号通路的阐述有助于从表观遗传学角度更好的解释卵巢癌的发生发展机制,并为卵巢癌的早期诊断和治疗提供潜在的有效靶点。
关键词:卵巢癌;m6A;YTHDF2;miRNA-146a;EGFR
Abstract:N6-methyladenosine,namly m6A,acts as the most frequent modification in eucaryotic cells,and YTHDF2 play a significant role in the m6A modification complex. This article demonstratesd that YTHDF2 could modulate the expression of EGFR via miRNA-146a,using the bioinformatics combined with molecular experiments. The establishment of the signal pathway favors the molecular mechanic eluciation of ovarian cancer innitiation and progression,thereby providing a potential candidate for the eraly diagnosis and treatment of ovarian cancer.
Key words: Ovarian cancer;m6A;YTHDF2;miRNA-146a;EGFR
【中图分类号】R271.1 【文献标识码】A 【文章编号】1673-9026(2021)13-02
1 前沿
卵巢癌是常见的女性恶性肿瘤之一,并且是导致女性癌症死亡的第四大原因,但长期以来,由于对卵巢癌分子发病机制的认识不完全且缺乏早期有临床意义的筛查标志物,约有50%的卵巢癌在确诊时已处于晚期,导致总生存期较差[1]。因此,发掘卵巢癌发生发展相关的分子驱动因子,开发针对早期卵巢癌的筛查方法,对于卵巢癌的早期诊断和治疗具有较高临床应用价值。
到目前為止,在生物体中已经鉴定出超过150种RNA修饰方式,RNA内部修饰主要用于维持mRNA的稳定性,常见的RNA修饰方式有
N6-腺苷酸甲基化(m6A)、N1-腺苷酸甲基化(m1A)、胞嘧啶羟基化(m5C)等,但m6A修饰是真核生物RNA中最常见的一种修饰方式[2]。哺乳动物的RNA中大约有0.1–0.4%的腺苷酸存在m6A修饰现象,大约占了所有甲基化核苷酸的50%。与m6A RNA修饰相关的酶系统主要分为三部分:甲基化酶、去甲基化酶、甲基化相互作用蛋白,METTL3,METTL14,WTAP,RBM15/15B,KIAA1429,ZC3H13和METTL16是常见的甲基化酶;ALKBH5、ALKBH3、FTO是常见的去甲基化酶;YTHDF1,YTHDF2、YTHDF3、YTHDC1、YTHDC2是常见的与甲基化相互作用的蛋白[3]。RNA的m6A修饰主要存在于RRm6ACH([G/A/U][G/A]m6AC[U/A/C])保守序列,而且主要集中在3′UTR区和长的外显子内部[3-4]。此外,在mRNA前体(pre-mRNA)和长链非编码RNA中(lncRNA)存在较多的m6A修饰[4]。m6A修饰几乎可以影响RNA代谢的每一个过程,如:RNA的转录、剪接、出核、降解和翻译等生物学过程,从而调控基因表达[5]。RNA m6A修饰与多种疾病相关,包括肿瘤、神经性疾病和胚胎发育迟缓等。
非编码RNA是指不编码蛋白质的RNA,包含rRNA、tRNA、snRNA、snoRNA 和microRNA等,能够调控肿瘤细胞的增殖、侵袭、细胞凋亡和自噬等多种生理过程[6]。 microRNA是一类重要的非编码RNA,它能够影响多种生物学过程,比如免疫反应、炎症反应和肿瘤形成等[7-8]。
m6A修饰对非编码RNA的功能、转运、降解等过程产生调控作用[9-11]:①m6A修饰能够调控microRNA的加工成熟过程,促进它的降解,进而抑制下游靶基因的表达;②m6A修饰能够影响多种与细胞增殖和致癌相关的microRNA的转录;③miR-106b、miR-18a/b、miR-3607、miR-423、miR-30a和miR-320b/d/e等多种microRNA上存在的m6A修饰能够影响亚砷酸盐诱导的肿瘤发生过程。
我们通过m6A在线预测软件分析发现miR-146a上存在m6A修饰位点,YTHDF2作为m6A修饰系统的重要成员,是否对miR-146a发挥调控作用?此外,通过miRNA靶点预测软件分析发现EGFR基因是miR-146a下游潜在的作用靶点,那么YTHDF2是否可以通过miR-146a调控EGFR基因的表达转录?本研究中我们将分别对以上问题进行探讨。
2 材料与方法
(1)细胞培养和RNAi实验
实验将采用常用的COV504(浆液性卵巢癌细胞系)和A2780(卵巢子宫内膜样腺癌细胞系)人卵巢癌细胞系。COV504细胞系培养于添加了10%FBS、100μg/mL青霉素和100μg/mL链霉素的RPMI1640培养基 (Life Technologies)。A2780细胞系培养于添加了10%FBS、100μg/mL青霉素和100μg/mL链霉素的Eagle培养基(Gibco),所有细胞置于含有5%CO2的37℃湿化培养箱中进行培养。
在RNAi實验中,使用Lipofectamine 2000进行siRNA转染,实验过程需设置阴性对照,siRNA将由RiboBio (广州,中国)合成。
(2)RNA提取及荧光定量PCR实验(Quantitative real-time PCR)
使用Trizol(Invitrogen)从组织和细胞中提取RNA,反转录实验使用PrimeScript RT Master Mix(Takara)。SYBR qPCR Mix(Toyobo)用于RT-PCR,采用2-ΔΔCT法评估YTHDF2和EGFR等基因的表达水平,β-actin基因用作内参基因。
(3)miRNA的克隆、表达和检测
按照pcDNA3.3-TOPO TA克隆试剂盒的操作说明,将192bp的DNA片段(将包含miRNA-146a前体序列)插入哺乳动物表达载体pcDNA3.3-TOPO(Invitrogen),通过测序确认插入片段,将插入片段的新载体命名为pcDNA3.3-miR-146a。按照DOTA脂质体转染(Roche)试剂盒操作说明,将pcDNA3.3-miR-146a载体转入COV504和A2780卵巢癌细胞系中。48小时后,使用mirVana miRNA 提取试剂盒(Applied Biosystem)提取miRNA,使用ABI 7500荧光定量PCR仪(Applied Biosystem)对成熟miR-146a进行定量(2-ΔΔCT)。每个实验重复三次。
3 结果
3.1卵巢癌细胞中YTHDF2基因在转录后水平调控miR-146a的转录
我们通过SRAMP(http://www.cuilab.cn/sramp/)对miR-146a中可能存在的m6A位点进行在线预测,发现miR-146a中存在1个潜在的m6A甲基化位点(图 1A),且YTHDF2敲除细胞系中miR-146a的转录水平存在一定程度的上调(图 1B),所以我们推测m6A识别蛋白YTHDF2通过识别miR-146a的m6A修饰位点,介导miR-146a的降解,进而在转录后水平调控miR-146a的转录。
3.2 EGFR是miR-146a的下游靶基因
为了确定miR-146a下游靶基因,我们通过miRmap(http:// mirmap.ezlab.org/),microT(http://www.microrna.gr/ microT),miRanda(http://www.microrna.org/microrna/home.do) 和 PITA(http://genie.weizmann.ac.il/pubs/ mir07/mir07_data.html)等多种miRNA靶点预测软件预测miR-146a的下游靶基因,miR-146a能够靶向结合EGFR基因(图2A),RT-PCR(图2B和2C)证明miR-146a的敲除和过表达均能影响EGFR的表达。
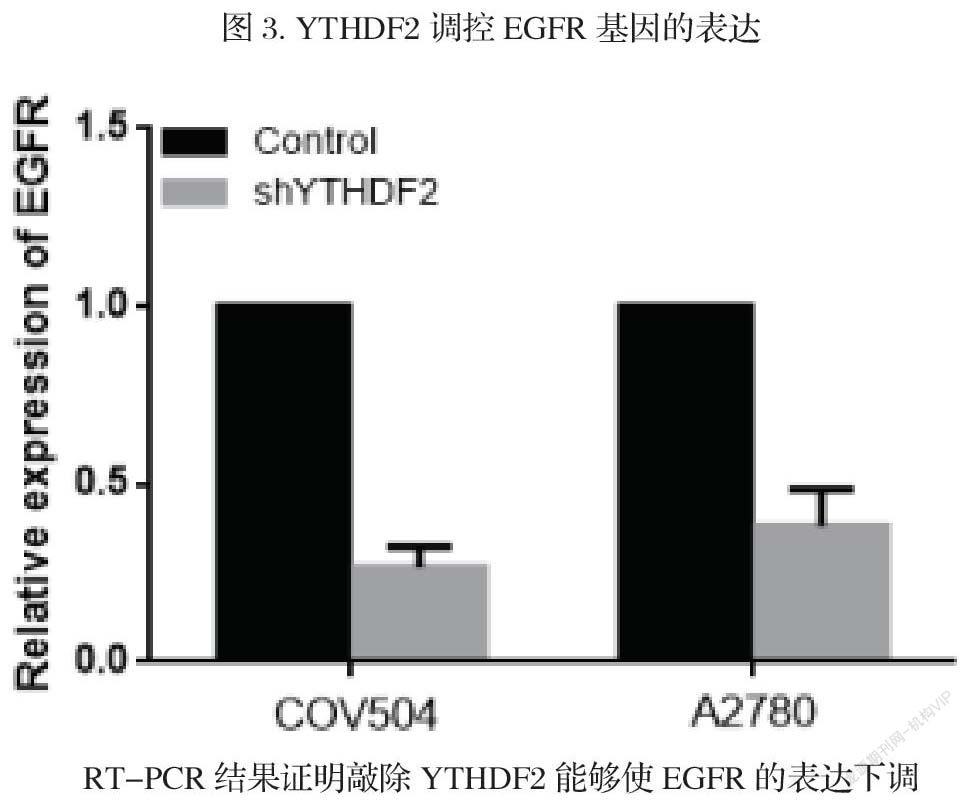
3.3 YTHDF2调控EGFR基因的表达
4 讨论
文章首次从表观遗传学角度揭示了m6A识别蛋白YTHDF2通过miR-146a对EGFR基因的分子调控机制,该信号通路在卵巢癌中的研究在国内外尚属首次,该通路的建立有助于从表观遗传学角度更好的解释卵巢癌的发病机制,并为卵巢癌早期诊断、临床分期、分子分型、预后评估、PARP抑制剂耐药机制等方面的研究提供参考,同时为卵巢癌的靶向/免疫治疗提供潜在的、有效的生物标记物。
参考文献:
[1]Hua W,Zhao Y,Jin X,et al. METTL3 promotes ovarian carcinoma growth and invasion through the regulation of AXL translation and epithelial to mesenchymal transition[J]. Gynecologic Oncology,2018,151(2): 356-365.
[2]Lan Q,Liu PY,Haase J,et al. The critical role of RNA m6A methylation in cancer[J]. Cancer Research,2019,79(7): 1285-1292.
[3]Kane SE,Beemon K. Precise localization of m6A in Rous sarcoma virus RNA reveals clustering of methylation sites: implications for RNA processing[J]. Molecular and Cellular Biology,1985,5(9): 2298-2306.
[4]Lan Q,Liu PY,Haase J,et al. The critical role of RNA m6A methylation in cancer[J]. Cancer Research,2019,79(7): 1285-1292.
[5]Dai D,Wang H,Zhu L,et al. N6-methyladenosine links RNA metabolism to cancer progression[J]. Cell Death & Disease,2018,9(2): 1-13.
[6]Fazi F,Fatica A. Interplay between N6-methyladenosine (m6A) and non-coding RNAs in cell development and cancer[J]. Frontiers in Cell and Developmental Biology,2019,7: 116.
[7]Chen Y,Lin Y,Shu Y,et al. Interaction between N 6-methyladenosine (m 6 A) modification and noncoding RNAs in cancer[J]. Molecular Cancer,2020,19: 1-14.
[8]Yi YC,Chen X Y,Zhang J,et al. Novel insights into the interplay between m 6 A modification and noncoding RNAs in cancer[J]. Molecular Cancer,2020,19(1): 1-10.
[9]Zhang J,Bai R,Li M,et al. Excessive miR-25-3p maturation via N 6-methyladenosine stimulated by cigarette smoke promotes pancreatic cancer progression[J]. Nature Communications,2019,10(1): 1-15.
[10]Han J,Wang J,Yang X,et al. METTL3 promote tumor proliferation of bladder cancer by accelerating pri-miR221/222 maturation in m6A-dependent manner[J]. Molecular Cancer,2019,18(1): 1-15.
[11]Gu S,Sun D,Dai H,et al. N6-methyladenosine mediates the cellular proliferation and apoptosis via microRNAs in arsenite-transformed cells[J]. Toxicology Letters,2018,292: 1-11.
作者簡介:第一作者赵强,1986年出生,男,汉族,山东临沂人,博士,现就职于天津市肿瘤医院空港医院,助理研究研员,主要从事肿瘤学研究。
基金项目:天津市卫生健康科技项目(RC20189)

