霍山石斛菌根真菌多样性及差异性的研究
刘 丽,陈绍通,张 腾,李 琳,刘旭宇,韩邦兴,4*
1安徽中医药大学药学院,合肥 230031;2皖西学院生物与制药工程学院,六安 237012;3华南农业大学,广州 510000;4安徽省中药资源保护与持续利用工程实验室,六安 237012
霍山石斛(DendrobiumhuoshanenseC.Z.Tang et S.J.Cheng)来源于兰科石斛属,为多年生草本植物,具有增强人体免疫力、抗氧化、修复肝损伤、制止心血管疾病发生等功效[1-3]。霍山石斛不仅有着极大的保健医疗价值,而且食用历史悠久;近几年,随着越来越多的人开始关注保健产品,其市场需求量不断增加[4]。霍山石斛常以三年生入药,不同生长年限的霍山石斛,其药材质量也有所差异。石斛属植物的生长形式是合轴式生长,主轴生长到一定阶段就会停止生长,开始发出侧芽形成新轴,同样到一定阶段后,新轴上继续发出侧芽又形成新轴,依此往复,植物得以不断生长。按照发芽时间的前后将霍山石斛分为三年茎(ⅢY3)、二年茎(ⅢY2)、一年茎(ⅢY1),分别对应根ⅢR3、ⅢR2和ⅢR1;同理,二年生的霍山石斛可分为一年茎(ⅡY1),二年茎(ⅡY2),各自对应根ⅡR1和ⅡR2,一年生的霍山石斛为ⅠY1,对应根ⅠR1[5]。研究发现,微生物对兰科植物的影响不仅关乎种子萌发[6],还能促进生长发育[7]及成分积累等[8]。
迄今为止对石斛菌根真菌的研究一般采用传统培养分离法,已报道的有半知菌门(Deuteromycotina)的丝核菌属(Rhizoctonia)、链格孢属(Alternaria)[9,10],子囊菌门(Ascomycota)的毛壳菌属(Chaetomium)、炭角菌属(Xylaria)、刺盘孢属(Colletotrichum)、镰刀菌属(Fusarium)[9,11],担子菌门(Basidiomycota)的胶膜菌属(Tulasnella)[9,12]、小菇属(Mycena)、蜡壳菌属(Sebacina)和角担菌属(Ceratobasidium)[9,13]等。向石斛属植物接种菌根真菌不仅能够促进植株生长,还具有不同程度的抗旱、抗病以及促进石斛碱和多糖的积累等作用[14-16]。虽然近几年利用传统培养分离方法对石斛属植物内生菌的研究较多,但因为微生物培养具有很大的随机性和盲目性,99%的微生物无法分离得到[17],目前关于一年生霍山石斛菌根真菌的研究尚未见报道。本文运用高通量测序技术以三种类型一年生霍山石斛菌根真菌为研究对象,目的是能够系统了解其群落多样性、差异性及结构组成,为指导霍山石斛合理采收及应用提供依据。
1 材料与方法
1.1 样品采集
每隔两个月于皖西学院药用植物园设施栽培基地采集三种一年生类型(ⅠR1、ⅡR1和ⅢR1)霍山石斛样品,方法为五点随机取样法,样品经皖西学院韩邦兴教授鉴定。本实验以1年生霍山石斛的根为研究对象(从不同生长年限的植物丛中分得),ⅢR1取自ⅢY1茎下对应的根,ⅡR1取自ⅡY1茎下对应的根,ⅠR1取自ⅠY1茎下对应的根。具体测序样品信息见表1。

表1 三种类型一年生霍山石斛样品Table 1 Three types of annual D.huoshanense samples
1.2 方法
1.2.1 样品消毒处理
将采集的霍山石斛植株用无菌剪刀剪取根,用自来水冲洗干净,置于超净工作台内晾干,样品消毒:置于0.1%升汞中浸泡2~3 min,无菌水漂洗3~4次,再置于75%的乙醇中浸泡3 min,无菌水漂洗5~6次,最后用干燥无菌滤纸擦去表面附着的水分,并将须根两端用无菌剪刀除去,保留中间段。将最后一次冲洗的无菌水均匀涂布于PDA培养基上,28 ℃黑暗培养3~7天,观察是否有菌长出,以此验证表面消毒的有效性。
1.2.2 DNA提取、PCR扩增及测序分析
将上述消毒完全的样品,按照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit说明书的步骤进行DNA提取,并用琼脂糖凝胶检查DNA的提取效果。真菌ITS1-2扩增区域采用通用引物ITS1F和ITS2R进行扩增。反应体系见表2,扩增程序见表3。霍山石斛样品DNA检测合格之后,由上海生工生物工程股份有限公司利用Illumina MiSeqTM平台进行测序。

表2 反应体系Table 2 Reaction system

表3 扩增程序Table 3 Amplification procedure
1.2.3 数据处理及分析
利用QIIME1.8.1对所得到的基因序列进行拼接、过滤、去除嵌合体及非特异性扩增序列,得到各样本高质量序列[18]。将高质量的序列与数据库中代表性序列进行比对。通过Usearch将所有样本序列根据序列间的距离进行聚类,然后按照97%的相似性将序列分成不同的操作分类单元(OTU),在此基础上,选择丰度最高的序列作为OTU的代表性序列,而后进行各类分析[19]。使用R的Venn Diagram包做出Venn图,以此统计样本中共有及特有OTU的数量;通过Mothur计算Alpha多样性指数,如Shannon指数、Simpson指数、Chao1指数及覆盖率(coverage)[20];采用Mothur对相似水平是97%的OTU进行稀释性分析,检测样品的取样深度。采用R对物种分类学统计结果作图,计算样品中所含何种微生物以及各微生物的相对丰度。采用统计学方法进行差异特征发现和显著性检验,LEfSe(linear discriminant analysis effect size,线性判别分析及影响因子)通过将统计显著性的标准检验与编码生物一致性和效应相关性的附加检验相结合,确定最能解释组间差异的基因[21]。
2 结果
2.1 物种组成(OTU)分析
对真菌ITS1-2区域进行高通量测序,共得到898 663条高质量序列,基于≥97%的相似度水平,通过聚类分析共获得1 928个有效OTUs(见图1),其中ⅠR1中有787个OTUs,ⅡR1中有1 018个OTUs,ⅢR1中有903个OTUs,200个OTUs共同存在于三组。ⅠR1中特有389个OTUs,ⅡR1特有516个OTUs,ⅢR1中特有443个OTUs。随着15个霍山石斛根部样品的序列数不断增加,其稀释性曲线越来越趋于平缓,说明即使继续增加取样量也只能产生极少量新的OTU(见图2),说明取样量合理,能够比较准确地反映霍山石斛菌根真菌群落。

图1 霍山石斛菌根真菌物种(OTUs)组成Venn图Fig.1 Venn diagram of species composition of mycorrhizal fungi (OTUs) of D.huoshanense
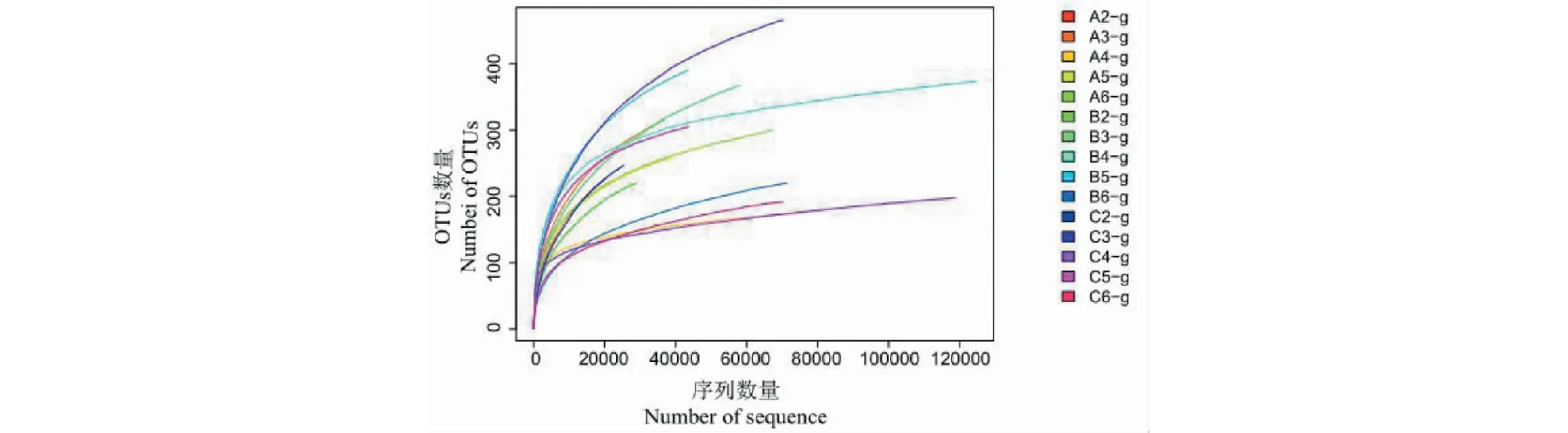
图2 样品真菌测序的稀释曲线Fig.2 Dilution curve of fungal sequencing
2.2 多样性指数分析
三组样品的Alpha多样性指数如表4所示。用Shannon指数量化微生物群落多样性。ⅡR1、ⅢR1、ⅠR1组的平均Shannon指数分别为2.79、2.74、2.42,IIR1>ⅡIR1>IR1。用Chao1算法评估物种丰富度大小。ⅠR1、ⅡR1、ⅢR1三组群落分布丰度的Chao1指数分别为320.7、394.27、365.81;同样,ⅡR1的菌根真菌丰富度最大,ⅠR1最小。霍山石斛各样品的coverage值达到1.00,表明该测序结果能够代表样本的真实情况。Alpha多样性评价箱式图评估了三组样本的离散及分布情况(见图3),Shannon指数的箱式图表明三组样品的菌落的均匀度基本一致(P>0.05),Chao1指数的箱式图表明三组样品的物种丰富度基本一致(P>0.05)。

图3 Alpha多样性评价菌根真菌菌群Fig.3 Alpha diversity evaluation of mycorrhizal fungi flora注:a:Shannon指数多样性;b:Chao1指数多样性。Note:a:Shannon index diversity;b:Chao1 index diversity

表4 菌根真菌的Alpha多样性指数表Table 4 Alpha diversity index of mycorrhizal fungi
2.3 群落组成分析
基于OTUs聚类分析得到9个门,30个纲,71个目,149个科,244个属。在门水平,霍山石斛根真菌主要集中在子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和毛霉门(Mucoromycota)三个门,占霍山石斛菌根真菌总量的90%左右(见表5);同时5月份的三个样品A6、B6、C6中子囊菌门的丰度最大,担子菌门的丰度最小;9月份的两个样品A2、C2中担子菌门的丰度最大,子囊菌门的丰度最小。在属水平,unclassified Serendipitaceae、unclassified Auriculariales、Zymoseptoria、unclassified Pleosporales、Fusarium、unclassified Agaricomycetes在三种类型一年生霍山石斛菌根真菌中占优势(见表6)。unclassified Serendipitaceae在ⅠR1中丰度最大(>45%),在ⅢR1中丰度最小(<5%),相反Fusarium在ⅠR1中丰度最小(<5%),在ⅢR1中丰度最大(>20%);Zymoseptoria在ⅡR1中丰度最大(>10%),而在ⅠR1、ⅢR1上均小于5%。

表5 门水平各样品菌群丰度Table 5 Abundance of fungus in each sample at phylum level (%)

表6 属水平各组样品菌群丰度Table 6 Abundance of fungus in each group of the genus level (%)
2.4 菌群差异分析
应用LEfSe对三种类型一年生的霍山石斛样品的菌根真菌进行分析,发现44个差异丰富的分类学分支(a = 0.01,LDA score≥2.0)(见图4)。在属水平(见图4a),ⅠR1组的拟棘壳孢属(Pyrenochaetopsis)、青霉菌属(Penicillium)与其他两组存在显著差异,且在该组丰度最高;ⅡR1组刺球菌属(Chaetosphaeria)、柱霉属(Scytalidium)、鞘孢属(Chalara)、Zymoseptoria、红酵母属(Rhodotorula)、Kockovaella与其他两组存在明显丰度差异;ⅢR1组Zasmidium、unclassified Stachybotryaceae、阿太菌属(Athelia)、糙孢菌属(Trechispora)与其他两组存在明显丰度差异。
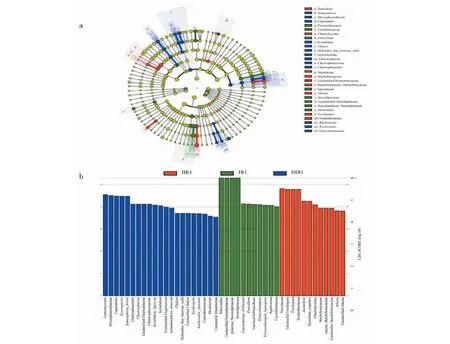
图4 三种类型一年生霍山石斛菌根真菌的LEfSe结果Fig.4 LEfSe results of three types of mycorrhizal fungi of D.huoshanensis
3 讨论与结论
植物根系微生物不仅能够通过调控基因表达来促进化学成分合成[22],还可以增加次生代谢产物的积累[23]。近年来对石斛属植物根系微生物研究普遍,如石斛属植物菌根真菌的特异性与寄主植物系统发育的关系[24],研究发现石斛属植物铁皮石斛的根中广泛分布子囊菌门、担子菌门真菌[25,26]等。由于微生物培养的方法研究内生菌存在局限性,本文采用高通量测序技术发现霍山石斛根部内生真菌丰富多样,子囊菌门、担子菌门为霍山石斛根部内生真菌的主要真菌门,ⅠR1、ⅡR1、ⅢR1有各自的优势菌,与子囊菌门、担子菌门在丹参、石斛属等药用植物内生真菌中也占主导地位报道基本一致[27,28]。通过Alpha多样性分析发现三组样品不管是在物种丰富度还是群落多样性比较上均无显著差异。而LEfSe进行组间内生真菌菌群差异分析发现,ⅠR1组有3个科与其他两组存在显著差异,且在该组丰度最高;ⅡR1组有5个科与其他两组存在明显丰度差异;ⅢR1组有4个科与其他两组存在明显丰度差异。
已有研究表明,中药茅苍术夏季的菌根内生真菌多样性高于春季和秋季[29]。本研究也对不同季节的霍山石斛根部内生真菌进行了考察,发现5月份霍山石斛根中子囊菌门的丰度最大,担子菌门的丰度最小,9月份担子菌门的丰度最大,子囊菌门的丰度最小,说明季节可能是影响霍山石斛菌根真菌群落结构的重要因素。在后续研究中,拟将石斛根际微生物结合化学成分,重点研究根系微生物对霍山石斛有效成分的影响,为提高霍山石斛品质、开发菌肥提供科学依据等。
综上所述,本研究应用Illumina MiSeq高通量测序方法对霍山石斛菌根真菌ITS1-2区进行测序,得到898 663条ITS rRNA序列,1 928个OTUs,基于OTU聚类分析得到9个门,30个纲,71个目,149个科,244个属,其中子囊菌门、担子菌门和毛霉门为霍山石斛根部内生真菌的主要真菌门,在5月份子囊菌门的丰度最大,担子菌门的丰度最小;LEfSe分析发现三种类型一年生霍山石斛菌根真菌有44个差异丰富的分类学分支(a = 0.01,LDA score≥2.0);通过Alpha多样性分析发现无论是物种组成还是多样性方面,均是ⅡR1>ⅢR1>ⅠR1,但是Alpha多样性评价箱式图反映了三组并无显著差异。

