尼古丁通过α7亚型烟碱型乙酰胆碱受体影响牙周膜干细胞成骨分化实验研究
刘 芬,朱 斌,翟 敏,葛 鑫,周志斐
(1.西安交通大学附属西北妇女儿童医院口腔科,陕西 西安 710061;2.西藏军区总医院口腔科,西藏 拉萨 850000;3.西安市人民医院 西安市第四医院口腔科,陕西 西安 710004)
牙周炎是一种导致牙周组织破坏的慢性疾病。若缺乏有效治疗,将最终引起牙齿脱落[1]。牙周膜干细胞(Periodontal ligament stem cells,PDLSCs)是一种在牙周膜组织中分离出的间充质干细胞亚群,在牙周组织再生中发挥着关键作用[2]。吸烟是牙周炎的重要高危因素[3],其可能机制为:在尼古丁作用下牙周膜细胞分泌白细胞介素(IL)-8等炎性因子,破坏牙周组织的稳定结构[4]。α7亚型烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7 nAChR)是尼古丁的重要受体[5]。前期研究[6]已经表明该受体在大鼠和人的牙周组织中存在表达。因此,α7 nAChR所介导的信号通路可能是吸烟相关性牙周炎骨破坏的重要机制之一。研究[7-8]表明,在人牙槽骨成纤维细胞中尼古丁还能够上调Wnt信号通路,且PDLSCs中Wnt信号通路的激活能够抑制细胞的成骨分化。由此推测尼古丁通过表达于PDLSCs中的α7 nAChR影响下游Wnt通路,从而调节PDLSCs的成骨分化,本研究即对此进行观察,希望能为吸烟相关性牙周炎的机制探索提供理论依据和实验参考。
1 材料与方法
1.1 细胞培养 自8例患者(12~23岁)获取14颗因正畸需要而拔除的健康前磨牙和第三磨牙。PDLSCs的分离和培养按照前期研究开展[9]。牙齿用无菌磷酸盐缓冲液冲洗后自根中1/3刮取牙周膜组织。将牙周膜组织块接种于6孔板,放置于37 ℃含有95%空气和5% CO2的孵箱中培养。极限稀释法挑选能够形成单细胞克隆的细胞集落体外扩大培养PDLSCs。第2~4代细胞用于后续实验。本研究获本院伦理审查委员会批准通过。
1.2 免疫表型分析 按照前期文献[10]描述的方法对PDLSCs进行干细胞表面标志物分析。取第3代5×105个PDLSCs孵育抗体1 h。藻红蛋白发光的多克隆抗体有抗人CD146(批号:102419,Biolegend)、CD34(批号:119328,Biolegend),CD31(批号:MA3100,eBioscience)。荧光素异硫酸发光的多克隆抗体有抗人stro-1(批号:340101,Biolegend)、CD105(批号:12-1057-42,eBioscience)、CD90(批号:45-0909-41,eBioscience)、CD44(批号:157107,Abcam)和CD14(批号:17-0141-81,eBioscience)。抗体孵育在4 ℃环境下避光进行。完成后磷酸盐缓冲液清洗,流式细胞仪检测。
1.3 PDLSCs成骨/成脂诱导分化 按照前期文献[11]实验步骤开展PDLSCs成骨/成脂分化诱导。6孔板每孔接种5×104个细胞。成骨诱导液中含100 nmol/L地塞米松(批号:D4902,Sigma)、50 μg/ml维生素C(批号:50-81-7,Sigma)和5 mmol/L β-甘油磷酸钠(批号:G9422-10G,Sigma)。成脂诱导液中含有0.5 mmol/L甲基异丁基黄嘌呤(批号:I7018-100mg,Sigma)、0.5 mmol/L氢化可的松(批号:H0888-1G,Sigma)和60 mmol/L吲哚美辛(批号:I7378,Sigma)。定向诱导21 d后,用油红O染液(批号:O0625-25G,Sigma)或2%茜素红染液(批号:A5533-25G,Sigma)对诱导的细胞分别进行染色。
1.4 细胞增殖检测(WST-1法) 利用WST-1细胞毒性分析试剂盒检测尼古丁(批号:N3876,Sigma)对PDLSCs的毒性作用。96孔板每孔接种5×103个细胞,每孔含培养液100 μl。24 h后不同浓度尼古丁作用于细胞作为实验组,以不加尼古丁干预的细胞为对照组。连续7 d在固定时间每孔加入10 μl WST-1试剂,避光孵育4 h。在450 nm波长下读取每孔吸光度值。
1.5 RNA提取和实时定量PCR检测 利用TRIzol试剂(批号:15596028,Invitrogen)提取PDLSCs总RNA。利用反转录试剂盒将所得RNA反转录为cDNA,反应体系3 μl。按照荧光实时定量PCR试剂盒说明配置PCR反应体系。本研究所用基因包括ALP、OCN、Runx2、BSP、β-actin,其中β-actin为内参。各基因引物序列见表1。

表1 各基因引物序列
1.6 蛋白提取和Western blot检测 蛋白裂解液提取PDLSCs总蛋白。定量试剂(批号:P0009,Beyotime)在595 nm波长下测量吸光度进行蛋白定量。Western blot检测上样体系为每泳道40 μg蛋白。Western blot检测所用一抗包括抗人ALP一抗(批号:ab154100,Abcam)、抗人OCN一抗(批号:ab93876,Abcam)、抗人DKK1一抗(批号:sc-374574,Santa Cruz)、抗人BSP一抗(批号:sc-73634,Santa Cruz)、抗人Runx2一抗(批号:sc-390351,Santa Cruz)、抗人p-GSK-3β一抗(批号:sc-81496,Santa Cruz)、抗人α7 nAChR一抗(批号:sc-1447,Santa Cruz)、抗人β-catenin一抗(批号:D-10A8,Cell Signaling)、抗人GSK-3β一抗(批号:3D10,Cell Signaling)以及抗人活化β-catenin一抗(批号:05-665,Millipore)。
1.7 统计学方法 采用SPSS 16.0 统计学软件分析处理数据。计量资料以均数±标准差的形式表示。采用双尾非配对t检验比较两组间数据差异。对于三组及以上数据差异,使用单因素方差分析比较,之后用Turkey检验进行两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 PDLSCs分离与鉴定 PDLSCs能够形成单细胞克隆(图1A)。镜下可见PDLSCs贴壁生长(图1B)。体外定向诱导3周后,细胞出现成骨及成脂分化(图1C、D)。流式细胞仪检测结果显示,PDLSCs间充质干细胞表面标志物CD44、CD90、CD105、CD146和Stro-1表达阳性,造血细胞标志物CD34、多核细胞标志物CD14及血小板内皮细胞标志物CD31表达阴性(图1E)。
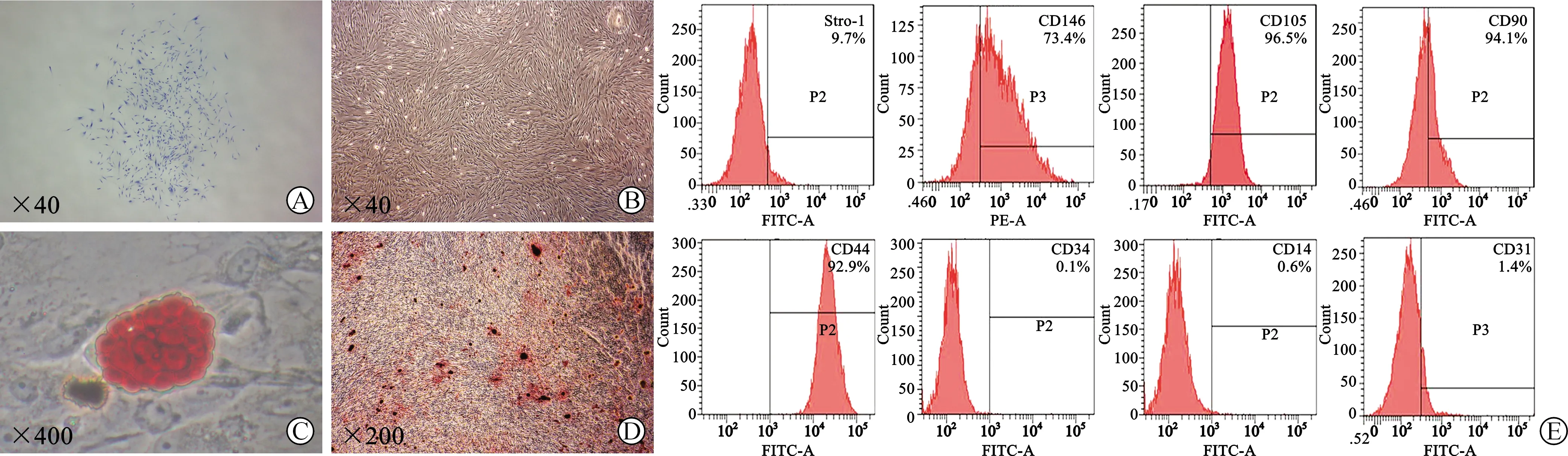
A:极限稀释法挑选单细胞克隆集落(甲苯胺蓝染色);B:PDLSCs贴壁生长;C:成脂诱导21 d后油红O染色;D:成骨诱导21 d后茜素红染色;E:流式细胞仪检测PDLSCs表面分子标志物表达情况
2.2 尼古丁影响PDLSCs形态并抑制其增殖 对照组PDLSCs细胞核清晰(图2A)。10-3mol/L尼古丁作用24 h后,细胞内可见空泡样改变(图2B)。尼古丁浓度为10-4mol/L时,胞质内颗粒状物质增多(图2C)。当尼古丁浓度为10-5、10-6、10-7mol/L时,细胞形态改变不显著(图2D-F)。细胞增殖检测结果提示10-3mol/L尼古丁作用后,PDLSCs增殖能力显著下调(P<0.05),10-7~10-4mol/L尼古丁作用后PDLSCs增殖能力同样出现减退(P<0.05),见图2G。
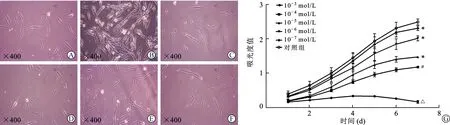
A:对照组PDLSCs形态;B:10-3 mol/L尼古丁作用后PDLSCs可见空泡状变性;C-F:10-7~10-4 mol/L尼古丁作用下可见胞浆内颗粒状物质增加;G:PDLSCs增殖情况比较,与对照组相比,*P<0.05,#P<0.01,△P<0.001
2.3 尼古丁通过激活α7 nAChR抑制PDLSCs成骨分化能力 在尼古丁(10-4mol/L)作用下,α7 nAChR表达进一步增强,而α7 nAChR特异性拮抗剂α-BTX(10-8mol/L)则能部分逆转α7 nAChR表达上调趋势(均P<0.05),见图3A、B。尼古丁浓度为10-4mol/L时,PDLSCs形成矿化结节的能力显著下降,而此作用能够被α-BTX部分逆转(均P<0.05),见图3C、D。尼古丁作用14 d后qRT-PCR检测发现,成骨相关基因ALP、OCN、BSP、Runx2表达显著下降,加入α-BTX后尼古丁的抑制作用减弱(均P<0.05),见图3E。ALP、OCN、BSP、Runx2蛋白表达变化呈现类似趋势(图3F)。
2.4 尼古丁通过Wnt/β-catenin通路激活α7 nAChR抑制PDLSCs成骨分化 Western blot检测发现,活化型β-catenin蛋白表达在尼古丁作用下上调,在α-BTX协同作用下表达减弱;Wnt通路抑制蛋白DKK1和GSK-3β在尼古丁作用后表达下调,加入α-BTX后尼古丁作用均减弱;磷酸化GSK-3β(p-GSK-3β)与GSK-3β变化趋势相似(均P<0.05),见图4。而在DKK1(10 ng/ml)作用下,尼古丁对PDLSCs成骨分化能力的抑制作用得到逆转,成骨分化相关基因ALP、OCN、BSP、Runx2及其蛋白表达变化呈现类似趋势(均P<0.05)。
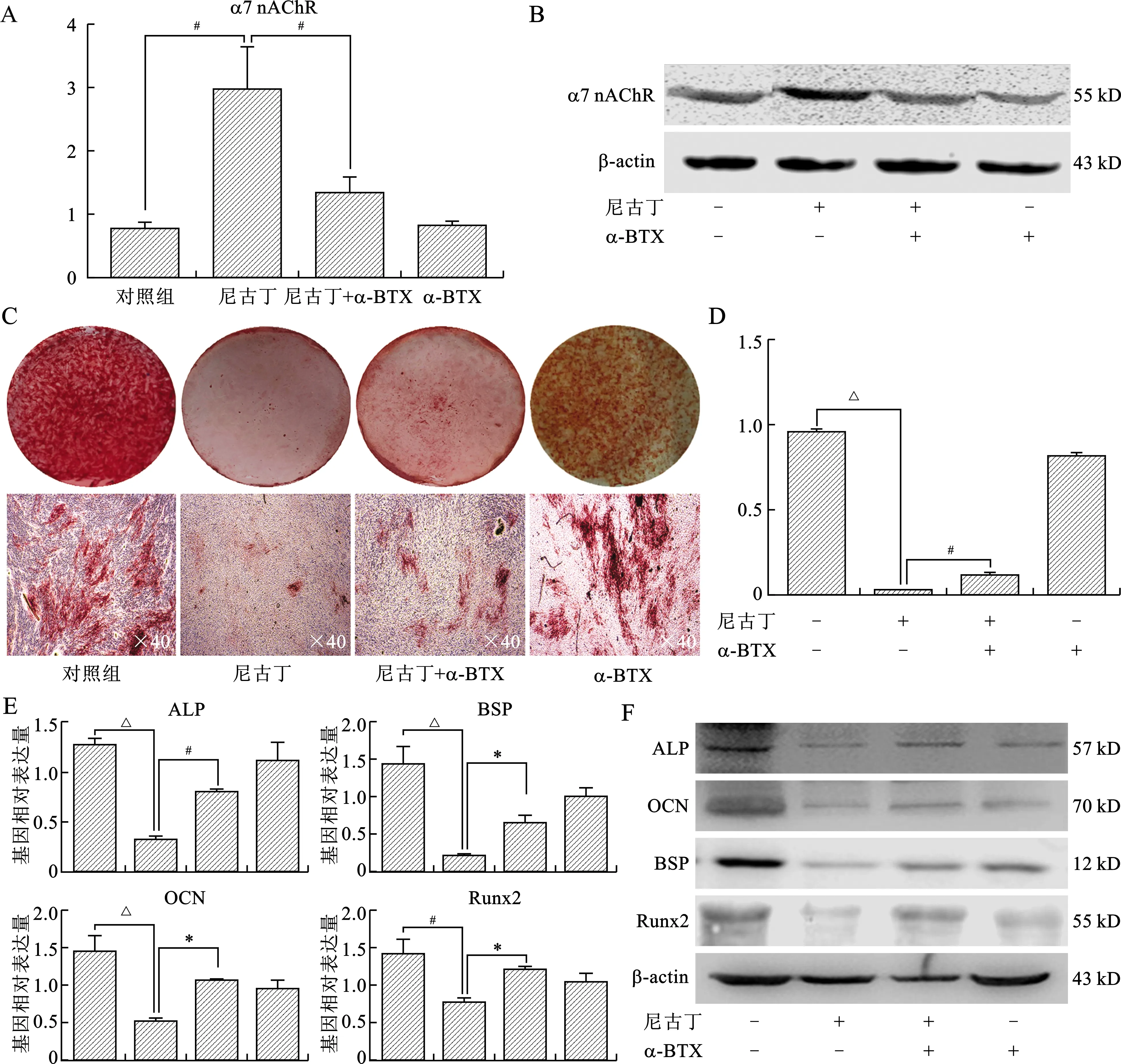
A:qRT-PCR检测PDLSCs α7 nAChR基因表达情况;B:Western blot检测α7 nAChR蛋白表达情况;C、D:茜素红染色检测PDLSCs在尼古丁和(或)α-BTX作用下形成矿化结节的能力;E:qRT-PCR检测成骨分化相关基因变化(横坐标由左向右依次为对照组、尼古丁、尼古丁+α-BTX、α-BTX);F:Western blot检测成骨分化相关蛋白变化。在A、D、E图中,组间比较*P<0.05,#P<0.01,△P<0.001
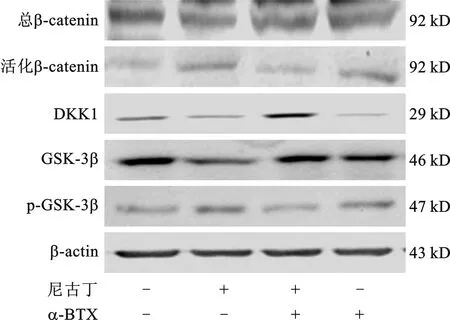
图4 Western blot检测Wnt通路相关蛋白表达情况
3 讨 论
吸烟可以影响牙周炎的发生与发展,表现为更加严重的牙槽骨吸收、牙周附着丧失和更深的牙周袋存留[12-13]。前期研究[5]已经证实烟草中的尼古丁能够损伤牙周成纤维细胞,导致牙周治疗预后不良。然而,现有研究多着眼于尼古丁的破坏作用,而对尼古丁抑制牙周组织再生关注较少。在本研究中,我们证实不同浓度尼古丁均可抑制PDLSCs成骨分化,其机制可能为尼古丁激活α7 nAChR后上调p-GSK-3β表达水平,调控Wnt信号通路。
PDLSCs具有一般间充质干细胞的特性。体内实验[2]已经证实PDLSCs能够分化形成成牙骨质样细胞及牙骨质/牙周膜样组织。类似结论在小型猪动物模型中也得到印证[14]。也有研究[15]表明,自小型猪获得的PDLSCs能够自体移植形成牙根-牙周膜复合结构,获得类似天然牙的组织学形态。PDLSCs由于具有牙周组织再生潜能,是用于牙齿再生领域的理想种子细胞[16]。本研究同前期研究结果均表明吸烟者牙周再生疗效较差的可能原因,即烟草中的主要毒性物质尼古丁破坏了PDLSCs的再生潜能。这一发现为将来的临床治疗提供了新的目标靶点。
α7 nAChR在机体免疫调节和炎性反应过程中扮演了重要角色[17]。在其特异性激动剂尼古丁作用下,可促进机体分泌乙酰胆碱,从而介导炎性反应[18]。此外,尼古丁还可与免疫细胞中的α7 nAChR直接结合,调控促炎因子如肿瘤坏死因子-α的表达,进而影响核因子-κB信号通路[19]。前期研究[5]提示α7 nAChR同样表达于人牙周膜细胞,尼古丁通过激活该受体能够上调促炎因子IL-1β的表达。还有研究[20]通过动物实验发现尼古丁能够导致实验性牙周炎大鼠牙槽骨丧失。在此基础上,研究[5]发现在大鼠牙周组织中存在α7 nAChR的表达,在尼古丁作用下该受体表达将上调。这些结果均提示,α7 nAChR在牙周炎发生与发展过程中可能发挥了破坏效应。本研究进一步证实,尼古丁同α7 nAChR结合后,PDLSCs成骨分化相关基因ALP、OCN、BSP和Runx2及其蛋白的表达均受到影响,提示PDLSCs中α7 nAChR在尼古丁对细胞成骨分化的负性调控过程中发挥了关键作用。
如前所述,α7 nAChR在炎性反应过程中发挥了重要作用[17]。在PDLSCs中,尼古丁正是通过该受体使得炎性因子表达上调,从而发挥相应破坏作用[5]。本研究结果还提示,在α7 nAChR同尼古丁结合后,受体下游Wnt通路发生激活,PDLSCs的成骨分化能力出现下调,而这一趋势可以被Wnt通路抑制剂DKK1部分逆转,表明α7 nAChR可能通过调节DKK1和下游GSK-3β的表达直接调控Wnt信号通路。然而,在后续研究中,我们仍需排除炎性因子在这一过程中可能发挥的间接作用。
综上所述,α7 nAChR介导了尼古丁对PDLSCs成骨分化的负性调控。尼古丁作用下Wnt通路的激活参与了这一过程。这一发现同前期已经证实的Wnt通路能够抑制PDLSCs成骨分化结论一致。在后续研究中,我们将更多关注α7 nAChR调控Wnt通路的机制。此外,非经典Wnt通路是否在这一调节过程中发挥作用也需加以证实。

