天竺葵素抑制肺癌进展的作用和机制研究
靳彩玲,姬颖华,王荦楠,杨军,张清琴,牛红蕊
(新乡医学院第一附属医院肿瘤科,河南新乡 453000)
肺癌是所有癌症中发病率和死亡率最高的恶性肿瘤,是严重的世界公共卫生问题[1]。目前,肺癌的具体发病机制尚不完全清楚,抑制肺癌细胞恶性生长是肺癌治疗的主要研究方向。天竺葵素(pelargonidin,PEL)是天然的花青素单体,具有抗肿瘤、抗氧化、抗炎等生理活性[2]。大量研究报道,不同来源的PEL 对肺癌、胃癌、肝癌等均有一定的抑制作用[3-5]。但PEL 在肺癌中的具体作用机制尚不完全清楚。本研究拟通过网络药理学分析PEL在肺癌中的潜在治疗靶点,并通过相关功能实验进行验证,旨在探讨PEL 治疗肺癌的分子机制,为其临床应用开发提供理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞与实验动物来源 人肺癌细胞NCIH1975、NCI-H292 购自上海中科院细胞库;16 只BALB/c裸鼠,SPF级,雄性,6周龄,体质量16~20 g,购自河南省实验动物中心,生产许可证号:SCⅩK(豫)2017-0001。
1.1.2 药品 PEL 购自美国Sigma,质量分数>98%,取3.07 mg PEL 溶于10 mL 无菌水中,配制为100 mmol/L 母液,再梯度稀释为10、20、25、40、50、80、100μmol/L的溶液。
1.1.3 试剂与仪器 干扰KIF11(shKIF11)慢病毒载体及杂序的短发卡RNA 阴性对照(shNC)、pcDNAKIF11 质粒及其阴性对照物(Vector)由北京阅微基因技术股份有限公司提供;脂质体2000 试剂盒(美国Invitrogen);细胞计数(CCK-8)试剂(美国GLPBIO);Transwell 小室、基质胶(美国BD);正常山羊血清、生物素化山羊抗兔、细胞裂解液(上海碧云天生物科技有限公司);兔抗细胞增殖抗原Ki67、KIF11 抗体(美国Abcam);iMARK 酶标仪(美国Bi-Rad);CⅩ21BIM-SET5显微镜(日本OLYMPUS)。
1.2 PEL潜在靶点的预测和筛选
在PubChem 中获取PEL 的SMILES 号,并导入SwissTarget 和TargetNet 数据库,获取PEL 的预测作用靶点;下载TCGA_LUSC 数据矩阵,利用生信人工具采用t-检验统计学方法进行差异基因分析,筛选出在肺癌患者中表达上调的基因;下载TCGA_LUSC 临床信息,将肺癌患者分为临床分期I期和Ⅱ~Ⅳ期两组以及T1期和T2~T4期两组,进行差异基因分析,筛选出在临床分期Ⅱ~Ⅳ期/T2~T4期组中表达上调的基因。对PEL 潜在靶点、表达上调基因以及在临床分期Ⅱ~Ⅳ期/T2~T4 期组中高表达的基因取交集。进一步分析共同基因表达水平与淋巴结转移(N 分期)之间的关系,筛选出目标基因KIF11。
1.3 实验分组
(1)添加不同浓度PEL处理细胞(NCI-H1975:10、25、50、100 μmol/L,NCI-H292:10、20、40、80 μmol/L),并设置空白对照(Control,不含药物的培养基),观察PEL 对NCI-H1975、NCI-H292 细胞活性及KIF11表达的影响;(2)选取细胞生存率约50%的PEL 浓度(NCI-H1975:50 μmol/L、NCI-H292:40 μmol/L)为实验浓度处理细胞,并设置空白对照(Control),观察PEL对NCI-H1975、NCI-H292 细胞恶性生物学行为的影响;(3)构建肺癌裸鼠荷瘤模型,分为Control组和PEL 组,观察PEL 对裸鼠肿瘤生长的影响;(4)参照脂质体2000 试剂盒操作,以shKIF11 慢病毒载体及shNC 转染细胞,分为shNC 组、shKIF11 1#组和shKIF11 2#组,观察KIF11低表达对NCI-H1975、NCI-H292 细胞恶性生物学行为的影响;(5)以pcDNA-KIF11 质粒及Vector 转染细胞,分为Vector 组和KIF11 组,检测KIF11 蛋白的表达;(6)将细胞分为Contorl 组、PEL 组 和PEL+KIF11 组,观 察PEL、KIF11 对NCI-H1975、NCI-H292 细胞恶性生物学行为的影响。
1.4 CCK-8检测细胞活性
取各组细胞以1×105密度接种于96 孔板,分别培养1、2、3、4、5 d,隔天更换新鲜培养基,添加含有10%(φ)CCK-8试剂的培养基,继续培养4 h,于450 nm处检测各孔吸光度(A)值,以吸光度值表示细胞活性。
1.5 划痕实验检测细胞迁移
取各组细胞以1×106密度接种于6孔板,待细胞贴壁后,用200 μL 微量枪头垂直于孔底划痕,拍照记录0 h 划痕宽度,培养24 h,再次拍照记录24 h 划痕宽度。
1.6 Transwell实验检测细胞侵袭
预先用基质胶包被小室上室,取各组细胞以2×105密度接种于小室上室,下室添加含有10%(φ)胎牛血清培养基作为趋化物,培养48 h,取出小室轻轻拭去基质胶和上室内细胞,固定于冰甲醛溶液,结晶紫染色,显微镜下观察并计数侵袭细胞。
1.7 肺癌裸鼠荷瘤模型的建立
正常培养NCI-H1975 细胞,制备为5×106/L 细胞悬液,取0.2 mL 接种于裸鼠右腋部背侧皮下,接种5~10 d 后观察到接种部位可触及肿瘤结节表明建模成功。将荷瘤模型裸鼠分为两组:Control组和PEL 组,每组8 只,PEL 组隔天腹腔注射3 mg/kg PEL[6],Control 组以等体积生理盐水替代,测量肿瘤长、短径,计算其体积,药物注射第14 天时处死裸鼠,剥取肿瘤组织,测量体积及质量后置于中性甲醛溶液中固定,制备石蜡切片。
1.8 免疫组化检测肿瘤组织中增殖抗原标记物Ki67的表达
取出肿瘤组织石蜡切片,经常规脱蜡水化后,滴加3%(φ)H2O2溶液灭活10 min,高温修复抗原15 min,分别添加正常山羊血清、Ki67 一抗(稀释比1∶100)、生物素化山羊抗兔(稀释比1∶500),终止反应后进行二氨基联苯胺(DAB)显色,苏木素复染,脱水、透明后封片,显微镜下观察阳性染色细胞(棕黄色颗粒),利用Image-ProPlus 软件测定阳性细胞平均吸光度值(A)。
1.9 蛋白印迹检测细胞中KIF11表达
添加细胞裂解液提取各组细胞中总蛋白,测定浓度后,进行聚丙烯酰胺凝胶电泳,待蛋白完全分离后停止电泳,冰上转膜,室温封闭2 h,加入一抗KIF11(稀释比1∶1 000),4 ℃下孵育过夜,再加入二抗(稀释比1∶5 000),37 ℃孵育1 h,最后化学发光显影。以β-肌动蛋白(β-actin)为内参,计算KIF11的相对表达量。
1.10 统计学方法
采用SPSS19.0 软件进行统计学分析,数据以均数±标准差表示,多组均数比较采用单因素方差分析,两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PEL潜在靶点的预测和筛选
如图1,韦恩分析结果显示,SwissTarget 数据库与TargetNet数据库预测PEL 的靶点,二者取并集得112 个靶点;下载TCGA_LUSC 数据矩阵和临床信息,对PEL 潜在靶点、表达上调基因以及在临床分期Ⅱ~Ⅳ期/T2~T4 期组中高表达的基因取交集,结果发现有KIF11和周期素依赖性激酶1(CDK1)2 个共同基因。进一步分析KIF11和CDK1基因表达水平与淋巴结转移之间的关系,结果表明N1 期组肺癌患者中KIF11表达水平更高(P<0.05)。因此,KIF11作为目标基因进一步研究。

图1 PEL潜在靶点的预测和筛选Figure 1 Prediction and screening of PEL's potential targets
2.2 PEL对肺癌细胞恶性生物学行为的影响
如图2,与Control组比较,10、25、50、100 μmol/L PEL 处理后NCI-H1975 细胞活性明显降低,10、20、40、80 μmol/L PEL 处理后NCI-H292 细胞活性明显降低(P<0.05),50 μmol/L/40 μmol/L PEL 处理NCIH1975/NCI-H292 细胞后,细胞的存活率均在50%左右,因此选取50 μmol/L 和40 μmol/L PEL 干预NCI-H1975、NCI-H292 细胞做后续功能实验。与Control 组比较,PEL 组细胞活性、迁移能力及侵袭数明显降低(P<0.05)。

图2 PEL对肺癌细胞恶性生物学行为的影响Figure 2 Effects of PEL on malignant biological behaviors of lung cancer cells
2.3 PEL对肺癌裸鼠荷瘤模型肿瘤生长的影响
如图3,与Control组比较,PEL组裸鼠肿瘤组织体积、质量及Ki67阳性表达明显降低(P<0.05)。
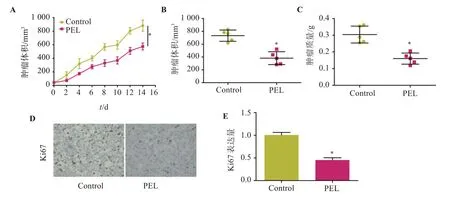
图3 PEL对肺癌裸鼠荷瘤模型肿瘤生长的影响Figure 3 Effects of PEL on the growth of lung cancer in tumor-bearing nude mice models
2.4 PEL对肺癌细胞中KIF11表达的影响
如图4,与Control 组比较,10、25、50、100 μmol/L PEL 处理后NCI-H1975 细胞中KIF11表达明显降低,10、20、40、80 μmol/L PEL处理后NCI-H292细胞中KIF11表达明显降低(P<0.05),呈剂量依赖性。50 μmol/L和40 μmol/L PEL分别处理NCI-H1975和NCI-H292 细胞12、24、48 h,NCI-H1975、NCI-H292细胞中KIF11表达明显降低(P<0.05),呈时间依赖性。

图4 PEL对肺癌细胞中KIF11表达的影响Figure 4 Effects of PEL on the expression of KIF11 in lung cancer cells
2.5 低表达KIF11 对肺癌细胞恶性生物学行为的影响
如图5,与shNC组比较,shKIF11 1#组和shKIF11 2#组KIF11表达、细胞活性、迁移能力及侵袭数明显降低(P<0.05)。

图5 低表达KIF11对肺癌细胞恶性生物学行为的影响Figure 5 Effects of low-expression KIF11 on malignant biological behaviors of lung cancer cells
2.6 PEL 靶向KIF11 对肺癌细胞恶性生物学行为的影响
如图6,与Vector 组比较,KIF11 组KIF11表达明显升高(P<0.05);与PEL 组比较,PEL+KIF11 组KIF11表达、细胞活性、迁移能力及侵袭数明显升高(P<0.05)。
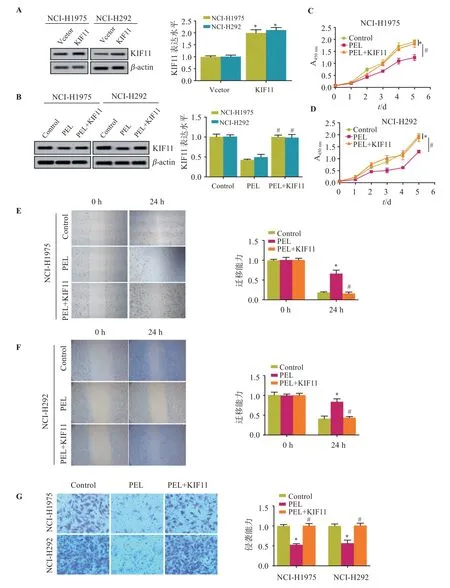
图6 PEL靶向KIF11对肺癌细胞恶性生物学行为的影响Figure 6 Effects of PEL on the malignant biological behaviors of lung cancer cells by targeting KIF11
3 讨论
近年来,植物天然产物在阻止、逆转或延缓癌症进展方面有重要作用,已成为肿瘤学领域的研究热点[7]。研究表明,食用富含类黄酮的食物可能降低癌症风险[8]。黄酮类化合物是植物中常见的一类次生代谢产物,可存在于植物叶子、花、种子、茎等多个部位,具有丰富的生物活性,如抗癌、抗氧化、抗病毒等[9-10]。PEL 是一种类黄酮前体化合物合成的花青素,也表现出一定的抗癌活性[11]。Chen 等[12]研究发现,PEL 对骨肉瘤细胞U2OS 有明显的抑制作用,可能与阻滞PI3K/AKT 信号通路有关。本研究通过检测细胞恶性生物学行为能力,发现PEL 可抑制肺癌细胞NCI-H1975、NCI-H292 的增殖、迁移及侵袭能力,同时构建肺癌裸鼠荷瘤模型,通过肿瘤生长曲线、体积、质量及肿瘤组织中增殖抗原标记物Ki67的表达,结果显示PEL在体内也表现出明显的抗肿瘤活性。但PEL 抗肺癌的具体分子机制尚不清楚。
本研究应用网络药理学分析PEL 的潜在靶点,初步筛选出112 个靶点,进一步下载TCGA_LUSC数据矩阵和临床信息,最终确定KIF11为靶基因进行后续验证实验。驱动蛋白超家族(KIFs)是调控细胞内转运的一类蛋白,不仅可控制细胞形态,还在高级生物功能中有重要作用[13]。近期报道结果显示,KIFs 还参与人类癌症的发生发展[14]。KIF11作为成员之一,主要参与纺锤体的形成及其动力学的维持,在多种癌症中存在异常表达[15]。Zhou 等[16]利用生物信息学软件筛查乳腺癌中差异表达基因,发现KIF11可能是乳腺癌发生发展的潜在致癌基因,与其不良预后密切相关。Yang 等[17]研究发现,KIF11、KIF4A、FOXM1等基因在卵巢癌中异常表达,与疾病进展有关,可用于治疗卵巢癌潜在靶向药物的开发。李蓉等[18]研究显示,非小细胞肺癌中KIF11高表达,对于患者临床诊治和预后预测有较好前景。本研究结果显示,KIF11在肺癌组织中异常高表达,且与患者临床分期、T 分期及N 分期等临床病理特征有关,提示KIF11高表达可能参与肺癌的发生发展。敲低KIF11表达后,肺癌细胞增殖、迁移与侵袭能力明显降低,证实KIF11在肺癌中发挥促癌因子作用。Hu[19]、Li[20]等基础研究结果也显示,KIF11可促进肝癌、肺腺癌细胞增殖、迁移与侵袭。另外,PEL 处理细胞后,KIF11表达明显降低,增强细胞中KIF11表达后,可逆转PEL 对肺癌细胞的抑制作用,表明PEL 抑制肺癌细胞增殖、迁移与侵袭,是通过靶向抑制KIF11表达实现的。
综上所述,PEL可抑制肺癌细胞增殖、迁移及侵袭能力,其作用机制可能与靶向抑制KIF11表达有关。但PEL 在肺癌中是否还存在其他作用途径,仍需要深入分析和研究。

