黄芪多糖对脂肪组织巨噬细胞活化的影响及作用机制
朱云峰,覃艳,曹萌,翟倩倩,李燕,王涛
近年来,由于人们饮食结构的改变,2 型糖尿病和肥胖病人逐年增加,严重威胁人民生命健康。胰岛素抵抗(insulin resistance,IR)是2 型糖尿病的重要原因。脂肪组织是发生IR 的场所之一,多种脂源性细胞因子如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、瘦素、抵抗素等参与或调节IR。巨噬细胞(adipose tissue macrophages,ATMs)数量增多,会导致促炎表达型巨噬细胞增多。ATMs 游走到脂肪组织后,致使刺激物增加经典活化巨噬细胞(classically activated macrophage,M1)的招募作用,加重脂肪细胞的功能障碍,诱发IR。目前,ATMs已经成为治疗IR的新靶点。
黄芪多糖(astragalus polysaccharide,APS)是传统中药黄芪的主要成分之一,具有增强免疫、抗肿瘤、抗氧化等功效。研究发现,APS 具有胰岛素增敏作用,且无明显的毒副作用,APS 干预能提高肥胖大鼠的葡萄糖输注率。目前,APS 对脂肪组织巨噬细胞活化的影响还未知。本研究于2018年11月至2019年5月主要探讨了APS 对TNF-α 诱导的巨噬细胞活化的影响及可能的作用机制,以期为APS用于改善IR提供一定的实验依据。
1 材料与方法
1.1 细胞、主要试剂和仪器
脂肪细胞株3T3-L1及ANA-1 巨噬细胞购自中国科学院上海生命科学研究院细胞资源中心;APS:含量90%,美国泛华公司,1000 毫克/支;胎牛血清:美国HyClone 公司;小鼠IL-6 酶联免疫吸附测定(ELISA)试剂盒、小鼠TNFα ELISA 试剂盒:上海沪峰生物科技有限公司;PCR试剂盒:日本Takara 公司、大连宝生物有限公司;互补DNA(cDNA)第一链合成试剂盒:美国Fermentas公司;引物由Primer 5.0 软件设计,上海生工科技有限公司合成。1.2 实验方法
1.2.1
前体脂肪细胞的培养和诱导为成熟脂肪细胞 将3T3-L1 前体脂肪细胞接种于细胞培养板内,用含10% 胎牛血清的高糖DMEM 培养基在37 ℃、5%二氧化碳、97%湿度的培养箱中培养。待细胞融合至80%~90%,加含终浓度0.5 mmol/L 1-甲基-3-异丁基黄嘌呤(IBMX)、1 μmol/L 地塞米松和终浓度为10 mg/L 的胰岛素的10% 胎牛血清高糖DMEM 培养48 h。48 h 后换含终浓度为10 mg/L 的胰岛素的10% 小牛血清高糖DMEM 再培养48 h。48 h后再换含10% 胎牛血清的高糖DMEM 继续培养。以后每2天更换一次含10% 胎牛血清的高糖DMEM 培养液。诱导分化8~12 d,90% 的3T3-L1 细胞呈成熟脂肪细胞,用油红O鉴定后用于实验。1.2.2
巨噬细胞培养 ANA-1 巨噬细胞复苏后,用含10% 胎牛血清的DMEM 培养基置于37 ℃、5% 二氧化碳、97% 湿度的培养箱中培养。根据细胞生长状况,每2~3 天更换一次新鲜的培养基。待细胞融合至80% 左右时,进行传代培养或取对数生长期的细胞用于后续实验。1.2.3
共培养体系的建立 通过Transwell 共培养方式,将巨噬细胞种于上室,脂肪细胞种于下室。小室底部滤膜孔径0.4 μm,细胞不能自由通过,但两层间的培养液及细胞因子可以自由通过。实验分为三组,空白对照组(NC):常规培养基正常培养,不进行干预;TNF-α 诱导干预组(TNF-α 组):含10 μg/L TNF-α 的培养基干预24 h;APS 干预组(APS+TNF-α 组):含10 μg/L TNF-α 与0.10 g/L APS 的培养基共同干预24 h。每组设置3个复孔。培养结束后,收集细胞培养上清液和细胞用于后续实验。1.2.4
双抗体夹心ELISA 测定IL-6、MCP-1 水平细胞培养上清液3500 r/min 离心10 min,取上清,分别参照IL-6、单核细胞趋化蛋白-1(MCP-1)试剂盒操作说明书检测其水平。1.2.5
实时荧光定量逆转录聚合酶链反应(qRTPCR)检测诱生型一氧化氮合酶(iNOS)和TNF-α 的mRNA水平Trizol试剂提取细胞总RNA,微量核酸仪检测RNA 的纯度和浓度。参照逆转录试剂盒操作说明书将RNA 逆转录为cDNA。然后以cDNA 为模板,进行PCR 扩增。 引物序列:iNOS 正向5'-GTTCACCCAGTTGTGCATCG-3',反向5'-ACTTGCGATGCTCCATGGTC-3'; TNF- α 正向5'-TCTCAAAACTCG AGTGACAAG-3',反向5'-AGTTGGTTGTCTTTGAGATCC-3';β 肌动蛋白(β-actin)正向5'-CCTTCCTTCTTGGGTATGG -3',反向5'-TGTTGGCATAGAGGTCTTTAC-3'。扩增程序:95 ℃预变性2 min,94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1 min,共进行35个循环。以β-actin为内参,采用2法计算iNOS和TNF-α的mRNA相对表达水平。1.2.6
蛋白质印迹法(Western blotting)法检测蛋白表达 RIPA蛋白裂解液提取细胞中总蛋白,BCA法测定蛋白浓度。取适量蛋白,100 ℃煮沸5 min。蛋白变性后,以每孔30 μg 蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳后,湿转至聚偏二氟乙烯(PVDF)膜。5% 脱脂牛奶中封闭1 h 后,分别加入一抗,4 ℃孵育过夜。等渗缓冲盐溶液(TBST)洗膜后,加入辣根过氧化物酶标记的二抗(稀释度1∶200),室温孵育1 h。TBST 缓冲液洗膜后,加入ELC 显影液,避光显影,凝胶成像系统曝光拍照。1.2.7
巨噬细胞趋化实验 采用Transwell 共培养方式,小室滤膜孔径8 μm 。将巨噬细胞种于上室,将脂肪细胞种于下室。实验分组与“1.2.3”相同。培养结束后,取出小室,吸弃培养基,磷酸缓冲盐溶液(PBS)清洗2 次。用棉签擦去小室表面为迁移的细胞,加入4% 多聚甲醛固定30 min。PBS 清洗细胞2 次,加入0.4% 结晶紫染色15 min。PBS 清洗后,显微镜观察巨噬细胞染色情况,并拍照,对迁移细胞进行计数。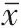
2 结果
2.1 细胞培养结果观察
前体脂肪细胞诱导为成熟脂肪细胞过程细胞形态如图1;成熟脂肪细胞油红O 染色结果如图2,可见细胞体内脂滴明显,围绕细胞核一周;巨噬细胞形态如图3。
图1 3T3-L1前体脂肪细胞诱导为成熟脂肪细胞过程细胞形态(×100):1A为诱导前;1B为诱导第4天;1C为诱导第8天;1D为诱导第12天 图2 3T3-L1成熟脂肪细胞油红O染色图:2A为×100;2B为×400 图3 ANA-1巨噬细胞培养情况(×100)
2.2 APS 抑制脂肪细胞因子IL-6、TNF
-α、MCP-1的表达
重复测量方差分析结果显示,与12 h 比较,培养24 h、48 h 时TNF-α 组和APS+TNF-α 组的细胞培养上清液中IL-6、MCP-1、TNF-α mRNA 水平均明显升高。与24 h 比较,48 h 时NC 组、TNF-α 组和APS+TNF-α组的细胞培养上清液中IL-6、MCP-1、TNF-α mRNA 水平均明显降低。细胞培养相同时间,与NC 组比较,TNF-α 组细胞培养上清液中IL-6、MCP-1、TNF-α mRNA 水平均明显升高;与TNF-α 组比较,APS+TNF-α 组细胞培养上清液中IL-6、MCP-1、TNF-α mRNA水平均明显降低。见表1。
表1 各组不同时间点上清液中白细胞介素-6(IL-6)、单核细胞趋化蛋白-1(MCP-1)和肿瘤坏死因子-α(TNF-α)mRNA表达水平比较/±s
2.3 APS 抑制巨噬细胞中iNOS 的表达
与NC 组比较,TNF-α 组iNOS mRNA 和蛋白水平显著升高(P
<0.05);与TNF- α 组比较,APS+TNF- α 组iNOS mRNA 和蛋白水平显著降低(P
<0.05)。 见图2、表2。
表2 黄芪多糖(APS)对巨噬细胞诱生型一氧化氮合酶(iNOS)表达的影响/±s

图2 黄芪多糖(APS)对巨噬细胞诱生型一氧化氮合酶(iNOS)表达的影响:A为巨噬细胞iNOS mRNA表达;B为巨噬细胞iNOS蛋白表达
2.4 APS 对脂肪细胞趋化巨噬细胞的影响
NC组、TNF-α 组与APS+TNF-α 组趋化巨噬细胞数整体比较F
=145.043,P
<0.001。与NC 组(27.68 ± 4.25)个比较,TNF-α 组(88.34 ± 8.26)个显著升高(P
<0.05);与TNF- α 组比 较,APS+TNF- α 组(42.50 ±6.15)个显著降低(P
<0.05)。2.5 APS 激活巨噬细胞中AMPKα1/SIRT1 信号通路
与NC 组比较,TNF-α 组磷酸化AMP 活化蛋白激酶α1(p-AMPKα1)和沉默信息调节蛋白1(SIRT1)蛋白水平显著降低(P
<0.05);与TNF-α组比较,APS+TNF-α 组p-AMPKα1 和SIRT1 蛋白水平显著升高(P
<0.05)。见图3、表3。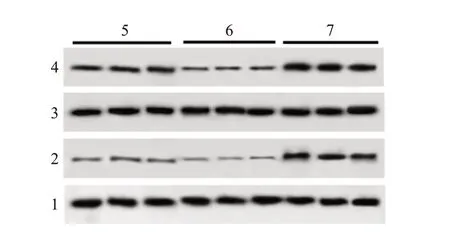
图3 巨噬细胞AMPKα1/SIRT1信号通路蛋白的表达
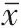
表3 黄芪多糖(APS)对巨噬细胞中AMPKα1/SIRT1信号通路的影响/±s
3 讨论
人脂肪体积增大可引起脂肪组织容积的增加,释放IL-1β、IL-6、TNF-α、MCP-1等细胞因子,进而诱导巨噬细胞向脂肪组织游走,并活化巨噬细胞。活化的巨噬细胞释放更高水平的TNF-α、IL-6、IL-12等炎性细胞因子,这些炎性因子又以旁分泌或自分泌的方式使巨噬细胞与脂肪细胞相互作用,相互影响,调控炎症反应。TNF-α 是一种具有多种生物功能的细胞因子,多种组织和细胞均可分泌TNF-α。脂肪组织是内源性TNF-α 的主要来源,主要由脂肪组织中的巨噬细胞分泌。MCP-1主要来源于巨噬细胞、单核细胞、内皮细胞等,巨噬细胞在MCP-1 的趋化作用下产生炎症反应。本研究结果显示,在TNF-α 诱导作用下,细胞培养上清液中IL-6、TNF-α、MCP-1 表达水平明显升高,提示在TNF-α诱导作用下,巨噬细胞或者,产生了较多炎性因子。而APS干预后,IL-6、TNF-α、MCP-1表达水平明显降低,提示APS 可降低巨噬细胞的活化,抑制巨噬细胞产生炎性因子。巨噬细胞游走到脂肪组织后,会加重脂肪细胞的功能障碍,产生IR。脂肪和脂肪间质分泌的MCP-1 增多对巨噬细胞具有趋化作用。本研究显示,在TNF-α 诱导的诱导作用下,巨噬细胞趋化数明显增加,而APS 的干预可降低巨噬细胞的趋化作用,提示APS可减轻IR。
在炎性细胞因子如内毒素、TNF-α 等刺激作用下,机体组织可表达iNOS,iNOS 通过催化合成大量一氧化氮。一氧化氮通过刺激巨噬细胞产生炎症反应,促进周边细胞产生炎症或细胞毒性,加重自身免疫组织的损伤。iNOS 是公认的巨噬细胞活化的标志物。本研究结果显示,TNF-α 诱导巨噬细胞后,iNOS mRNA 和蛋白表达水平升高,说明TNFα诱导导致巨噬细胞活化。APS作用后,TNF-α诱导的巨噬细胞iNOS mRNA 和蛋白表达降低,进一步说明APS可抑制TNF-α诱导的巨噬细胞活化。
AMP 活化蛋白激酶(AMPK)是一种保守的丝氨酸/苏氨酸激酶,由催化亚基α、调节亚基β 和γ 组成。AMP 活化蛋白激酶α(AMPKα)可通过对靶蛋白的磷酸化调节,参与脂代谢。AMPK 活性的降低可导致血浆游离脂肪酸升高及脂质在体内的异位沉积,进而导致脂质代谢紊乱性疾病的发生。SIRT1是一种NAD+依赖的组蛋白去乙酰化酶,可增加AMPKα 的活性。AMPKα/SIRT1 信号通路在脂肪组织脂代谢中发挥重要调控作用,激活AMPKα/SIRT1 信号通路可降低巨噬细胞炎性因子的分泌。本研究结果显示,TNF-α诱导后,巨噬细胞p-AMPKα1 和SIRT1 蛋白表达水平降低,说明细胞中AMPKα/SIRT1 信号通路受到抑制。APS 干预后,TNF-α 诱导的巨噬细胞p-AMPKα1 和SIRT1 蛋白表达水平升高,表明APS 可激活细胞中AMPKα/SIRT1信号通路。
综上所述,APS 可降低脂肪组织巨噬细胞的炎症反应及趋化作用,抑制巨噬细胞活化,其作用机制与激活细胞中AMPKα/SIRT1信号通路有关。
(本文图1~3见插图12-1)

