微小RNA-218-5p靶向Jagged 1调控人牙周膜干细胞的活性和骨向分化
马文贤,黄琼,董振耀
微小RNA(miRNA)为长度在19~23个核苷酸之间的短链非编码微小RNA,其在多种疾病中均具有调控功能,其中包括牙周炎。微小RNA-218-5p(miR-218-5p)在牙周炎中的作用虽然已得到部分学者的肯定,但其调控机制与Notch 信号通路的关系尚未清楚。Notch 信号通路在维持细胞生长、分化方面具有关键作用,其在疾病的进程中具有重要作用。Notch 信号通路通过Notch 蛋白与相邻细胞上的配体Jagged 1(JAG1)蛋白结合而被激活,Notch蛋白的裂解在细胞内发生,导致Notch 细胞内结构域易位到细胞核中并进一步调节Notch 靶基因表达。Notch 信号通路参与成骨分化过程和破骨细胞生成的诱导过程。但是miR-218-5p 与JAG1 在人牙周膜干细胞(hPDLSCs)中的作用关系尚不清楚。2018年12月至2019年9月,本研究拟以人牙周膜干细胞hPDLSCs 为研究对象,观察抑制miR-218-5p、过表达JAG1 对hPDLSCs 细胞活性、分化的影响,揭示其机制,为牙周膜干细胞治疗牙周炎,促进牙周骨组织再生提供理论依据。
1 材料与方法
1.1 材料
hPDLSCs 购自ATCC;兔抗人JAG1、Ⅰ型胶原蛋白(Col-1)、骨钙素、Runt 相关转录因子2(Runx2)多克隆抗体、辣根过氧化物酶标记的羊抗兔免疫球蛋白G(IgG)抗体均购自Santa Cruz;pcDNA 3.1 载体购自康为世纪;α-MEM 培养基购自Hyclone 公司;胎牛血清均购自Gibco 公司;噻唑蓝(MTT)试剂盒购自美国GIBCO 公司;转染试剂Lipofectamine2000 购自北京索莱宝科技有限公司;BCA 蛋白定量试剂盒购自上海源叶生物公司;逆转录试剂盒购自大连Takara 公司;聚偏二氟乙烯(PVDF)膜购自德国罗氏诊断有限公司;ECL发光液购自北京普利莱基因技术有限公司;RIPA裂解液购自碧云天生物技术公司;双荧光素酶报告基因检测试剂盒购自美国Promega 公司。实验中所有引物的合成及序列均由上海吉玛公司合成。1.2 方法
1.2.1
细胞培养 用含10 %胎牛血清的α-MEM 培养基培养人牙周膜干细胞hPDLSCs,置于37 ℃,5%二氧化碳的培养箱中常规培养。1.2.2
细胞转染 将未做任何处理的hPDLSCs 细胞标记为对照组;anti-miR-218-5p、anti-miR-NC、pcDNA、pcDNA-JAG1、anti-miR-218-5p+si-NC、antimiR-218-5p+si-JAG1 按照脂质体Lipofectamine2000 说明书操作步骤要求转染至正常培养的hPDLSCs 细胞,分别标记为anti-miR-218-5p 组、antimiR-NC 组、pcDNA 组、pcDNA-JAG1 组、anti-miR-218-5p+si-NC 组、anti-miR-218-5p+si-JAG1 组,转染48 h后,用实时荧光定量逆转录聚合酶链反应(qRTPCR)检测转染效率。转染成功后,用于后续试验。1.2.3
qRT-PCR 检测细胞中miR-218-5p、Col-1、骨钙素、Runx-2 的表达 为了观察miR-218-5p、JAG1 对hPDLSCs 细胞中Col-1、骨钙素、Runx-2 的mRNA 表达的调控,本探究通过抑制miR-218-5p、过表达JAG1、敲减JAG1 检测其中Col-1、骨钙素、Runx-2 的mRNA 表达情况。将对照组、anti-miR-218-5p 组、anti-miR-NC 组、pcDNA 组、pcDNA-JAG1组、anti-miR-218-5p+si-NC 组、anti-miR-218-5p+si-JAG1 组细胞,遵照RNA 抽提试剂盒说明书要求操作提取RNA,进行定量,然后按逆转录试剂盒按照说明书操作合成互补DNA(cDNA),相关序列信息见表1。最后按qRT-PCR 试剂盒说明书操作进行miR-218-5p、Col-1、骨钙素、Runx-2 检测。用2计算miR-218-5p、Col-1、骨钙素、Runx-2的表达。
表1 相关序列信息
1.2.4
MTT 法检测细胞活性 调整对照组、antimiR-218-5p 组、anti-miR-NC 组、pcDNA 组、pcDNAJAG1 组、anti-miR-218-5p+si-NC 组、anti-miR-218-5p+si-JAG1 组细胞密度至10/mL,取200 μL,加入20 μL 5 g/L的MTT溶液,培养4 h,然后弃去上清,每孔加入150 μL二甲基亚砜(DMSO),震荡,使结晶溶解,在490 nm波长下检测细胞吸光度。1.2.5
茜素红染色实验 将对照组、anti-miR-218-5p 组、anti-miR-NC 组hPDLSCs 细胞调整至10/mL,然后接种在6 孔板中进行常规培养,弃去未贴壁的细胞和培养液,用10 nmol/L 地塞米松、10 mmol/L β甘油酸钠及50 mg/L 维生素C 的α-MEM 成骨诱导液或者10 μg/L转化生长因子β1(TGF-β1)的α-MEM成骨诱导液处理hPDLSCs。每2~3天换液,分别培养14 d、21 d、28 d,在倒置显微镜下观察矿化结节的形成。1.2.6
蛋白质印迹法(Westrn blotting)实验检测细胞中JAG1、Col-1、骨钙素、Runx-2 的蛋白表达 收集对照组、anti-miR-218-5p 组、anti-miR-NC 组、pcDNA 组、pcDNA-JAG1 组、anti-miR-218-5p+si-NC 组、anti-miR-218-5p+si-JAG1 组细胞,调整细胞密度至10/mL,加入裂解液,冰上裂解30 min。12000 r/min离心10 min。取上清置于离心管,加入5×SDS 上样缓冲液,沸水煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF 膜;5 %脱脂奶粉将膜封闭2 h,洗膜,加入Ⅰ抗(1∶500 倍稀释的兔抗人JAG1、Col-1、骨钙素、Runx-2 多克隆抗体),4 ℃过夜孵育,洗膜,加Ⅱ抗(1∶1000倍稀释的辣根过氧化物酶标记的羊抗兔IgG),4 ℃,2 h。加发光液,曝光。1.2.7
双荧光素酶报告基因检测实验 将目的基因JAG1-WT 和JAG1-MUT 进行XhoⅠ和NotⅠ酶切,并回收目的片段,克隆至PUC-T 载体。再将目的序列与psiCHECK-2 载体链接,点击法插入DH5α 感受态细胞,再用500 μL LB 液体培养基进行摇菌和优势菌落挑选,扩大优势菌落培养,最后提取质粒DNA。用脂质体法将psiCHECK2-JAG1-3′非翻译区(UTR)WT、psiCHECK2-JAG1-3′UTR MUT 转染至对照组、miR-218-5p 组、miR-NC 组细胞。最后按双荧光素酶报告基因检测试剂盒技术手册要求操作。psiCHECK2 载体以萤火虫荧光素酶活性为内参,psiCHECK2-JAG1-3′UTR WT 和psiCHECK2-JAG1-3′UTR MUT 的表达为对照,检测荧光强度。海肾荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值反映miR-218-5p与JAG1的结合力。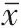
2 结果
2.1 抑制miR-218-5p 表达对hPDLSCs 活性的影响
与anti-miR-NC 组相比,anti-miR-218-5p 组hPDLSCs 细胞中miR-218-5p 表达显著降低(P
<0.001),48、72 h时,细胞活性显著升高(均P
<0.001)。见表2。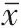
表2 抑制miR-218-5p表达对人牙周膜干细胞(hPDLSCs)活细胞数的影响/±s
2.2 抑制miR-218-5p 表达对hPDLSCs 骨向分化的影响
与anti-miR-NC 组相比,anti-miR-218-5p 组hPDLSCs 细胞的矿化结节明显升高,Col-1、骨钙素、Runx-2 的mRNA 和蛋白的相对表达量均显著升高(均P
<0.001)。见图1、图2、表3。
图1 抑制miR-218-5p表达观察人牙周膜干细胞(hPDLSCs)骨向分化时矿化结节的形成(茜素红染色×100)

图2 蛋白质印迹法检测抑制miR-218-5p表达后人牙周膜干细胞(hPDLSCs)骨向分化时Col-1、骨钙素、Runx-2蛋白电泳图
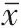
表3 抑制miR-218-5p表达对人牙周膜干细胞(hPDLSCs)骨向分化的影响/±s
2.3 JAG1 过表达对hPDLSCs 活性和骨向分化的影响
与pcDNA 组相比,pcDNA-JAG1 组hPDLSCs细胞中JAG1 蛋白表达显著升高(P
<0.001),48、72 h时,细胞活性显著升高(均P
<0.001),Col-1、骨钙素、Runx-2 的mRNA 的相对表达量和蛋白表达量均显著升高(均P
<0.001)。见表4。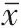
表4 JAG1过表达对人牙周膜干细胞(hPDLSCs)活性和骨向分化的影响/±s
2.4 miR-218-5p 靶向调控JAG1 的表达
运用miRcode 数据库预测到miR-218-5p 与JAG13′UTR存在结合位点(图3);双荧光素酶活性检测结果显示,与miR-NC 组相比,miR-218-5p 组WT-JAG1 细胞中荧光活性显著降低(P
<0.001),MUT-JAG1 细胞中荧光活性不受影响(P
=0.308),见表5。对照组、miR-NC 组、miR-218-5p 组、anti-miR-NC 组及antimiR-218-5p 组细胞中JAG1 蛋白相对表达量分别为(0.45±0.04)、(0.52±0.05)、(0.21±0.03)、(0.49±0.04)及(0.84±0.08)(F
=175.396,P
<0.001);与miR-NC 组相比,miR-218-5p 组JAG1 蛋白相对表达显著降低(P
<0.001),与anti-miR-NC 组相比,anti-miR-218-5p组JAG1蛋白相对表达显著升高(P
<0.001)。
图3 Jagged-1(JAG1)的3’非翻译区(UTR)中含有与miR-218-5p互补的核苷酸序列
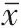
表5 双荧光素酶报告实验/±s
2.5 抑制JAG1 表达逆转了抑制miR-218-5p 表达对hPDLSCs 活性骨向分化的作用
结果如图4 和表6所示,与anti-miR-NC组相比,anti-miR-218-5p组hPDLSCs 细胞中JAG1 蛋白表达显著升高(P
<0.001),48、72 h 时,活细胞数显著升高(均P
<0.001),Col-1、骨钙素、Runx-2 的mRNA 和蛋白的相对表达量均显著升高(均P
<0.001);与anti-miR-218-5p +si-NC 组 相比,anti-miR-218-5p +si-JAG1 组hPDLSCs 细胞中JAG1 蛋白表达显著降低(P
<0.001),48、72 h 时,细胞增殖显著降低(均P
<0.001),Col-1、骨钙素、Runx-2 的mRNA 和蛋白的相对表达量均显著降低(均P
<0.001)。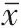
表6 抑制JAG1表达逆转了抑制miR-218-5p表达对人牙周膜干细胞(hPDLSCs)增殖骨向分化的作用/±s

图4 蛋白质印迹法检测人牙周膜干细胞(hPDLSCs)JAG1、Col-1、OCN、Runx-2蛋白电泳图
3 讨论
miRNA 在人类各种疾病的发生发展中均具有调节作用,其中包括牙周组织流失。Hao 等使用微阵列分析成骨分化期间的miRNA 表达谱发现,miR-218-5p 是其中差异表达的miRNA 之一。李建嘉等通过诱导hPDLSCs 发生成骨分化,检测其中miR-218-5p 及成骨相关基因的表达发现,诱导分化后miR-218-5p 表达下调,miR-218-5p 在hPDLSCs 成骨分化过程中可能起负调控作用。最近Guo等在研究中发现,miR-218 的过度表达可以抑制Ⅰ型和Ⅳ型胶原蛋白和牙本质唾液蛋白(DSP)的降解,抑制破骨细胞的形成,并抑制促炎细胞因子的分泌,其机制与靶向基质金属蛋白酶9(MMP9)相关。Zhong 等研究发现,LncRNA CCAT1 通过负调控miR-218 促进牙周膜细胞细胞增殖和分化。本研究运用MTT、qRT-PCR 法检测了抑制miR-218-5p 的hPDLSCs 细胞的活性和成骨相关基因Col-1、骨钙素、Runx-2 的表达发现,细胞活性显著增强,成骨相关基因Col-1、骨钙素、Runx-2的表达水平明显上调,说明抑制miR-218-5p 具有促进hPDLSCs 细胞成骨分化的功能,提示miR-218-5p 具有促进人牙周膜干细胞分化的潜力。而Guo等在牙周炎的研究中支持过表达miR-218能够通过减轻牙周炎病人的骨吸收和炎症达到保护作用,这说明miR-218-5p 在牙周膜干细胞中的功能与在牙周炎病人中的功能存在差异,但本课题组并没有在实验动物体内进行验证,这也为临床试验提供参考。深入研究,通过生物信息学、双荧光素酶报告基因检测实验验证miR-218-5p 与JAG1 存在靶向负调控的关系,这为miR-218-5p在成骨分化中的作用机制研究奠定基础。
JAG1 和Notch1 是Notch 信号通路的关键基因,该通路是细胞间发生作用的重要机制,近几年其在成骨分化中的功能成为研究的热点。袁萍等报道,在牙周炎病人牙周膜干细胞中Notch 信号通路受到抑制,而在轻微牙周炎症病人中,激活Notch信号通路有助于病人缺损牙槽骨的成骨分化。张文等研究发现,在hPDLSCs 细胞不发生增殖的情况下,成骨相关基因及Notch 信号通路的配体表达发生上调。最近,马玉等研究显示,在PDLSCs 发生增殖时,成骨标志基因的表达量发生下调,Notch信号通路相关分子JAG1 发生下调,提示Notch 信号通路可调控PDLSCs 的骨向分化能力。本研究发现,过表达JAG1 可增强细胞的活性,促进成骨相关基因Col-1、骨钙素、Runx-2 的表达,可见,过表达JAG1具有促进hPDLSCs细胞发生骨向分化的功能,这与前人的激活Notch 信号通路可治疗牙周炎牙槽缺损的实验结果相一致,这是首次在体外验证Notch 信号通路关键基因JAG1 具有促进hPDLSCs细胞骨向分化的功能。深入研究发现,抑制JAG1表达可逆转抑制miR-218-5p 对hPDLSCs 的活性和骨向分化作用。
综上所述,抑制miR-218-5p 可促进人牙周膜干细胞发生成骨分化,其作用机制与靶向JAG1 相关,为牙周膜干细胞用于治疗人牙周疾病奠定理论基础。
(本文图1见插图12-3)

