高糖环境下BCA-1通过血管平滑肌细胞对间充质干细胞增殖和凋亡的影响
李永涛,沈雷,张善强,姜杨,孙石柱
齐齐哈尔医学院基础医学院解剖教研室,黑龙江齐齐哈尔 161006
糖尿病患者全球约4.51亿人[1],我国糖尿病患发病率保守估计约为11%[2]。控制糖尿病及其并发症却不理想。间充质干细胞(mesenchymal stem cells,MSC)作为细胞治疗的首选细胞被用于多种疾病的治疗[3-5]。提高MSC归巢效率将促进MSC的再生修复能力。B淋巴细胞化学引诱物-1(b-lymphocyte chemical attractants-1,BCA-1)又称趋化因子13(CXC motif chemokine ligand 13,CXCL-13),不仅作为判断肝癌预后的良好指标[6],还可以激活CXCR5/ERK信号通路而加速乳腺癌细胞转移[7]。CXCL-13可以降低癌细胞免疫原性,在肿瘤免疫逃避中发挥作用[8]。此外发现MSC分泌的CXCL-13可促进骨髓瘤细胞侵袭,增加耐药性[9]。也有研究发现,BCA-1结合于MSC的CXCR5受体,诱导MSC成骨分化、成肌腱分化,在肌腱-骨愈合过程中发挥再生修复作用[10-11]。缺氧环境下,BCA-1通过MAPK/NFκB信号通路促进MSC自噬和增殖[12]。因此,BCA-1可能在招募MSC迁移或降低MSC低免疫原性等“干性”作用中发挥着重要作用。
MSC由血管迁移到组织是MSC穿过血管的过程,目前还不清楚BCA-1招募MSC归巢与血管平滑肌细胞的关系。该研究在细胞高糖模型下,以BCA-1刺激主动脉平滑肌细胞(aortic smooth muscle cells,ASMC)的上清液制备条件培养基,观察各组ASMC对MSC增殖和凋亡作用及分子机制,为BCA-1诱导MSC归巢穿越血管壁,治疗糖尿病及其并发症提供研究数据。
1 材料与方法
1.1 材料
小鼠主动脉平滑肌细胞(mASMC)、小鼠骨髓间充质干细胞(mBMSC)均购自深圳豪地华拓生物科技有限公司;小鼠BCA-1重组蛋白购自武汉艾美捷科技有限公司;LY294002重组蛋白购自美国Selleck公司;胎牛血清(Fetal Bovine Serum,FBS)、α-MEM培养基、RPMI-1640培养基均购自美国Hyclone公司;Annexin VFITC/PI细胞凋亡试剂盒购自南京凯基生物科技发展有限公司;CCK-8购自日本Dojindo公司;苯甲基磺酰氟(Phenylmethylsulfonyl fluoride,PMSF)购自上海碧云天生物技术有限公司;小鼠IL-8、Akt、磷酸化-Akt(Phosphorylation-Akt,p-Akt)蛋白的ELISA试剂盒购自美国R&D公司。兔抗小鼠Caspase-8、兔抗小鼠β-actin和HRP标记羊抗兔IgG购于Abcam公司。美国Molecular Devices公司的Emax酶标仪;美国BD公司的FACSAria II型流式细胞仪。
1.2 方法
1.2.1 细胞高糖模型 含30 mmol/L葡萄糖的培养基为细胞高糖培养基,用细胞高糖培养基培养的细胞为高糖细胞模型[13]。
1.2.2 mASMC培养与分组 含10%FBS的RPMI-1640培养基培养mASMC。正常条件下培养的mASMC为正常对照组。高糖环境下培养的mASMC为高糖对照组;以50 ng/mL BCA-1刺激者为高糖BCA-1组;若预先加入10μmol/L LY294002培养60 min,0.01 mmol/L PBS清洗后,再以50 ng/mL BCA-1刺激则为高糖PI3K抑制剂组。
1.2.3 条件培养基1.5×105各组mASMC,在37℃,5%CO2培养12 h后,取上清液;1 000 r/min离心5 min,0.22μm滤器抽滤;与mBMSC培养基按1:5稀释,即为各组mASMC的条件培养基(Conditioned medium,CM)[13],用于培养mBMSC。
1.2.4 mBMSC培养与分组 含10%FBS的α-MEM培养基培养mBMSC。正常条件下培养mBMSC为正常对照组:高糖环境下无任何刺激者为高糖对照组。以mASMC的高糖对照组CM、高糖BCA-1组CM和高糖PI3K抑制剂组CM培养的mBMSC,分别为高糖CM组、高糖BCA-1CM组和高糖PI3K抑制剂CM组。
1.2.5 CCK-8实验 8.0×103mBMSC培养在96孔板,37℃、5%CO2培养12 h;0.01 mmol/L PBS清洗3次,1 min/min。按照mBMSC分组而加入相应的培养基或试剂,继续培养12 h。各孔加入CCK-8溶液10μL,37℃、5%CO2培养2 h后,Emax酶标仪于450 nm处检测各组mBMSC吸光度值(Absorbance value,A)。
1.2.6 流式细胞凋亡实验 2.0×105各组mBMSC细胞重悬于1.25%Annexin V-FITC溶液中,室温孵育15 min,4℃,10 000 r/min离心5 min后,加入等体积的2%PI溶液,冰上孵育2 min,4℃,10 000 r/min离心5 min后,0.01 mmol/L PBS重悬,FACSAria II流式细胞仪检测细胞凋亡率。
1.2.7 West er n bl ot 含1 mmol/L PMSF的细胞裂解液裂解各组5.0×106 mBMSC,4℃,12 000 r/min离心60 min。BCA蛋白浓度测定试剂盒定量。浓缩胶75 V电泳30 min,分离胶110 V电泳45 min;75 V转膜2 h至硝酸纤维素膜。脱脂奶粉封闭后,加入兔抗小鼠Caspase-8抗体 (1∶550),兔抗小鼠β-actin抗体(1:800),4℃过夜后;加入HRP标记羊抗兔IgG(1∶500),室温孵育120 min;滴加ECL试剂,Tanon 6 200发光成像工作站显影。Image-Pro Plus 6.0.1图像分析软件检测各蛋白条带的相对光密度值 (Optical density value,OD),并计算各蛋白的相对表达量。
1.2.8 酶联免疫吸附试验(ELISA)提取5.0×106各组mASMC上清液,小鼠IL-8蛋白ELISA试剂盒检测各组mASMC上清液中IL-8蛋白含量。含1 mmol/L PMSF的裂解液裂解各组mASMC,4℃,12 000 r/min离心8 min,提取各组细胞裂解液。小鼠Akt、p-Akt蛋白ELISA试剂盒检测各组mASMC裂解液中Akt、p-Akt蛋白含量。
1.3 统计方法
采用SPSS 21.0统计学软件进行数据分析,计量资料用(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Q检验;计数资料用[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组条件培养基对mBMSC增殖的影响
正常对照组、高糖对照组、高糖CM组、高糖BCA-1CM组、高糖PI3K抑制剂CM组mBMSC的A值分别为(1.47±0.20)、(0.62±0.39)、(0.85±0.22)、(1.31±0.15)、(0.53±0.34),差异有统计学意义(F=80.33,P<0.01)。高糖对照组A值是正常对照组的0.42倍,差异有统计学意义(P<0.01);高糖对照CM组A值是高糖对照组的1.37倍,差异有统计学意义(P<0.05);高糖BCA-1CM组A值是高糖对照CM组1.54倍,差异有统计学意义(P<0.01);高糖PI3K抑制剂CM组A值是高糖BCA-1CM组的0.40倍,差异有统计学意义(P<0.01),见图1。结果提示高糖环境下,BCA-1刺激的mASMC条件培养基能促进mBMSC增殖。

图1 CCK-8实验检测各组mBMSC增殖
2.2 各组条件培养基对mBMSC凋亡率的影响
各组mBMSC的细胞凋亡率比较,差异有统计学意义(P<0.01)。高糖对照组mBMSC细胞凋亡率是正常对照组的2.02倍,差异有统计学意义(P<0.01);高糖BCA-1CM组mBMSC细胞凋亡率是高糖CM组的62.2%,差异有统计学意义(P<0.01);高糖PI3K抑制剂CM组mBMSC凋亡率是高糖BCA-1CM组的1.37倍,差异有统计学意义(P<0.01)。见图2。
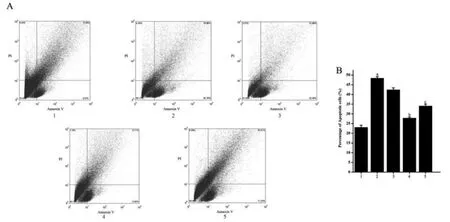
图2 流式细胞术分析各组mBMSC凋亡
2.3 各组条件培养基对mBMSC的Caspase-8蛋白表达的影响
为了进一步验证各组条件培养基对mBMSC凋亡的影响,Western blot检测各组mBMSC的Caspase-8蛋白表达。正常对照组、高糖对照组、高糖CM组、高糖BCA-1CM组、高糖PI3K抑制剂CM组的Caspase-8蛋白相对表达量分别为(0.52±0.03)、(0.75±0.08)、(0.70±0.06)、(0.42±0.04)、(1.10±0.01),差异有统计学意义(F=488.00,P<0.01)。高糖对照组Caspase-8蛋白是正常对照组的1.44倍,差异有统计学意义(P<0.01);高糖CM组Caspase-8蛋白是高糖对照组的0.93倍,差异有统计学意义(P<0.05);高糖BCA-1CM组Caspase-8蛋白是高糖CM组0.60倍,差异有统计学意义(P<0.01);高糖PI3K抑制剂CM组Caspase-8蛋白是高糖BCA-1CM组2.38倍,差异有统计学意义(P<0.01),见图3。两种细胞凋亡实验结果均提示高糖环境下,BCA-1通过激活mASMC内PI3K信号通路,受BCA-1刺激的mASMC条件培养基能降低mBMSC凋亡。

图3 Western blot法检测各组mBMSC的Caspase-8蛋白表达
2.4 BCA-1对mASMC的Akt、p-Akt、IL-8蛋白表达的影响
ELISA检测各组mASMC裂解液中Akt、p-Akt蛋白含量。高糖对照组的Akt、p-Akt蛋白量分别是正常对照组的1.27倍、1.06倍,差异有统计学意义(P<0.001);高糖BCA-1组的Akt、p-Akt蛋白含量分别是高糖对照组的1.54倍、1.40倍,差异有统计学意义(P<0.001);高糖PI3K抑制剂组的Akt、p-Akt蛋白含量分别是高糖BCA-1组的0.68倍、0.79倍,差异有统计学意义(P<0.001)。ELISA检测各组mASMC上清液中IL-8含量发现,高糖对照组的IL-8蛋白量是正常对照组的1.50倍,差异有统计学意义(P<0.001);高糖BCA-1组的IL-8蛋白含量是高糖对照组的1.92倍,差异有统计学意义(P<0.001);高糖PI3K抑制剂组的IL-8蛋白含量是高糖BCA-1组的0.77倍,差异有统计学意义(P<0.001),见表1。这说明BCA-1激活mASMC内Akt通路,促进mASMC表达IL-8蛋白,PI3K抑制剂能够阻断这一过程。
表1 BCA-1对mASMC的Akt、p-Akt蛋白表达的影响[(±s),μg/mL]

表1 BCA-1对mASMC的Akt、p-Akt蛋白表达的影响[(±s),μg/mL]
注:a P<0.001,与正常对照组比较;b P<0.001,与高糖对照组比较;c P<0.001,与高糖BCA-1组比较
指标正常对照组(n=16)高糖对照组(n=16)高糖BCA-1组(n=16)高糖PI3K抑制剂组(n=16)F值 P值Akt p-Akt IL-8 6.03±0.14 5.16±0.09 2.38±0.34(7.71±0.29)a(5.48±0.15)a(3.57±0.28)a(11.85±0.18)b(7.69±0.13)b(6.84±0.21)b(8.16±0.24)c(6.10±0.12)c(5.33±0.67)c 1987.68 1308.22 357.74<0.001<0.001<0.001
3 讨论
糖尿病及其相关并发症造成患者生活质量的下降[14]。胰腺及胰岛细胞的移植虽可解决上述弊端,但由于供体来源短缺,易出现免疫排斥反应,致使移植手术难以在临床广泛推广[15]。体内分布广泛的MSC具有容易提取、易于培养、多分化性、低免疫原性等特点,为糖尿病及其并发症的治疗带来希望。趋化因子是一族小的多肽,主要作用为活化细胞,促进细胞运动[16]。研究发现MSC可表达CCR1、CCR7、CCR9、CXCR4、CXCR5等多种趋化因子配体[8],趋化因子可促进MSC等细胞归巢并在组织中集聚[17]。BCA-1(CXC13)可与MSC表达的CXCR5配体结合,促进人骨髓MSC的增殖和自噬[12],并能够提高MSC成骨分化的能力[10],BCA-1提高了大鼠损伤肌腱张力负荷水平,促进小鼠C3HIOT1/2间充质细胞系ERK1/2、JNK和p38蛋白的表达,提高C3HIOT1/2细胞成骨能力[10]。但是BCA-1在高糖环境下对MSC增殖或凋亡的影响却鲜见报道。
该研究探讨高糖环境下,BCA-1处理的ASMC对MSC增殖和凋亡的影响。30 mmol/L葡萄糖建立的细胞高糖模型相当于血糖浓度540 mg/dl,Shen L等[13]也据此建立细胞高糖模型,是比较认可的细胞高糖模型。高糖对照组mBMSC的A值与正常对照组相比,出现明显降低,其原因可能与高糖环境导致细胞内活性氧、氧自由基等物质增多有关。张磊等[18]研究HK-2正常人近端肾小管上皮细胞发现,30 mmol/L葡萄糖通过激活活性氧介导的NF-κB信号通路,诱导HK-2人肾小管上皮细胞NF-κBp65及α-SMA表达升高,细胞发生转分化,贺今等[19]在动物研究中报道,苯能够诱导骨髓细胞活性氧(ROS)表达增高,阻滞造血干细胞S期,最终出现苯所致小鼠再生障碍性贫血。这再次证明ROS阻断了线粒体呼吸链的传递,抑制了细胞的代谢,引起细胞有丝分裂周期延长[19],致使细胞增殖能力降低有关,该研究结果与Shen L、张磊、贺今等学者的观点和研究结果相符,即高糖环境下mBMSC的A值明显降低。与高糖对照组相比,高糖CM组和高糖BCA-1CM组mBMSC的A值逐渐增加,这可能是高糖环境使mASMC产生ROS、氧自由基等有害物质,mASMC能启动、释放清除氧自由基的超氧化物歧化酶等抗氧化酶家族成员有关。岳萌等[20]在链脲佐菌素诱导联合大脑中动脉栓塞动物模型的缺血再灌注后5、24 h收集脑组织,利用免疫荧光等试验均发现ROS增加的同时,脑组织抗氧化酶的表达也呈现逐渐增多的趋势,或Huang F等[21]研究高浓度葡萄糖诱导的人系膜细胞中也发现,高糖组人系膜细胞释放IL-8、TNF-1α等炎症因子,以维持细胞自身生存或能量供给,该研究结果也发现与对照组相比,高糖对照组IL-8蛋白表达增高,富含白介素等细胞因子的mASMC条件培养基培养mBMSC,促进了高糖环境下mBMSC的增殖。
高糖BCA-1CM组mBMSC的A值明显增加,并结合mASMC内Akt蛋白含量与其他组相比,有较大上调的ELISA研究结果,认为BCA-1与mASMC表面CXCR5相结合[12],启动了mASMC内部的PI3K-Akt信号通路。张超等[22]研究发现,Akt信号通路是经典而复杂的信号网络,其主要作用为维持细胞稳态,促进细胞增殖、分化和运动。PI3K蛋白是激活Akt信号通路的关键原件,PI3K被激活后可进一步磷酸化Akt信号通路。此外,Akt通路还与人肺成纤维细胞分泌IL-6、IL-8等细胞因子密切相关[23]。该研究也发现BCA-1促进mASMC分泌IL-8,IL-8能促进MSC在高糖环境下增殖,降低MSC凋亡,并能够招募MSC归巢运动,Hou Y等[24]研究发现IL-8不仅增强人骨髓MSC归巢,还能够促进人骨髓MSC表达VEGF蛋白,加速血管生成潜能。BCA-1与CXCR5结合的信号过程被PI3K抑制剂阻断,抑制了PI3K-Akt信号通路的活化,导致mASMC旁分泌障碍,进而使mBMSC的A值降低。
为了验证BCA-1处理的mASMC对mBMSC凋亡的影响,采用两种细胞凋亡研究方法。研究均发现各组mBMSC凋亡的情况与mBMSC的A值趋势明显相反。与正常对照组相比,高糖对照组mBMSC的Caspase-8蛋白的相对表达量和细胞凋亡率增高的原因是由于mBMSC群落为对抗高糖损伤,部分衰老的细胞率先出现凋亡现象,为其余细胞提供能量和营养物质,以维持细胞整体的生长。Davydov VV等[25]研究认为氧化应激及凋亡反应的生理意义在于避免细胞接触有害物质的损伤,促进细胞集落的生长,这是机体的本能反应机制的细胞生物学表现形式。高糖BCA-1CM组mBMSC的Caspase-8蛋白相对表达量降低,而高糖PI3K抑制剂CM组的Caspase-8蛋白相对表达量又升高,进一步提示BCA-1激活mASMC内PI3K-Akt信号通路,促进mASMC表达IL-8等细胞因子上调mBMSC的增殖,抑制细胞凋亡的表达。
综上所述,高糖环境下,BCA-1能够通过激活mASMC内的PI3K-Akt信号,发挥保护MSC对抗高糖环境的作用。后续研究还将建立糖尿病足动物模型,在动物研究水平,阐述BCA-1通过ASMC招募MSC的效果和机制。

