小米提取物及其消化液的抗氧化和降糖作用
尹瑞旸,李 星,胡锦荣,胡小松,沈 群*
(1 中国农业大学食品科学与营养工程学院 植物蛋白与谷物加工北京市重点实验室国家果蔬加工工程技术研究中心 北京100083)2 国家食品质量安全监督检验中心 北京100094)
糖尿病是一种慢性代谢紊乱性疾病,表现为胰岛素分泌不足或胰岛素利用率降低,进而引起的高血糖症状[1]。其中,以胰岛素抵抗为特征的二型糖尿病占总数的90%,成为全球性的重大公共卫生问题[2]。很多科学家都在寻找合适的药物或者通过膳食干预来改善胰岛素抵抗,降低二型糖尿病对人体健康的影响[3-4]。然而,这些药物会导致患者出现体重增加、骨质流失和胃肠道功能紊乱等不良反应[5]。还有相当一部分研究通过食物中的功效成分降低胰岛素抵抗[6-7]。研究表明,提高谷类的摄入量可降低糖尿病的发病率[8]。
小米作为粟类的代表,是干旱及半干旱地区的主要粮食作物。小米富含多种活性组分,如膳食纤维、多酚、色素、抗性淀粉及蛋白等,具有调节糖脂代谢及护肝等生物功能[9-10]。大量的动物实验及人群试验发现小米具有降糖功效。Ren 等[11]人发现小米膳食可显著降低糖耐量受损人群空腹血糖及餐后2 h 血糖[9]。Qi 等[12]人研究表明小米干预可显著降低STZ 诱导的糖尿病大鼠的空腹血糖[10]。小米富含多种活性组分,如膳食纤维、多酚、色素、抗性淀粉及蛋白等,具有调节糖脂代谢及护肝等生物功能[11-12]。有研究表明,小米中的脂肪酸,尤其是亚油酸可显著降低小米淀粉的体外消化率[13];小米中的蛋白可降低糖尿病小鼠的血糖和血脂含量[14]。然而,综合比较小米不同极性组分的降糖作用的研究较少。
肝脏作为糖代谢的重要器官,参与糖的代谢及合成,也是胰岛素抵抗的重要靶器官。相对于动物实验,体外的细胞试验因具有周期短、成本低及易于重复等优点而广泛用于食品和药品的体外评价。其中,HepG2 细胞为人肝癌细胞,该细胞既保留了正常肝细胞的生物特征,又具有高亲和力的胰岛素受体[15]。大量试验表明,利用棕榈酸(PA)处理HepG2 细胞可成功诱导胰岛素抵抗模型,此时细胞的糖吸收显著低于正常细胞[16-17]。本试验中采用水、乙醇、正丁醇、正己烷4 种不同极性溶剂提取小米不同组分,分析提取物及沉淀物消化液的抗氧化活性和对PA 诱导的IR-HepG2 细胞糖吸收的影响,为小米的功效研究提供支持,为进一步推广利用提供依据。
1 材料与方法
1.1 试验材料与试剂
HepG2 细胞株购自北京协和医学院细胞库。
DMEM 高糖培养基、PBS 缓冲液、0.25%胰酶细胞消化液,北京索莱宝科技有限公司;胎牛血清,美国Gibco 公司;无脂肪酸牛血清白蛋白、胆盐,上海源叶生物科技有限公司;棕榈酸钠、胃蛋白酶、α-淀粉酶、胰蛋白酶、噻唑蓝(MTT),美国Sigma 公司;乙醇、正丁醇、正己烷(分析纯级),国药集团化学试剂有限公司;葡萄糖检测试剂盒,南京建成生物研究所;试验所用小米购于山西东方亮生命科技股份有限公司,小米所含基本营养成分如表1所示。

表1 小米基本营养成分Table 1 Nutritional components of millet
1.2 试验方法
1.2.1 样品提取 小米样品置37 ℃热风干燥箱中烘干24 h,粉碎过80 目筛。小米粉用水、乙醇、正丁醇及正己烷以料液比1∶10 在50 ℃条件下旋涡提取1 h,抽滤,重复两次,分别收集滤液及滤渣。乙醇、正丁醇及正己烷提取物减压蒸馏,水提物及滤渣冷冻干燥,得水提物、乙醇提取物、正丁醇提取物及正己烷提取物,提取率分别为5.978%,9.764%,6.262%,4.749%,提取物及沉淀物于-80℃冷藏备用。
1.2.2 提取物及沉淀物的体外模拟消化 通过调节pH 值、温度、添加酶模拟胃肠道消化液,利用消化液对小米提取物及沉淀物进行体外模拟消化。口腔消化阶段:于50 mL 离心管中加入提取物0.15 g 或沉淀物0.75 g(不添加样品为空白组),之后加入9 mL 口腔消化液(α-淀粉酶终活力为200 U)将pH 值调至6.75,37 ℃下震荡10 min。胃消化阶段:用1 mol/L HCl 将口腔消化液pH 值调至1.2,终止α-淀粉酶作用,加入9 mL 胃消化液(0.32 g 胃蛋白酶溶于100 mL 的0.03 mol/L NaCl溶液)37 ℃下震荡2 h。肠消化阶段:用1 mol/L NaHCO3将胃消化液pH 值调至6.5,终止胃蛋白酶作用,加入1.5 mL NaCl(120 mmol/L)、1.5 mL KCl(5 mmol/L)及9 mL 肠消化液(0.15 g 胰蛋白酶和0.9 g 胆盐溶于100 mL 的0.1 mol/L NaHCO3),37 ℃下震荡2 h(消化流程如图1所示)。
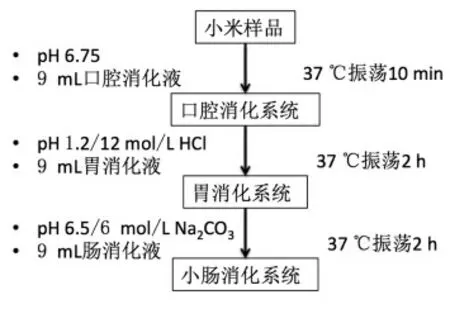
图1 样品消化流程Fig.1 Digestion process of samples
70 ℃下加热消化液15 min 将酶灭活,10 000×g离心15 min。收集上清液,用0.22 μm滤膜过滤除菌分装,得水提物消化液、乙醇提取物消化液、正丁醇提取物消化液、正己烷提取物消化液、水沉淀物消化液、乙醇沉淀物消化液、正丁醇沉淀物消化液、正己烷沉淀物消化液及小米消化液,于-80 ℃保存。
1.2.3 DPPH 自由基清除能力测定 0.15 mmol/L DPPH-乙醇溶液与样品溶液按1∶1(体积比)混合,室温避光反应1 h 后,离心取上清,于波长517 nm处测定吸光值。DPPH·清除能力按下式计算:
DPPH·清除率(%)=[1-(A1-A2)/A0]×100
式中,A0——DPPH 溶液+无水乙醇/蒸馏水的吸光度;A1——DPPH 溶液+样品溶液的吸光度;A2——样品溶液+无水乙醇的吸光度。
利用5~50 μmol/L 水溶性维生素E 制作标准曲线为y=0.0135x-0.0189,R2=0.999。
1.2.4 总抗氧化能力测定 将提取物及消化液配制成不同的质量浓度梯度,其中提取物为5.0,10.0,15.0,20.0,25.0 mg/mL,提取物消化液为5 mg/mL,沉淀物消化液为25 mg/mL。样品溶液与工作液按1∶3(体积比)比例混合,其中工作液为10 mmol/L 2,4,6-三吡啶基三嗪(TPTZ)、20 mmol/L FeC13、0.3 mol/L 醋酸缓冲液以1∶1∶10(体积比)的比例混合,摇匀后于37 ℃水浴中静置10 min,于波长593 nm 处测定其吸光值。另以FeSO4作标准曲线(浓度为0.0125~0.300 mmol/L,吸光度为0.087~0.952),样品的抗氧化活性以达到同样吸光度值所需的FeSO4的物质的量表示。标准曲线为:y=3.0485x+0.0458,R2=0.999。
1.2.5 MTT 法测定细胞存活率 细胞加样处理后,加入0.5 mg/mL MTT-DMEM 于37 ℃避光孵育4 h 后除去培养基,加入100 μL DMSO,震荡混匀以完全溶解出MTT 紫色结晶产物。用酶标仪在波长570 nm 处测定吸光度值。
1.2.6 棕榈酸钠溶剂的配制 棕榈酸钠(PA)在70 ℃下用超纯水溶解,加入到5%牛血清白蛋白(不含游离脂肪酸)溶液中,配制成终浓度为5 mmol/L 的PA 母液,用0.22 μm 滤膜过滤除菌分装,于-20 ℃保存,两周内用完。使用前将PA 母液55 ℃复热15 min 后,用DMEM 培养基稀释到相应倍数。
1.2.7 小米提取物及消化液对IR-HepG2 糖吸收的测定 当HepG2 细胞融合度为80%时,将细胞消化,用含15% FBS 的DMEM 培养基调整密度,以30 000 个/孔的密度接种于96 孔板中。待细胞贴壁后,换以含或不含0.25 mmol/L PA 及样品的培养基培养24 h。将细胞分为正常对照组、模型组及样品组,提取物组终质量浓度为20,40,80 μg/mL;提取物消化液组终质量浓度20,80 μg/mL;沉淀物消化液组终质量浓度200,400 μg/mL。细胞加样处理24 h 后,弃去培养液,用PBS 洗2 次,换为含10-7mol/L 胰岛素的无血清DMEM 培养基孵育20 h 后,取5 μL 上清液,用葡萄糖试剂盒测定葡萄糖含量。以无血清DMEM 培养基葡萄糖含量为对照,计算样品20 h 葡萄糖消耗量。若细胞数量变化较大,需进行归一化处理。
1.2.8 数据处理方法 采用Excel 软件统计数据,所有数据均为4 次重复试验的平均值和标准误差。采用SPSS 16.0 软件进行显著性分析,P<0.05 表示差异显著性。
2 结果与分析
2.1 提取物及提取物消化液的抗氧化活性
2.1.1 提取物DPPH 自由基清除能力比较 由于消化液中的酶与DPPH·反应生成的物质有颜色,对检测结果有干扰,结果不可信,因此仅对提取物的DPPH·清除能力进行测定。由图2 可知,4 种提取物对DPPH·的清除效果与样品质量浓度都呈剂量依赖关系。各提取物的抗氧化能力存在较大差距,当样品质量浓度为3.5 mg/mL 时,水、乙醇、正丁醇及正己烷提取物对DPPH·的清除率分别为(55.07±0.31)%,(45.07±1.10)%,(26.47±1.17)%,(20.67±0.90)%。单位质量浓度样品的DPPH·清除能力相当于水溶性维生素E 质量摩尔浓度的值分别为(15.00±0.45),(11.06±0.48),(7.00±0.20),(5.04±0.15)μmol/mg,说明水提物的抗氧化能力优于有机溶剂提取物。
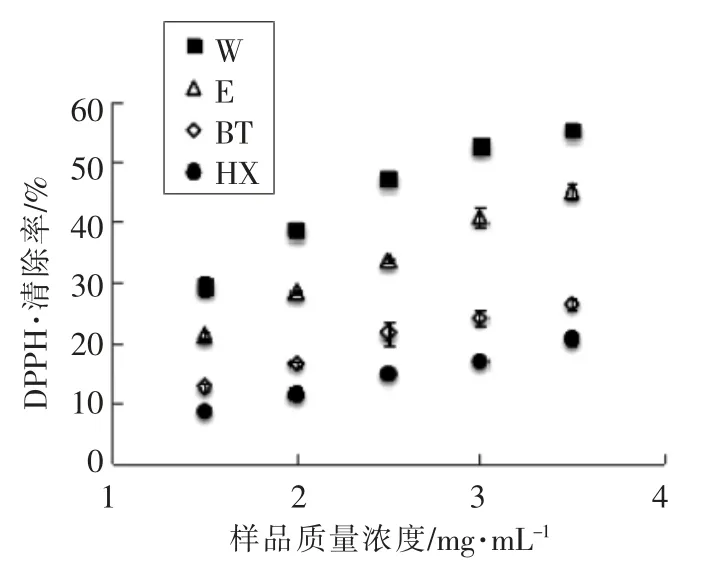
图2 提取物的DPPH·清除率Fig.2 DPPH· scavenging rate of extracts
2.1.2 提取物及其消化液总抗氧化能力比较 从图3 可知,不同提取物质量浓度与总抗氧化能力呈剂量依赖关系。当样品质量浓度为5 mg/mL 时,水、乙醇、正丁醇及正己烷提取物的总抗氧化能力分别为(0.136±0.001),(0.099±0.001),(0.032±0.002),(0.029±0.003)mmol/L。在较高质量浓度下(>15 mg/mL),水提物的抗氧化能力达到平台期,其抗氧化能力不及乙醇提取物,说明水提物存在较单一的物质,对特定的自由基清除能力较强,但总抗氧化能力不及乙醇提取物。
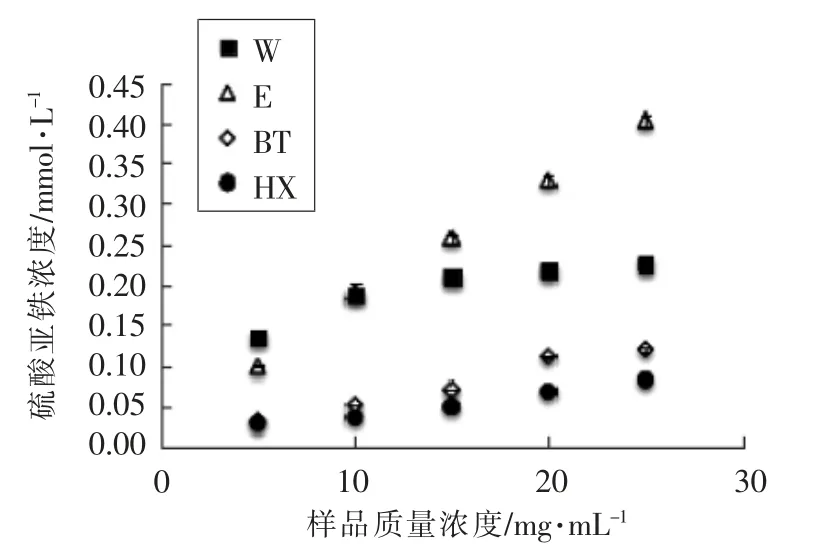
图3 提取物总抗氧化能力Fig.3 Total antioxidant capacity of extracts
小米作为一种粮食作物,其主要成分为淀粉,蛋白,脂肪、膳食纤维,还包含一些微量物质如多酚、胡萝卜素等(表1)。根据以往研究可知,水提物中主要富集的成分有水溶性蛋白、多糖及酚酸类物质等[18]。小米中有较高含量的酚酸物质(如阿魏酸为15.6 μg/100 g),而酚酸类物质有较高的抗氧化活性[19]。乙醇提取物中富含丰富的醇溶蛋白及多酚等物质,其中小米中的蛋白主要为醇溶蛋白,是小米乙醇提取物主要成分,赋予了乙醇提物较高的抗氧化活性[20-21]。正己烷提取物中主要为脂肪酸、叶黄素、生育酚及胡萝卜素等,其抗氧化活性不及乙醇提取物[22]。
从图4 可知,当样品质量浓度为5 mg/mL 时,抗氧化能力分别为水提取>乙醇取提物>正丁醇提取物>正己烷提取物,分别为(0.068±0.000),(0.045 ±0.001),(0.025 ±0.002),(0.016 ±0.000)mmol/L。可以发现,消化后提取物的抗氧化能力明显降低,分别降低了50.00%,54.55%,21.88%,44.83%。当沉淀物消化液质量浓度为25 mg/mL时,抗氧化能力为正己烷沉淀物≥小米>乙醇沉淀物>正丁醇沉淀物≥水沉淀物。
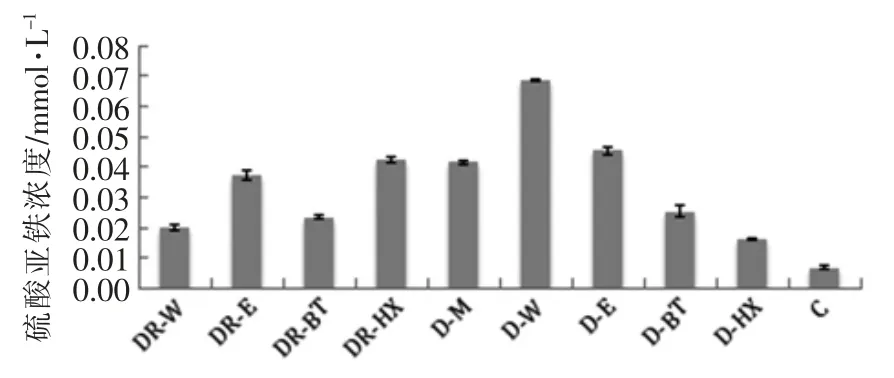
图4 提取物及沉淀物消化液总抗氧化能力Fig.4 Total antioxidant capacity of extracts and sediment digestive solution
提取物经过消化后抗氧化能力有所下降,这是由于胃肠道消化中pH 值的变化及酶的作用使一些活性成分分解。因此,体外试验不能够完全显示出活性组分对机体的作用效果。之后的体外细胞筛选小米降糖成分的试验,将综合评价提取物、提取物消化液及沉淀物消化液对胰岛素抵抗细胞糖吸收的作用。
2.2 小米提取物及其消化液对IR-HepG2 糖吸收的影响
2.2.1 小米提取物对IR-HepG2 糖吸收的影响由图5 可知,模型组细胞的糖吸收显著低于对照组,说明0.25 mmol/L 的PA 处理HepG2 细胞可成功复制出胰岛素抵抗模型。水提物、乙醇提取物、正丁醇提取物及正己烷提取物均促进了模型细胞的糖吸收。其中80 μg/mL 乙醇提取物,40 μg/mL和80 μg/mL 正丁醇提取物,20,40,80 μg/mL 正己烷提取物均可显著提高胰岛素抵抗细胞的糖吸收,与模型组相比吸收率分别提高19.17%,25.02%,41.44%,9.15%,26.38%,53.07%,说明此质量浓度下的提取物对HepG2 细胞的胰岛素抵抗有改善作用。Nishizawa 等[14]发现小米蛋白可以显著改善糖尿病小鼠的胰岛素抵抗,然而乙醇提取物对IR-HepG2 的改善作用不及抗氧化性不强的正己烷提取物,这表明起到降糖效果的活性物质不仅仅是具有较高抗氧化活性的蛋白及多酚等物质,同时表明乙醇提取物中的醇溶蛋白主未经消化很难被细胞利用。有研究表明,不饱和脂肪酸——亚油酸可有效增加胰岛素敏感性,降低餐后及空腹血糖[23]。小米中富含丰富的不饱和脂肪酸,而这些脂肪酸主要富集在正己烷提取物中,而正丁醇提取物中也富集了较多的脂肪酸[22]。因此,推测小米中的脂肪酸具有较好的改善糖代谢的作用。
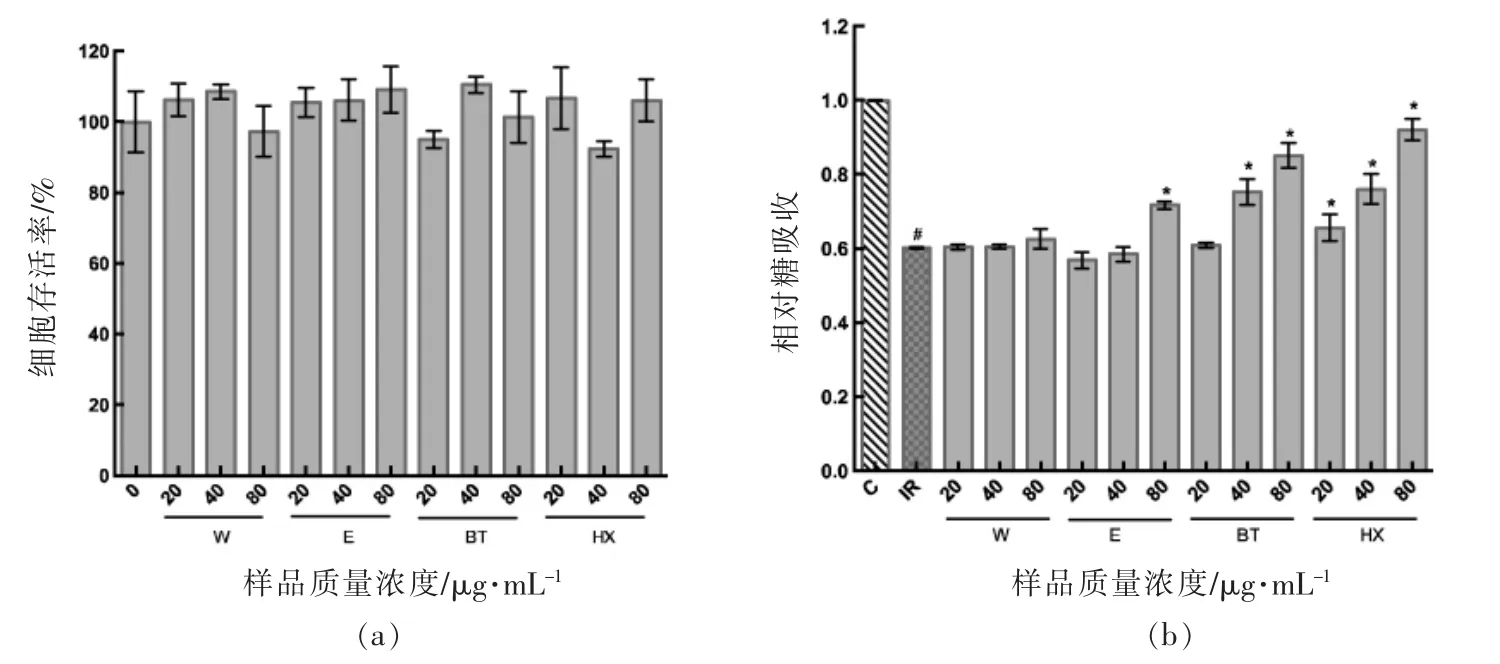
图5 提取物对胰岛素抵抗HepG2 细胞糖吸收的影响Fig.5 Effect of extracts on glucose uptake of IR-HepG2
2.2.2 提取物消化液对胰岛素抵抗HepG2 细胞糖吸收的影响 如图6所示,与正常对照组相比,模型组糖吸收下降了31.97%,有显著性差异(P<0.05);水提物消化液对胰岛素抵抗细胞糖吸收无显著影响。与C1 及C2 相比,20 μg/mL 和80 μg/mL 乙醇提取物消化液、正丁醇提取物消化液、正己烷提取物消化液均可显著促进胰岛素抵抗细胞糖吸收。提取物消化前、后对胰岛素抵抗细胞的糖吸收存在差异。其中,水提物消化后降低了IRHepG2 细胞的糖吸收;乙醇提取物消化后胰岛素抵抗改善作用显著增强,这可能是由于水提物中的多糖分解为单糖,增加了对细胞的刺激作用。有研究表明,高糖的摄入会加重糖脂代谢紊乱,降低HepG2 细胞的糖吸收[24-25]。小米醇溶蛋白在未消化前不容易被细胞利用,在胃肠道消化后分解为多肽或氨基酸作用于细胞,提高了其生物利用率[26-27],揭示了在体外细胞评价前期进行模拟消化试验的重要性,特别是对于含有较多蛋白及淀粉多糖等大分子物质的样品。
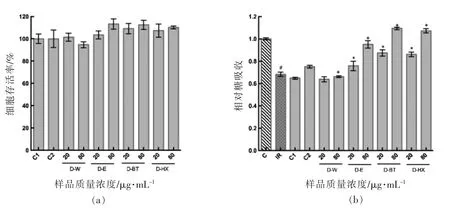
图6 提取物消化液对胰岛素抵抗HepG2 细胞糖吸收的影响Fig.6 Effect of extracts digestive solution on glucose uptake in IR-HepG2
2.2.3 沉淀物消化液对胰岛素抵抗HepG2 细胞糖吸收的影响 如图7所示,与C1 及C2 相比,200 μg/mL 和400 μg/mL 的水沉淀物消化液、正丁醇沉淀物消化液,正己烷提取物消化液、小米消化液均可显著促进胰岛素抵抗细胞糖吸收。乙醇沉淀物消化液对胰岛素抵抗细胞糖吸收无显著影响,因此推测小米中起降糖作用的主要物质集中在乙醇提取物中。小米正己烷提取物及正己烷沉淀物消化液均可有效促进IR-HepG2 细胞的糖吸收(图6 和7),可能是由于油脂类物质会与小米中的蛋白作用,抑制了蛋白质的消化,在剥离了这些物质后提高了正己烷沉淀物中蛋白的消化程度,从而提高了降糖效果,使正己烷沉淀物消化液仍保持较高的活性。推测小米各组分之间存在相互作用(协同或拮抗),从而影响其生物活性。
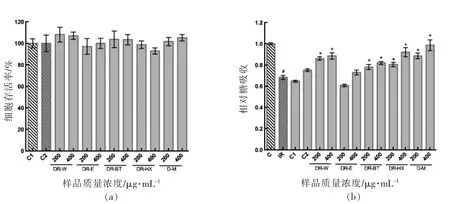
图7 沉淀物消化液对胰岛素抵抗HepG2 细胞糖吸收的影响Fig.7 Effect of sediment digestive solution on glucose uptake in IR-HepG2
3 结论
本文研究表明,DPPH·清除能力的大小顺序为水提取>乙醇提取物>正丁醇提取物>正己烷提取物。总抗氧化能力与DPPH·清除能力结果类似,水提物也表现出了较好的抗氧化活性,在质量浓度为15 mg/mL 时达到平台期,抗氧化能力不及乙醇提取物。提取物经过模拟体内胃肠道消化后,总抗氧化活性降低。然而,抗氧化能力较强的水提物对IR-HepG2 细胞糖吸收的影响较低,而正己烷和正丁醇对胰岛素抵抗改善作用明显。当提取物经过胃肠道消化后,对IR-HepG2 细胞糖吸收作用效果发生改变,其中乙醇提取物消化后降糖活性升高,水提物消化后加重了细胞的胰岛素抵抗,可能是由于提取物的蛋白及多糖分解、小分子活性物质在酸碱条件下结构发生改变等多种原因,需要进一步的验证。同时,提取后剩余物及小米消化后的消化液对IR-HepG2 细胞糖吸收也有促进作用,与提取物的结果基本吻合。
本试验的结果表明,提取物的抗氧化活性与其胰岛素改善作用之间没有明显联系,能够改善胰岛素抵抗作用的物质可能为低抗氧化活性物质,该类物质在经胃肠道消化后仍可保持较好的降糖功效。

