半滑舌鳎CsNLR-C6和CsNLR-C7基因的克隆及免疫应答分析
陈张帆,王 洁,徐锡文,周 茜,陈松林
(1.中国水产科学研究院黄海水产研究所,青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东青岛 266071;2.山东省海洋渔业生物技术与遗传育种重点实验室,山东青岛 266071;3.上海海洋大学水产与生命学院,上海 201306)
先天免疫系统是生物体以非特异方式抵御病原体(包括细菌和病毒)入侵的首道屏障。作为先天免疫系统的重要组成部分,模式识别受体(pathogen/pattern recognition receptors,PRRs)通过识别病原相关分子模式(pathogen associated molecular patterns,PAMPs),触发免疫反应(如炎症反 应)[1]。NOD样受体家族(NOD-like receptors,NLRs)是一类识别胞内PAMPs的PRR,在机体的抗细菌和抗病毒的免疫应答中起着重要的调控作用[2]。目前,在人类基因组中已鉴定出22个NLR蛋白,这些蛋白都具有NLR家族保守的结构域:N末端的效应器结构域,通常包含热蛋白结构域(PYR)、半胱天冬氨酸募集结构域(CARD)等;C末端的亮氨酸重复序列(LRR),主要含有配体结合位点;中段最保守的核苷酸结合寡聚化结构域(NACHT),用于自身低聚反应和自我调控[3-4]。
根据功能域的不同,鱼类的NLRs主要分为3个亚家族:NLR-A(与哺乳动物的NODs同源)、NLR-B(与哺乳动物的NALPs同源)、NLR-C(鱼类特有)[3]。鱼类中的NLR-C亚家族除了具有NLR家族保守的NACHT和LRR结构域外,还具有N末端鱼类特有的FISNA(fish-specific NACHT associated)结构域,和/或具有C末端的B30.2结构域。B30.2结构域包含丝氨酸-脯氨酸-精氨酸-酪氨酸模体(SPRY)和脯氨酸-精氨酸-酪氨酸模体(PRY),已被证实参与调控哺乳动物的免疫反应[5]。目前,已在斑马鱼(Danio rerio)[3]、斑点叉尾鮰(Ictalurus punctatus)[6]、牙 鲆(Paralichthysolivaceus)[7]、鮸(Miichthys miiuy)[8]、大菱鲆(Scophthalmus maximus)[9]中报道了NLR-C亚家族基因的克隆,并发现NLR-C基因表达量受LPS和poly I∶C刺激后升高,参与调控鱼体的先天免疫反应。
半滑舌鳎(Cynoglossus semilaevis)是我国重要的海水经济养殖鱼类之一,因其营养价值高、生长速率快、活动范围小等特点,深受消费者欢迎,养殖前景广阔[10]。然而,随着养殖规模的扩大,病害频发,半滑舌鳎养殖业的健康发展受到严重制约。其中,哈维氏弧菌(Vibrio harveyi)是引起半滑舌鳎细菌性疾病的主要病原菌之一,发病症状主要表现为体表皮肤溃烂、烂尾、烂鳍等[11]。为了探究半滑舌鳎抗哈维氏弧菌病的分子机制,研究人员对免疫相关基因进行了研究,如Toll样受体[12]、趋化因子[13]、多聚免疫球蛋白受体[14]、肿瘤坏死因子受体相关因子[15]等。前期研究中,通过生物信息学分析鉴定分析了半滑舌鳎NLR基因家族29个成员,其中,CsNOD3和CsNOD4基因对哈维氏弧菌感染表现出快速应答模式[16],CsCIITA参与了半滑舌鳎抗哈维氏弧菌的免疫反应,并直接调控MHC IIA和MHC IIB基因的表达[17]。本研究通过克隆分析半滑舌鳎的CsNLRC6和CsNLR-C7基因,检测其在健康组织中的分布模式,以及其在不同感染组织中对哈维氏弧菌的响应模式,以期为探讨NLR基因家族在半滑舌鳎、乃至硬骨鱼类的先天免疫系统中的重要作用奠定基础。
1 材料与方法
1.1 实验材料
4尾健康半滑舌鳎[平均体质量(31.0±6.5)g;平均体长(17.1±1.0)cm]购自山东海阳市黄海水产有限公司,解剖收集鳃、心脏、头肾、肠、肾脏、肝脏、肌肉、皮肤、脾脏、胃等组织样品,置于-80℃冻存,用于总RNA的提取。
哈维氏弧菌感染实验参考WEI等[18]的实验方法,即另取相同来源60尾10月龄生长状态良好的半滑舌鳎,经腹腔注射1.0×104cfu哈维氏弧菌。以感染前0 h作为对照,在注射12、24、48、72、96 h后,分别在各个时间点随机取样5尾鱼,解剖收集肾脏、鳃、肠、脾脏和肝脏组织,置于-80℃冻存,用于总RNA的提取。
1.2 RNA提取及cDNA第一链的合成
采用TRIzol试剂(Invitrogen,美国)提取总RNA,用0.8%琼脂糖凝胶电泳检测RNA的完整性,并用超微量分光光度计P100(Pultton,美国)检测RNA的浓度和质量。采用PrimerScriptTM RT reagent kit(TaKaRa,中国大连)进行痕量基因组DNA的去除以及cDNA第一链的合成。
1.3 获得CsNLR-C6和CsNLR-C7基因核心片段序列
基于InterProScan[19]对半滑舌鳎基因组[10]进行蛋白功能域的预测结果,以NLR基因家族保守的NACHT结构域和鱼类NLR-C家族特有的FISNA结构域进行搜索,筛选出16个半滑舌鳎NLR-C基因[16],其中根据CsNLR-C6和CsNLR-C7的cDNA序列,设计扩增其开放阅读框(ORF)序列的特异性引物(表1),采用PCR技术扩增目的条带,PCR反应体系为25μL,反应程序为:95℃,3 min;95℃,30 s,58℃,30 s,72℃,2 min,35个循环;72℃,10 min。PCR产物经1%琼脂糖凝胶电泳检测后,纯化并克隆到pEASY-T1载体上,转化至大肠杆菌DH5α中,挑取阳性克隆送至北京擎科新业生物技术有限公司(青岛)进行测序验证。
1.4 CsNLR-C6和CsNLR-C7基因序列分析
利用DNAMAN软件包对克隆得到的CsNLRC6和CsNLR-C7的核酸和氨基酸进行序列比对。通过ExPaSy ProtParam工具(http://web.expasy.org/protparam)对其分子量(Mw)和等电点(pI)进行预测。利用SMART预测CsNLR-C6和CsNLRC7的蛋白结构域,与CsNOD1-5蛋白序列的结构域进行比对分析。从NCBI上搜索人类(Homo sapiens)、斑马鱼、尼罗罗非鱼(Oreochromis niloticus)、半滑舌 鳎NOD1、NOD2、NOD3(NLRC3)、NOD4(NLRC5)、NOD5(NLRX1)及同源序列(表2),利用在线服务器GUIDANCE2 Server(http://guidance.tau.ac.il/)[20],选 择MAFFT算法(默认参数值)[21]进行多重氨基酸序列比对,使用IQ-TREE软件构建系统进化树(-B1000-alrt 1000)[22]。
1.5 实时荧光定量PCR(qPCR)
基于克隆得到的CsNLR-C6和CsNLR-C7基因的核心片段序列,用Primer3(https://primer3.ut.ee/)设计实时荧光定量PCR引物(表1),选用β-actin为内参基因。以4尾健康半滑舌鳎各个组织的cDNA为模板,检测两个基因的组织表达量;并以感染哈维氏弧菌后0、12、24、48、72、96 h的5条半滑舌鳎肾脏、鳃、肠、脾脏和肝脏组织的cDNA为模板,检测哈维氏弧菌感染后两个基因的表达量变化。使用SYBR®Premix ExTaqTMII(Tli RNaseH Plus)试剂盒(TaKaRa,中国大连)进行荧光定量PCR反应,反应程序设置如下:95℃,30 s;95℃,3 s,60℃,33 s,40个循环;95℃,15 s;60℃,60 s;95℃,15 s。实验数据采用相对表达量计算方法,即2-ΔΔCt法,经计算得到CsNLRC6和CsNLR-C7基因的相对表达量。数据以平均值±标准误差的形式表现表达量变化倍数。使用IBM®SPSS®统计平台(V.19.0)进行单因素方差分析(one-way ANOVA)和Turkey多重比较分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 CsNLR-C6和CsNLR-C7基因的ORF序列分析
以半滑舌鳎混合组织为模板,扩增得到CsNLR-C6和CsNLR-C7基因的ORF序列(GenBank登 录 号 分 别 为:MZ753812,MZ753813)。其中,CsNLR-C6的ORF为3234 bp,编码1078个氨基酸,预测蛋白相对分子量Mw为120.64 kDa,理论等电点pI为6.50;CsNLR-C7的ORF为2961 bp,编码987个氨基酸,预测蛋白相对分子量Mw为112.68 kDa,理论等电点pI为6.04。SMART软件预测结果显示,两个蛋白均含有1个FISNA结构域,1个NACHT结构域,1个B30.2(PRY/SPRY)结构域;此外,CsNLR-C6包含5个LRR结构域(图1-A),而CsNLR-C7包含4个LRR结构域(图1-B)。半滑舌鳎NLR-A亚家族(NOD1-5)均含有NACHT结构域,并在靠近3′端含有数量不等的LRR结构域(图2)。通过比较发现,半滑舌鳎NLR-C6和NLR-C7含有保守的NACHT结构域和LRR结构域,说明NACHT结构域和LRR结构域广泛地存在于半滑舌鳎NLR家族中,而FISNA结构域和B30.2结构域是半滑舌鳎NLR-C亚家族特有的。

图1 半滑舌鳎CsNLR-C6(A)和CsN LR-C7(B)ORF及其氨基酸序列Fig.1 The ORFs and deduced amino acid sequences of CsNLR-C6 and CsNLR-C7

图2 半滑舌鳎NLR家族的功能域分析Fig.2 Functional domain analysis of NLR family in Cynoglossus semilaevis
2.2 系统进化树分析
为了探究CsNLR-C6和CsNLR-C7在脊椎动物中的进化关系,使用IQ-TREE软件对人类、斑马鱼、尼罗罗非鱼和半滑舌鳎的NOD1-5以及NLR-C构建了系统进化树(图3)。在进化树上,这些蛋白被分成了6个进化枝:NOD1、NOD2、NOD3、NOD4、NOD5以 及NLR-C。CsNLR-C6、CsNLR-C7与尼罗罗非鱼、斑马鱼的NLR-C组成一支,与NOD3的进化关系较近。而在其余的进化枝中,半滑舌鳎、尼罗罗非鱼与斑马鱼的进化地位均较为接近。
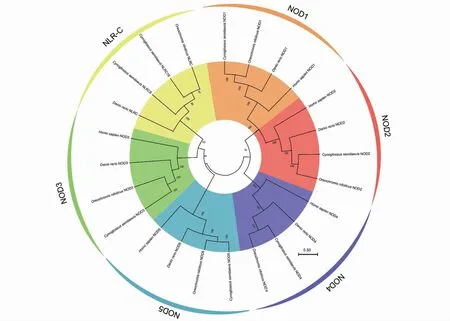
图3 NLR家族的系统进化分析Fig.3 Phylogenetic analysis of NLR family in representative species
2.3 CsNLR-C6和CsNLR-C7基因的组织表达分析
为了检测CsNLR-C6和CsNLR-C7基因在健康鱼体组织中的表达分布,采用qPCR方法检测了这两个基因在心脏、肝脏、头肾、鳃、脑、肾、皮肤、脾、胃和肌肉组织中的表达量。结果表明(图4),CsNLR-C6在免疫相关组织如鳃、肠、皮肤、脾中具有较高的表达量,而CsNLR-C7在免疫相关组织如鳃、头肾、肝中具有较高的表达量。这两个基因在肌肉组织中的表达量均较低。

图4 CsNLR-C6(A)和CsNLR-C7(B)在半滑舌鳎健康组织中的表达模式Fig.4 Expression profiling of CsNLR-C6(A)and CsNLR-C7(B)in normal tissues of Cynoglossus semilaevis
2.4 哈维氏弧菌侵染半滑舌鳎后CsNLR-C6和CsNLR-C7基因的表达分析
为了探究CsNLR-C6和CsNLR-C7基因对哈维氏弧菌感染的响应模式,以0 h为对照,分析了这两个基因在哈维氏弧菌感染12 h、24 h、48 h、72 h和96 h后鳃、肠、肾脏、脾脏和肝脏组织中的表达模式变化。结果如图5所示,CsNLR-C6和CsNLR-C7基因在不同组织中的表达模式并不完全一致。在肠和脾中,两个基因的表达量均在感染48 h后显著上调(P<0.05);在鳃和肾脏中,CsNLR-C6基因的表达量分别在感染48 h和感染12 h后显著上调(P<0.05),而CsNLR-C7基因的表达量均在感染12 h后显著下降(P<0.05)。而在这两个组织中,CsNLR-C7基因在感染24 h后呈现出不同趋势:在鳃中,CsNLR-C7基因表达量持续维持在相比0 h显著降低的水平上;而在肾脏中,CsNLR-C7基因表达量有所升高,并在感染48 h后较0 h提高(1.70±0.28)倍(P<0.05),之后又渐渐回落至正常水平。在肝脏中,CsNLR-C6基因的表达量在感染12 h后有所升高,但与0 h相比并无显著差异,之后一直维持在稳定水平上;而CsNLR-C7基因的表达量在感染48 h后显著升高(P<0.05)。

图5 半滑舌鳎CsNLR-C6和CsNLR-C7在哈维氏弧菌感染后鳃(A)、肠(B)、肾(C)、脾(D)、肝(E)的表达模式变化Fig.5 Expression profiling of CsNLR-C6 and CsNLR-C7 in gill(A),intestine(B),kidney(C),spleen(D),and liver(E)at different time after V.harveyi infection
3 讨论
胞内NOD样受体是炎症小体复合物的主要组成部分,主要作用为保护机体免受外来微生物病原的侵害[23]。本研究对半滑舌鳎中NOD样受体家族中的CsNLR-C6和CsNLR-C7进行了克隆和表达分析。通过功能域预测,这两个蛋白都含有NOD样受体家族保守的NACHT结构域,并含有4~5个包含配体结合位点的LRR结构域。CsNLR-C6与CsNLR-C7包含不同数量的LRR结构域,说明它们可能结合不同类型的病原体。此外,与其他NOD亚家族不同的是,CsNLR-C6和CsNLR-C7还具有C端的FISNA结构域和N端的B30.2结构域。FISNA结构域为鱼类特有的NACHT类子结构域,但其功能还不清楚[24]。三分模体包含蛋白和含热蛋白结构域分子中的B30.2结构域已被证实可与配体结合,从而调控先天免疫反应[25-26]。鮸中18个含B30.2结构域的NLR-C亚家族基因可识别病原体入侵,并在抗病毒免疫应答过程中起到重要作用[8]。因此,半滑舌鳎可能通过NLR-C的FISNA、NACHT、LRR和B30.2结构域的协同工作,识别病原体并启动相关的免疫信号通路。
在系统进化分析中,CsNLR-C6、CsNLR-C7与其他鱼类的NLR-C蛋白聚类。相比其他NOD亚家族,NLR-C与NOD3的进化关系较近,这与斑马鱼、红鳍东方鲀(Takifugu rubripes)NLR-C的进化分析结果一致[3,23],说明NLR-C与NOD3有最近的共同祖先(most recent common ancestor)。
NOD样受体家族基因广泛分布在哺乳动物和鱼类的各个组织中。作为NOD样受体家族成员,CsNLR-C6和CsNLR-C7在半滑舌鳎的各个组织中均有表达,但CsNLR-C6在鳃、肠、皮肤、脾中有较高表达,而CsNLR-C7在鳃、头肾、肝中有较高表达。鳃、肠、皮肤是黏膜相关淋巴组织,具有淋巴细胞、巨噬细胞等,是鱼体抵御病原微生物的有效防线[27]。头肾、脾脏、肝都是参与鱼类先天免疫的重要器官:头肾承担了造血和内分泌的功能;脾脏具有造血和免疫功能,在体液免疫和炎症反应中起到重要作用;肝帮助鱼体抵御外源异物侵害[28-29]。两个基因在这些组织高表达,表明了它们具有重要的免疫功能,但不同的组织表达模式说明CsNLR-C6和CsNLR-C7可能在半滑舌鳎免疫应答中起到不同的作用。大菱鲆的两个NLR-C基因在不同的组织中也表现出不同的表达水平,NLR-C3a在鳃和头肾中高表达,而NLR-C3b在血液、脾和头肾中表达量较高[9]。此外,NLR-C基因在不同鱼类中的组织表达模式不尽相同。牙鲆的NLR-C基因在肾、鳃和血液中高表达[7];鲤(Cyprinus carpio)的NLR-C基因在血液、脾和鳃中高表达[30];斑马鱼的NLR-C基因在肝、肠和脾中高表达[3]。这些研究结果表明,NLR-C基因表达在不同种属的鱼类中具有一定的组织特异性。
目前已有研究表明,鱼类NLR-C基因对细菌感染具有快速响应模式。在哈维氏弧菌感染的红鳍东方鲀头肾组织中,NLR-C10和NLR-C12的表达量分别在感染后4 h和12 h显著升高[23]。鳗弧菌感染鲤的肠、皮肤、肝、脾和头肾组织中,NLR-C基因的表达量在3~6 h内均有显著升高[30]。在鳗弧菌感染的鮸脾脏组织中,NLR-C39和NLR-C40的表达量呈现不同应答模式:NLRC39的表达量在感染后24 h显著降低,随后在48 h内恢复并显著升高;而NLR-C40的表达量则在感染后显著升高,在24 h达到峰值[8]。本研究检测了半滑舌鳎鳃、肠、肾、脾、肝组织中CsNLR-C6和CsNLR-C7在哈维氏弧菌感染后的表达量变化。结果表明,两个基因在不同组织中呈现出对哈维氏弧菌感染不同的响应模式。在肠和脾中,两个基因的表达量都在感染后48 h内显著升高,表明CsNLR-C6和CsNLR-C7都参与了半滑舌鳎抗哈维氏弧菌的免疫应答反应。在肾脏中,CsNLR-C6基因响应更快,在感染后12 h内其表达量就显著升高,并持续升高,在感染后24 h至96 h内一直保持在较高的水平,说明肾脏一直处于哈维氏弧菌感染的应答状态;在肝中,CsNLRC7则表现出更强烈的响应,其表达量在感染后48 h内显著升高。而在鳃中,两个基因的表达趋势相反,CsNLR-C6随着哈维氏弧菌侵染表达逐渐升高,而CsNLR-C7随哈维氏弧菌感染表达降低,并一直处于较低水平,说明两个基因对于鳃中免疫反应的应答模式不同。在哈维氏弧菌感染的半滑舌鳎肾脏中,CsNOD1、CsNOD2和CsNOD3、CsNOD4也呈现出相反的应答模式[16]。
本研究克隆了半滑舌鳎CsNLR-C6和CsNLRC7的ORF,分析其结构域和系统进化地位,并对其组织表达模式和感染哈维氏弧菌后在不同组织中的应答模式进行了检测,结果表明,CsNLRC6和CsNLR-C7基因均参与了半滑舌鳎抗哈维氏弧菌的免疫反应,这为今后鱼类特有的NLR-C基因家族在鱼类先天免疫反应中的作用机制研究提供了实验数据和理论基础。

