肿瘤免疫治疗研究进展
李龙,谢成英,郑明月,蒋华良①†
①上海科技大学 免疫化学研究所,上海 201210;②中国科学院上海药物研究所 药物发现与设计中心,上海201203;③中国科学院分子细胞科学卓越创新中心,上海 200031
肿瘤是威胁人类生命健康最重大的疾病之一。目前常用的肿瘤治疗方法主要包括手术、化疗、放疗和靶向疗法等,均取得了长足的进步,肿瘤患者的生存状况也得到极大的改善。很多肿瘤的初始临床治疗效果良好,但随着治疗时间的延长,肿瘤往往会产生耐药性,且容易复发,为临床治疗带来严峻挑战。肿瘤免疫治疗是最近十多年快速发展起来的新型疗法,主要作用靶标是机体的免疫系统而非肿瘤细胞,通过增强机体对肿瘤的自然免疫防御、重塑免疫微环境等方式清除肿瘤细胞[1]。这些疗法一方面通过训练免疫细胞识别和清除携带肿瘤抗原的靶细胞,增强免疫介导的肿瘤细胞裂解,另一方面消除或者降低肿瘤细胞诱导的免疫抑制性信号[2],从而达到肿瘤治疗的效果。肿瘤免疫疗法已有100多年的历史,经历里程碑式的发展,给肿瘤的治疗带来奇迹(图1)。2013年12月美国《科学》(Science)杂志将肿瘤免疫疗法评为年度十大科技突破之首[3]。2018年度诺贝尔生理学或医学奖颁给了肿瘤免疫治疗。在过去的10年,各种肿瘤免疫新疗法不断涌现并取得令人兴奋的临床效果,被学术界认为是继传统治疗、靶向治疗后,肿瘤治疗史上的第三次革命[4]。本文重点介绍各种临床常用的肿瘤免疫疗法,分析肿瘤免疫疗法的最新进展与发展制约因素,并对未来进行展望。
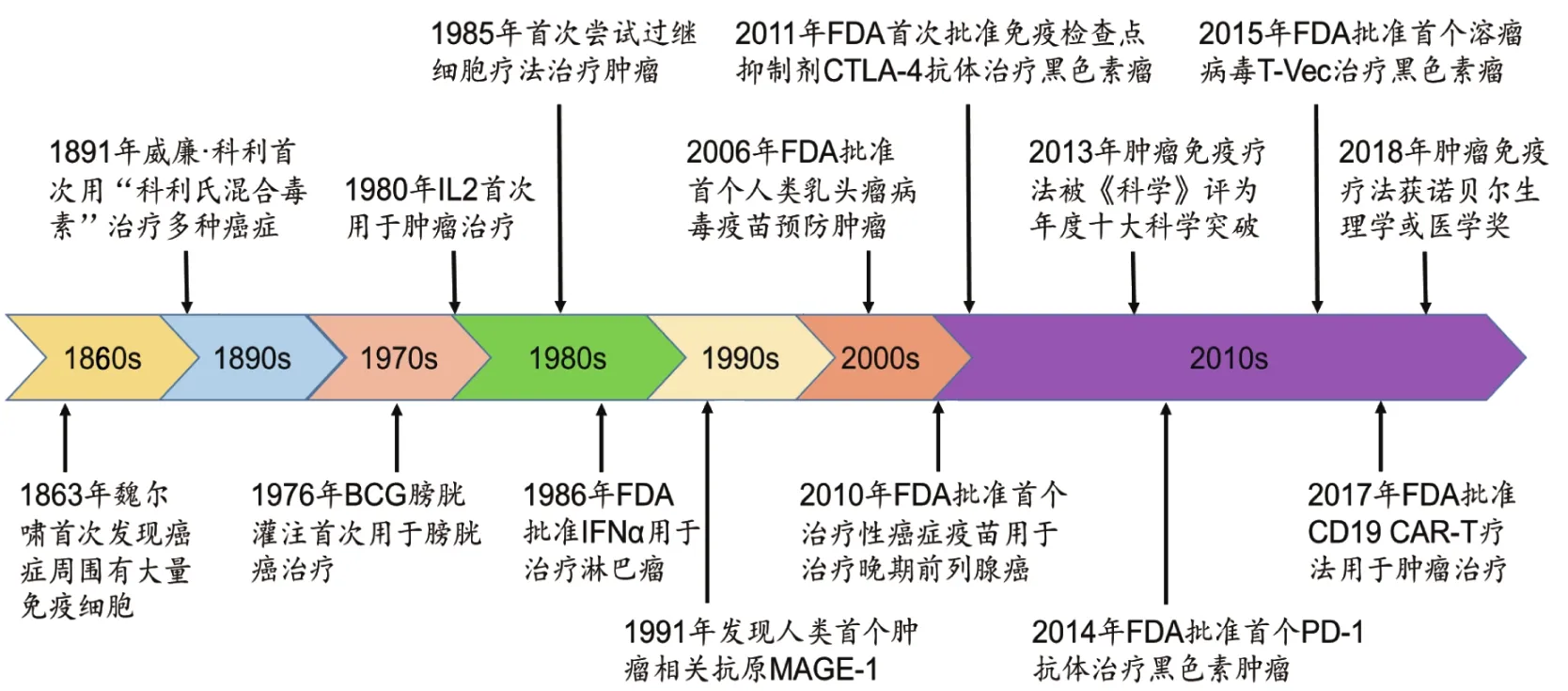
图1 肿瘤免疫疗法里程碑事件
1 肿瘤免疫微环境
机体的免疫系统具有免疫监视功能。当肿瘤细胞侵袭时,免疫系统可以根据它们表面所表达的肿瘤抗原识别并清除它们。然而,在某些情况下肿瘤细胞能够通过多种机制逃避机体的免疫监视,恶性增殖,形成肿瘤。
肿瘤微环境(tumor microenvironment, TME)是由肿瘤细胞、免疫细胞、肿瘤相关的成纤维细胞、细胞外基质、细胞因子,以及其他有助于肿瘤生长和发展的分子,如免疫检查点(immune checkpoints, IC)关键分子等,组成的复杂系统,它们包围和支持着肿瘤巢[5]。随着科学的发展,人们逐渐了解到TME的复杂性和多样性以及在免疫治疗中的重要作用。TME影响免疫疗法的效果,也是肿瘤免疫逃逸的重要原因之一。TME中含有各种类型的免疫细胞,如T细胞、NK细胞、巨噬细胞、树突状细胞(DC)和髓源性抑制细胞(MDSCs)等,还包含大量的细胞因子和趋化因子等。TME是一个动态变化的环境,其中的细胞、细胞因子和其他生物分子相互作用影响肿瘤的生长、侵袭和转移。TME中的细胞因子谱影响T细胞的浸润,有时甚至可以决定肿瘤治疗的成败。在这种缺乏必需氨基酸的低氧酸性TME中,浸润的T细胞会经历失能、衰老和耗竭的过程,难以达到理想的肿瘤杀伤效果。TME被称为肿瘤的第七大标记性特征,是宿主免疫系统和肿瘤之间的重要战场[5-7]。因此,通过靶向TME中的免疫细胞来调节肿瘤免疫也逐渐成为研究的重点。免疫检查点阻断疗法是近年来肿瘤免疫治疗最为突出的进展,在多种肿瘤的治疗中取得显著疗效。未来,新技术的发展及研究模式的创新,将进一步推动靶向TME的免疫治疗。
2 肿瘤免疫疗法进展
肿瘤免疫疗法经过一个多世纪的发展逐渐被人们认可接受,成为迄今为止最成功的肿瘤治疗策略之一。根据其发展顺序和作用机制的不同,肿瘤免疫疗法分为细菌免疫疗法、细胞因子疗法、单克隆抗体疗法、免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)疗法、过继细胞免疫疗法(adoptive cell therapy, ACT)、溶瘤病毒疗法(oncolytic virus therapy, OVT)和肿瘤疫苗疗法(图2)。目前临床研究和应用的主要是后几种疗法,本文对前两种不再介绍。
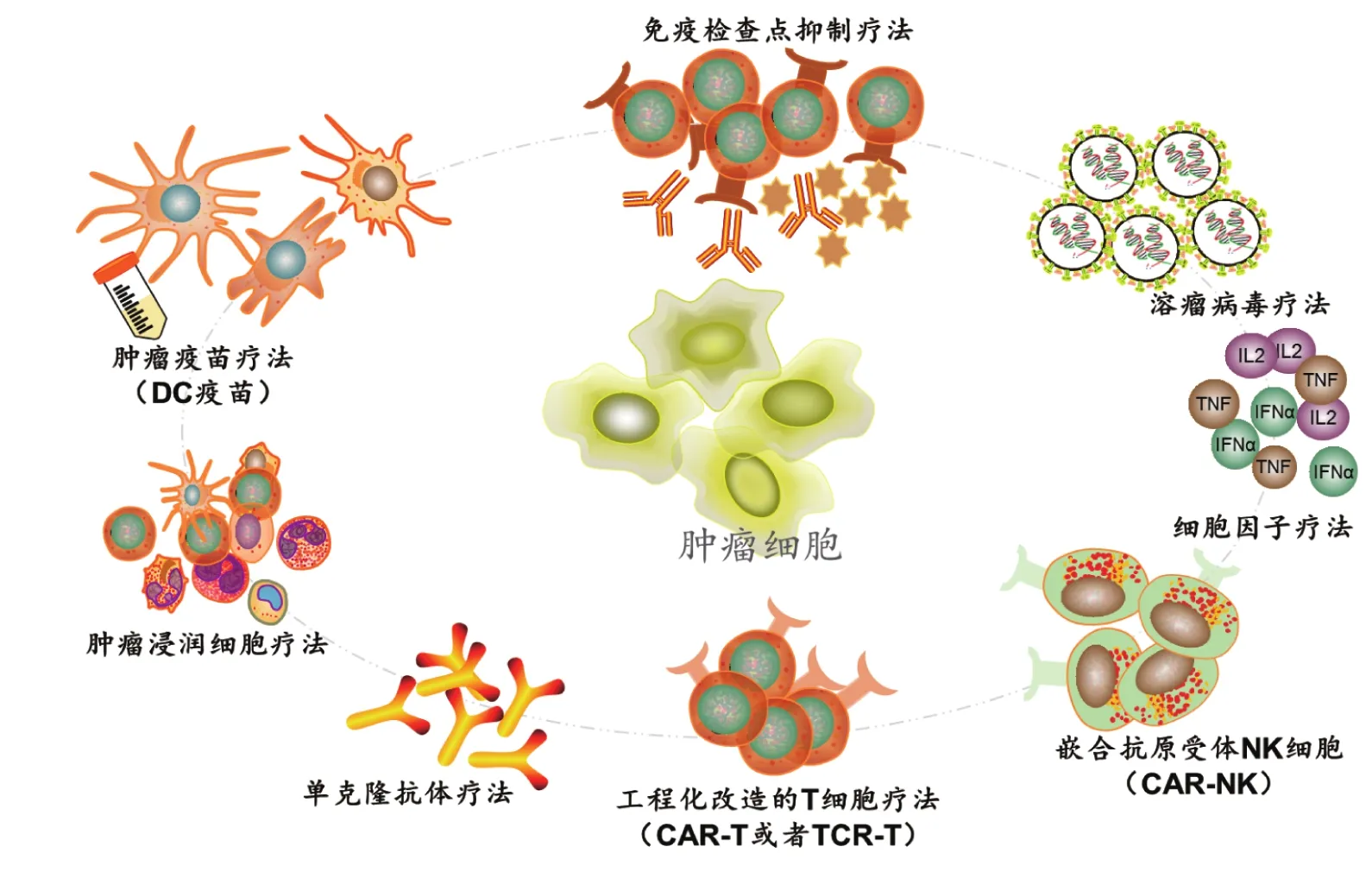
图2 目前临床研究的肿瘤免疫疗法
2.1 单克隆抗体免疫疗法
受益于免疫学和蛋白质工程的快速发展,单克隆抗体免疫疗法是目前发展最快的免疫疗法。单克隆抗体类药物可将T细胞招募到肿瘤部位,直接靶向肿瘤细胞,改变宿主对肿瘤的反应,从而起到抑制甚至消除肿瘤的作用[8]。
单克隆抗体包括结合肿瘤抗原的Fab端和结合免疫细胞表面受体的Fc端。在单抗的作用下,两种细胞结合后会通过补体介导的细胞毒和抗体依赖的细胞毒作用杀死肿瘤细胞[9-10]。此外,单克隆抗体如贝伐珠单抗(bevacizumab)通过抑制肿瘤细胞的氧气供应和营养物质的输送,抑制肿瘤血管生成,发挥抗肿瘤作用[11]。另一种基于单克隆抗体的疗法,即抗体药物偶联物,是通过特定的连接头与高细胞毒性药物偶联的靶向生物制剂,可以特异性结合肿瘤表面抗原,通过“自焚”机制释放药物杀死肿瘤细胞并激活免疫系统。目前已经有10款抗体药物偶联物被批准上市[12-14]。
目前FDA已经批准至少100种单克隆抗体产品[15],是肿瘤免疫治疗领域批准最多的产品类型。以双特异性抗体(bispecific antibody,bsAb)为代表的第二代单克隆抗体逐渐进入市场,如倍林妥莫双抗(blinatumomab)和艾美赛珠单抗(emicizumab)[16]。靶向EGFR/MET的双抗amivantamab最近也被批准上市,用于治疗EGFR外显子20插入突变的非小细胞肺癌。
2.2 免疫检查点抑制剂疗法
免疫检查点是机体免疫系统中的保护因子,可以防止T细胞过度激活而导致自身免疫性损伤。但是,肿瘤细胞可能会利用这些检查点,逃脱机体的免疫监视与杀伤,发生免疫逃逸。免疫检查点抑制剂通过阻断免疫检查点,可以有效恢复T细胞的功能[17-18]。
免疫检查点抑制剂是目前应用比较多的一种肿瘤免疫疗法。2011年FDA批准的首个免疫检查点抑制剂伊匹单抗(ipilimumab),即抗细胞毒性T淋巴细胞相关蛋白4(CTLA-4)的抗体,通过阻断CTLA-4的抑制性信号诱导活化CTL,用于晚期黑色素瘤的临床治疗。3年后,针对程序性细胞死亡受体1(PD-1)及其配体(PD-L1)的抗体帕姆单抗(pembrolizumab)和阿特珠单抗(tezolizumab)被FDA批准用于治疗多种类型的肿瘤,包括肺癌、膀胱癌和黑色素瘤等[17-19]。截至目前,中国批准上市的PD-1和PD-L1单抗产品多达8种。
此外,研究人员正在尝试开发一系列免疫检查点小分子抑制剂,目前尚处于临床前研究或者临床I期[20-21]。调控天然免疫的关键蛋白干扰素基因刺激因子(stimulator of interferon genes,STING)在T细胞介导的肿瘤免疫过程中起枢纽作用,发挥IFN依赖的抗肿瘤免疫[22]。目前有10余个STING激动剂正处于临床研究[23]。随着研究的深入,越来越多的免疫检查点被发现,如LAG3、TIGIT、TIM3、腺苷A2A和CD47等[19],针对这些新发现的免疫检查点的药物研发也在持续进行中。
2.3 过继细胞疗法
过继细胞疗法是一种被动免疫治疗方法。首先从肿瘤患者体内分离出免疫细胞,在体外经过基因工程化改造或者筛选激活,大量扩增后重新回输到患者体内,以达到清除肿瘤的目的(图3)。依据效应细胞是否有外源基因的表达,过继细胞疗法可以分为两类:一种需要基因工程化改造,例如通过基因修饰T细胞从而表达出嵌合抗原受体(CAR)或T细胞受体(TCR)的嵌合型抗原受体T细胞(CAR-T)和T细胞受体嵌合T细胞(TCR-T)疗法,以及在NK细胞膜表面表达CAR的CAR-NK疗法等;另外一种是从患者的外周血或者肿瘤原位分离筛选出免疫细胞,体外扩增活化后回输到患者体内进行抗肿瘤治疗,包括肿瘤浸润免疫细胞(TILs)疗法、细胞因子诱导的杀伤(CIK)细胞疗法、淋巴因子激活的杀伤(LAK)细胞疗法、自然杀伤(NK)细胞疗法等。随着抗原筛选技术和高通量测序方法的发展,以及肿瘤免疫学、生物信息学和化学生物学等多学科交叉融合,未来会有越来越多的治疗性细胞产品应用于临床抗肿瘤治疗[24]。
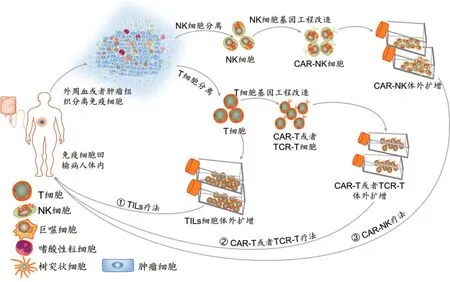
图3 过继细胞免疫疗法流程图
2.3.1 CAR-T疗法
CAR-T细胞疗法作为一种“活性药物”清除肿瘤,可以规避组织相容性复合体(MHC)的限制性,其利用患者自身的免疫细胞治疗对其他疗法产生抗性的恶性肿瘤[25]。CAR本质上是一种膜蛋白,是由不同蛋白功能结构域串联形成的重组受体,具有灵活性和特异性识别抗原的特点。以目前商业化的CAR为例,功能结构域包括识别并结合肿瘤相关抗原(TAA)的单链抗体区(scFv)、铰链区、跨膜域、共刺激域(CD28或4-1BB)和细胞内T细胞活化结构域。scFv结合TAA后胞内信号结构域可以激活T细胞,共刺激分子则可以维持T细胞的增殖[26-27]。
2012年靶向CD19的CAR-T细胞被注射到患者Emily体内用于治疗急性淋巴性白血病,使其保持无瘤生存至今。对接受CAR-T细胞疗法的弥散性大B细胞淋巴瘤患者进行长达5年的临床疗效随访,数据显示该疗法显著延长了患者的生存期[28]。全球已有500多项基于CAR-T细胞疗法的临床试验,尤其在2017年FDA批准两款CD19 CAR-T疗法上市,使CAR-T疗法在临床应用的道路上迈进了一大步[29]。截至2021年6月,FDA已经批准的CAR-T产品有5项,集中于血液瘤的治疗(表1)。
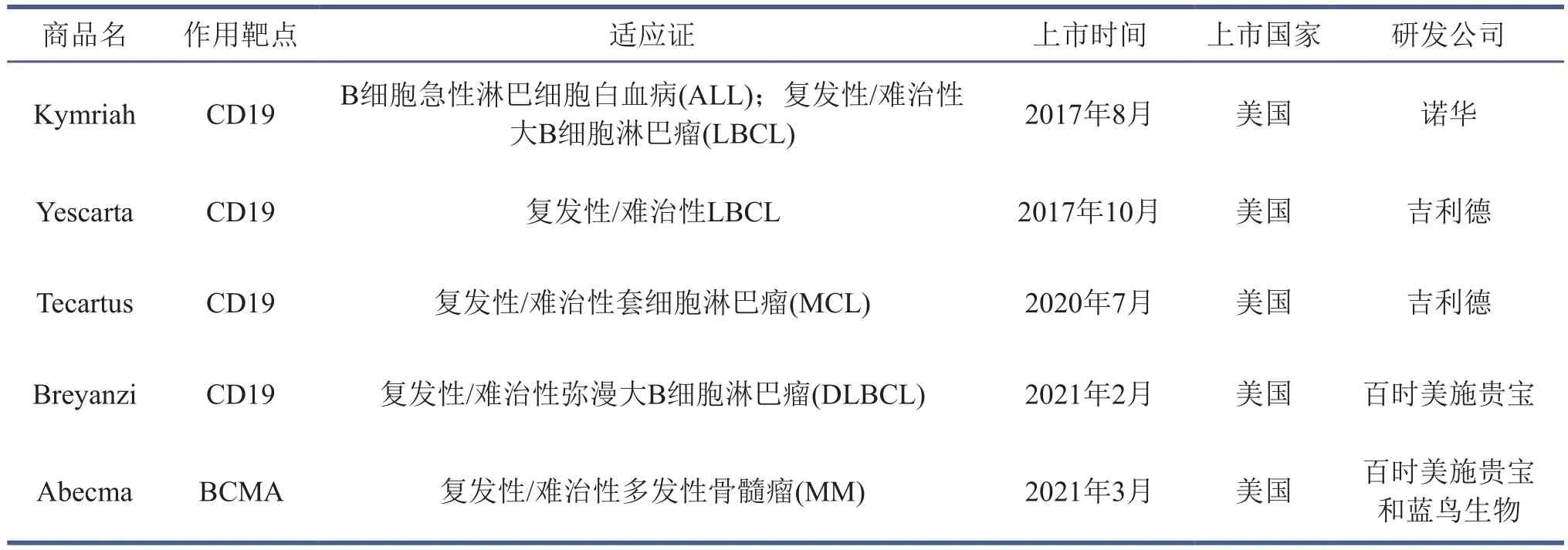
表1 FDA批准上市的CAR-T产品(数据截至2021年6月)
目前正在尝试的双靶点CAR-T细胞疗法可以规避CAR-T脱靶问题,也可能具有更好的成药性。双靶点CAR可以独立识别目标抗原,同时识别TAA后能使T细胞完全活化。CD19/CD22双靶点CAR-T是第一种双靶点CAR-T,联合单抗的临床研究结果显示出令人鼓舞的抗肿瘤活性[30]。通用型CAR-T疗法也是目前重点研究的方向。研究者基于CD19/CD22双靶点CAR-T设计出的通用型CAR-T细胞产品如CTA101,为复发性/难治性急性淋巴细胞白血病患者提供了一种新的治疗方案[31]。
2.3.2 CAR-NK疗法
人的外周血淋巴细胞中大约5%~15%是NK细胞,是机体重要的免疫细胞。CAR-NK疗法是基于基因工程改造NK细胞的过继细胞疗法[32]。CARNK通过CAR靶向肿瘤细胞后激活NK细胞释放穿孔素和颗粒酶等裂解肿瘤细胞,也可以发挥非依赖CAR的NK细胞功能,例如通过CD16介导的ADCC清除肿瘤细胞等[33]。CAR-NK在血液肿瘤中具有很好的临床疗效,实体瘤的研究尚在进行中[32]。CARNK的制备细胞来源广泛,如外周血中分离NK细胞、NK细胞系和脐带血NK细胞等。研究表明,CAR-NK细胞疗法能规避CAR-T的许多缺点,如细胞因子释放综合征、与免疫效应细胞相关的神经毒性综合征、可及性差等[34]。目前为止,CAR-NK尚处于临床前或者临床研究阶段,尚无产品批准上市。CAR-NK疗法被认为是下一代基于CAR平台的最有希望的细胞疗法[35-36]。
2.3.3 TCR-T疗法
TCR-T通过将特异性识别肿瘤抗原的外源性TCR基因转导到T细胞中,可以发挥出MHC依赖性的抗肿瘤作用。基因工程设计的TCR由α链和β链组成,每个链均包含可变域、恒定域和跨膜结构域,可以通过非共价键的方式结合CD3链表达在T细胞的细胞膜上,识别肿瘤细胞内的抗原并经过加工提呈后形成MHC I-抗原肽复合物从而激活T细胞,后者能特异性杀伤肿瘤细胞[37]。
TCR-T细胞疗法的关键是特异性识别靶细胞,因此选择合适的肿瘤特异性抗原是最为关键的步骤。目前已有30多项关于TCR-T的临床项目正在进行。TCR-T在治疗实体瘤方面显示出良好的效果,引起了越来越多的研究兴趣。针对新抗原介导的TCR-T疗法也展示出令人鼓舞的效果[38]。
2.3.4 TILs疗法
TILs是一群离开血管系统、定位于肿瘤间质或上皮内且能对TAA具有特异性反应的免疫细胞,能够分泌效应细胞样的细胞因子,回输后能准确迁移到肿瘤部位,在抗肿瘤中发挥积极的作用。TILs疗法主要利用肿瘤浸润T淋巴细胞,经过体外IL2刺激大量扩增后回输到患者体内发挥抗瘤作用。
黑色素瘤患者采用TILs疗法取得了卓越的临床疗效[39]。最新的临床数据(2020ASCO)显示,接受过靶向和免疫治疗后进展的极晚期黑色素瘤患者在接受TILs治疗后,疾病控制率高达80.3%,客观缓解率达到36.4%。更引人注目的是,对免疫检查点抑制剂无效的患者仍能获益于TILs疗法。TILs疗法是一款适用于多种实体瘤的免疫疗法,目前针对各类实体肿瘤的TILs疗法的临床试验正在进行中,在结直肠癌、肺癌和乳腺癌等恶性肿瘤治疗中显示出巨大的潜力[40]。已有的各项研究表明,随着不断改进和发展,TILs疗法最终将成为人类抗癌的新武器。
2.4 溶瘤病毒疗法
溶瘤病毒(OVs)是自然界存在或基因工程改造的病毒,可选择性地在肿瘤细胞中复制进而引起肿瘤细胞裂解,激活免疫系统。与病毒作为转基因传递载体的基因疗法不同,OVs本身可以作为活性药物起作用[41]。目前临床试验的OVs大多是基因工程病毒,大部分属于DNA病毒如疱疹病毒科和腺病毒科[42],小部分是RNA病毒。溶瘤病毒介导抗肿瘤活性主要通过以下方式:选择性地在肿瘤细胞内复制,导致肿瘤裂解;裂解释放的肿瘤相关抗原激活机体的免疫反应,从而清除肿瘤细胞;病毒感染也会使肿瘤细胞释放出细胞因子,进而清除转移性肿瘤[41,43-44]。
目前已批准上市的OVs包括第一代溶瘤病毒H101和第二代溶瘤病毒T-VEC。H101是基于腺病毒改造而成的,2005年被批准上市,是目前中国首个治疗头颈部肿瘤的溶瘤病毒[45]。2015年利用双突变单纯疱疹病毒1(HSV-1)改造而来的T-VEC成为首个被FDA批准用于治疗黑色素瘤的溶瘤病毒[41,46]。OVs疗法已经发展到第三代,通过将病毒部分基因替换为抑癌基因,在提高OVs肿瘤靶向性的同时可促进特异性免疫反应的建立。基因修饰能够增强OVs溶瘤能力,例如利用人端粒酶逆转录酶启动子调控的溶瘤病毒疗法可增强对胃癌的细胞毒性作用[47]。未来可以结合肿瘤二代测序和新抗原表位预测等新的技术方法改造OVs,提高其抗肿瘤疗效。
2.5 治疗性肿瘤疫苗
治疗性肿瘤疫苗疗法属于主动免疫疗法。与普通预防性疫苗不同的是,恶性肿瘤患者注射治疗性肿瘤疫苗会诱导或增强体内预存的靶向肿瘤抗原的体液免疫和细胞免疫,杀死肿瘤细胞同时形成长期免疫记忆,一定程度上可以防止肿瘤复发。2010年FDA批准了针对抵抗性前列腺癌的治疗性肿瘤疫苗Provenge,这是首个树突状细胞疫苗[48]。治疗性肿瘤疫苗包括多种类型,如肿瘤细胞疫苗、长肽疫苗、基因疫苗等[49-50]。
近年来测序技术的快速发展为肿瘤新抗原疫苗和个性化肿瘤疫苗的发展提供了技术支撑,如全基因组测序和全外显子测序等技术促进肿瘤相关基因被识别、鉴定。目前肿瘤疫苗疗法有几千项的临床试验,主要应用于黑色素瘤、乳腺癌和肺癌等恶性肿瘤的治疗[50]。通过优化抗原靶点、添加免疫调节类佐剂、选择合适的疫苗形式及联合其他免疫疗法等手段提高抗肿瘤细胞免疫应答是未来肿瘤疫苗的发展方向[51]。最近提出的个体化疫苗,即根据患者本身的HLA-A类型及其预先存在的免疫记忆选择合适的肽疫苗,从而产生更快、更强的免疫应答反应,达到个体化治疗的目标[52]。
3 免疫疗法的挑战
经过上百年艰难探索,肿瘤免疫疗法改变了多发性实体瘤和血液恶性肿瘤的治疗格局,为肿瘤患者尤其是晚期恶性肿瘤患者以及多药耐药的肿瘤患者带来福音。然而,肿瘤免疫疗法还面临着诸多难题,如免疫应答仅发生在相对小部分肿瘤患者身上,缺乏有效且可靠的疗效预测标志物是实现精准个体化免疫治疗所面临的最大挑战之一。无论单克隆抗体免疫疗法,还是CAR-T、CAR-NK和TCR-T疗法,都需要合适的肿瘤靶点。肿瘤抗原也会被多糖封闭,导致很难被加工提呈,从而无法被免疫系统识别[53]。因此,选择合适的肿瘤特异性抗原并提高其免疫原性,成为免疫疗法需要解决的关键问题之一。由于免疫疗法的类型与作用机制不同,肿瘤免疫疗法具有独特的毒性特征[54]。例如,ICIs引发的器官特异性损伤就因人而异,可能的因素涉及某些未知的遗传背景。一些患者治疗几个月都不会出现不良事件,而另一些患者在一次输液后立即出现危及生命的不良反应[55-56]。此外,肿瘤免疫治疗有自己的一些特点,例如假性进展、延迟反应。因此,在评价免疫治疗效果的时候不能简单套用化疗药物治疗肿瘤的标准。2020年Hegde等[57]详细分析了肿瘤免疫疗法存在的十大挑战,这些都是肿瘤免疫疗法需要解决的问题,也是未来重要的研究方向。
4 总结和展望
随着新技术、新方法的不断涌现与革新,学科交叉融合日益紧密,肿瘤免疫疗法迎来飞速的发展,表现出治愈肿瘤的巨大潜力,也让晚期恶性肿瘤患者有了新的选择。但是,由于肿瘤的异质性和个体免疫环境的差异,免疫疗法并不能在所有个体、所有肿瘤上表现出良好的治疗效果,不良反应事件也不尽相同。选择特异性的靶点、筛选适合的肿瘤患者、多种疗法联合应用都可以部分解决目前肿瘤免疫疗法面临的问题。未来,肿瘤免疫学、计算机科学、生物信息学等学科的发展以及多学科之间的交叉融合将进一步共同推动肿瘤免疫治疗的发展。基于新理论、新技术和新方法设计开发的肿瘤免疫疗法将能安全有效地增强免疫系统,进而消灭肿瘤细胞,最终实现毒性有限的持久性治愈的目标。

