基于LC-MS/MS分析不同蛋白酶酶解奶牛胎盘产物差异及其抗氧化活性预测
张 钺 尤留超 朱颍琨 莘 余 吕尚揆 裴淼毓 傅宏庆 沈留红*
(1.四川农业大学 动物医学院/动物疫病与人类健康四川省重点实验室/奶牛疾病研究中心,成都 611130;2.江苏农牧科技职业学院,江苏 泰州 225300)
奶牛胎盘是奶牛养殖中的副产物,未得到有效利用,且处理不当易造成环境污染和生物安全风险。而胎盘含大量肽类、多糖类、激素、脂质和矿物质等生物活性物质[1],多肽类物质可能是其主要活性成分,具有促免疫、抗氧化、促进组织恢复和抗肿瘤等作用[2-4]。因此,从奶牛胎盘中提取活性多肽成分有利于新型肽类药物开发,进而促进奶牛胎盘合理利用,减少因胎盘丢弃造成环境污染。
目前从动植物成分中制备活性多肽的方法主要有直接分离法、超声波破碎法和酶解法等。直接分离法要求严格、成本高,常用于确定的单个或几个多肽研究[5],无法对大量多肽样本进行筛选;超声破碎法操作简便、省时省力、提取率高[6],但其主要提取胎盘组织中可溶性蛋白和多肽,无法提取组织中不溶性蛋白,而胎盘不溶性蛋白质亦可产生具有生物活性的多肽;而酶解法是制备成分种类单一、作用方式较为确定的胎盘生物活性多肽有效方法,具有条件温和、过程可控、成本较低等优点[7],能够将不溶性蛋白酶解为小和分子量易于吸收的多肽,更利于对其活性成分研究。目前酶解动植物组织制备多肽的酶有胰蛋白酶、胃蛋白酶和木瓜蛋白酶等[8],不同蛋白酶酶解产物生物活性存在差异[9]。常采用1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-trinitrophenylhydrazine,DPPH)法、普鲁士蓝法和菲啰嗪法等测定多肽抗氧化活性,但上述方法与生物体内活性氧产生和猝灭并无直接关联,因此生物相关性低,只能评估体外抗氧化活性,不能进一步分析抗氧化活性多肽序列。而液相色谱-串联质谱(Liquid chromatography-tandem mass spectrometry,LC-MS/M)被广泛用于功能性蛋白和多肽研究,如检测红酒中致敏蛋白[10]、大麦麦芽评估[11]及鱼类鉴定[12]等,可从原料中鉴定和分析大量蛋白及多肽序列,利用生物信息学数据库进一步研究多肽序列[13]。此外,LC-MS/MS技术识别的肽段数量,可决定蛋白质组学敏感性和特异性[14]。目前尚未见奶牛胎盘抗氧化活性多肽序列及其制备抗氧化活性多肽蛋白酶选择的相关研究。
因此,本研究旨在胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解奶牛胎盘获得具有最优还原活性和提取率多肽的基础上[15-16],利用LC-MS/M技术对酶解产物定性和定量分析,探究奶牛胎盘各种酶酶解产物间差异及对蛋白组学影响,并通过BIOPEP数据库(http:∥www.uwm.edu.pl/biochemia/biopep/start_biopep.php)预测不同酶解产物抗氧化活性,发掘具有潜在抗氧化活性多肽,为奶牛胎盘蛋白组学研究对酶的选择和奶牛胎盘抗氧化活性多肽的开发利用提供理论依据。
1 材料与方法
1.1 试验材料
选择某规模化奶牛场半封闭统一舍饲、2~4胎、体况良好、妊娠足月、自然分娩脱落的健康中国荷斯坦奶牛新鲜胎盘组织,其自然脱落后立即用生理盐水清洗,除去胎盘内残留血液及污物,至胎盘子叶呈粉红色后,于-20 ℃冷冻保存。
1.2 主要试剂和仪器
胰蛋白酶(Trypsin,250 U/mg,批号920T041),胃蛋白酶(Pepsin,250 U/mg,批号810H021),木瓜蛋白酶(Papain,800 U/mg,批号621G025),北京索莱宝科技有限公司生物;0.1%甲酸水溶液、0.1%甲酸乙腈水溶液(乙腈84%)、自配。上样柱(Thermo Scientific Acclaim PepMap100,100 μm×2 cm,nanoViper C18),分析柱(Thermo scientific EASY column,10 cm,ID 75 μm,3 μm,C18-A2),LYOQUEST 冷冻干燥机(阿自倍尔泰事达);SorvallTMLegendTMXT冷冻离心机(Thermo scientific)。
1.3 试验方法
1.3.1样品制备和分组
参照胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解奶牛胎盘制备酶解产物最优条件[15-16]:胰蛋白酶、木瓜蛋白酶和胃蛋白酶的反应时间分别为5.80、4.70和5.49 h,底物体积分数分别为34.96%、34.03%和35.74%,酶底比分别为3.33%、3.66%和3.92%,每种蛋白酶重复3次,分别记为胰蛋白酶组(Trypsin)、胃蛋白酶组(Pepsin)和木瓜蛋白酶组(Papain)。
1.3.2LC-MS/MS分析
采用纳升流速的HPLC液相系统Easy nLC进行样品分离。缓冲液A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱以95%的A液平衡,样品由自动进样器进入上样柱,经过分析柱分离,流速为300 nL/min。
样品经色谱分离后用Q-Exactive质谱仪进行质谱分析。检测方式为正离子,母离子扫描范围300~1 800 m/z,一级质谱分辨率70 000 at 200 m/z,AGC target为1e6,Maximum IT为50 ms,动态排除时间为60 s。多肽和多肽碎片质量电荷比按下列方法采集:每次全扫描后采集20个碎片图谱(MS2 scan),MS2 Activation Type为HCD,Isolation window为2 m/z,二级质谱分辨率17 500 at 200 m/z,Normalized Collision Energy为30 eV,Underfill为0.1%。
1.3.3蛋白质和肽段鉴定及定量分析
将质谱分析原始数据导入Max Quant软件,基于Uniprot_Bos_taurus数据库(https:∥www.uniprot.org)进行蛋白质和肽段鉴定及定量分析。部分相关参数设定:裂解酶,Trypsin/Papain/Pepsin;允许的最大漏切位点数,2;可信肽段的筛选标准(Peptide false discovery rate,Peptide FDR),≤0.01;一级离子质量容差,6 ppm;二级离子质量容差,20 ppm;固定修饰,脲甲基化;可变修饰,氧化。
1.4 数据处理
采用SPSS 26.0软件进行数据分析,单因素方差分析和邓肯多极差检验组间差异,P<0.01为差异极显著,P<0.05为差异显著。使用GraphPad Prism 8.0绘图。
2 结果与分析
2.1 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物质谱及蛋白鉴定分析
质谱分析显示胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物鉴定多肽的峰值均出现在质荷比(m/z)400以下,且波形相似,最大峰值在303~305 m/z,表明此质谱分析准确和生物学重复均一。
胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物蛋白鉴定结果见图1,去除重复后,三组蛋白酶分别鉴定出541、136和86个蛋白。胰蛋白酶酶解产物鉴定蛋白数极显著高于其余2种酶(P<0.01),胃蛋白酶显著高于木瓜蛋白酶(P<0.05)。

**P<0.01表示差异极显著,*P<0.05表示差异显著。下同。**P<0.01 indicates extremely significant differences,*P<0.05 indicates significant difference. The same below.图1 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物鉴定蛋白数量Fig.1 Numbers of identified proteins in trypsin, pepsin and papain hydrolysates
胰蛋白酶酶解产物鉴定蛋白中330种蛋白(61.11%)的分子量在10~60 ku,85种蛋白(15.74%)分子量超过100 ku(图2(a));大多数蛋白(471个,87.22%)由从1~10个多肽鉴定出,平均值为5.98个多肽(图2(b));序列覆盖率大于25%的蛋白有103个(19.07%),247个(45.74%)大于10%(图2(c))。胃蛋白酶酶解产物分子量在10~60 ku的蛋白共92种(67.65%),27种蛋白(21.26%)分子量超过100 ku(21.26%)(图2(d));92个蛋白67.65%)由从1~10个多肽鉴定出,平均值为14.46个多肽(图2(e));序列覆盖率大于25%的蛋白有45个(32.85%),86个(62.77%)大于10%(图2(f))。木瓜蛋白酶酶解产物蛋白质的相对分子量、肽段数量、和序列覆盖分布见图2:48种蛋白(55.81%)分子量在10~60 ku,15种蛋白(17.44%)分子量超过100 ku(图2(g));74个蛋白(86.05%)由从1~10个多肽鉴定出,平均值为 8.88 个多肽(图2(h));序列覆盖率大于25%的蛋白有17个(19.77%),36个(41.86%)大于10%(图2(i))。

(a)~(c)胰蛋白酶;(d)~(f)胃蛋白酶;(g)~(i)木瓜蛋白酶(a)-(c) Trypsin; (d)-(f) Pepsin; (g)-(i) Papain图2 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解蛋白的相对分子量、肽段组成和蛋白片段覆盖率Fig.2 Molecular weight, peptide counts and protein sequence coverage of identified proteins in trypsin, pepsin and papain hydrolysates
2.2 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物肽段鉴定及分析
胰蛋白酶,胃蛋白酶和木瓜蛋白酶酶解产物蛋白鉴定结果见图3,去除重复共鉴定出2 766、1 170和128个肽段。胰蛋白酶鉴定肽段数极显著高于其余2种酶(P<0.01),胃蛋白显著高于木瓜蛋白酶(P<0.05)。

图3 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物鉴定肽段数Fig.3 Numbers of identified peptides in trypsin, pepsin and papain hydrolysates
胰蛋白酶酶解产物2 463种(89.05%)肽段相对分子量小于3 000 u,257种肽段相对分子量小于1 000 u(图4(a)),其中255种长度在十肽及以下;肽段长度在十肽及以下有654种(图4(d))。胃蛋白酶酶解产物所有肽段对分子量均在3 000 u以下,106种肽段相对分子量小于1000 u(图4(b)),其中95种长度在十肽及以下;肽段长度在十肽及以下有247种(图4(e))。木瓜蛋白酶酶解产物所有肽段对分子量均在3 000 u以下,相对分子量小于1 000 u 有10种(图4(c)),且其长度均在十肽及以下;有30种肽段长度在十肽及以下(图4(f))。
2.3 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物鉴定肽段的抗氧化活性预测
胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物鉴定肽段利用BIO-PEP数据库进行匹配,未发现数据库内含的抗氧化活性多肽。相对分子质量小于3 000 u 的肽段具有较强抗氧化作用[17],而小于1 000 u 的抗氧化多肽往往活性最强[18],胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物鉴定多肽相对分子质量小于1 000 u分别有257种、106种和10种,而这些肽段绝大部分(255种、95种、10种)长度小于或等于10个多肽,因此,使用BIO-PEP数据库可对十肽及以下多肽进行抗氧化活性预测。
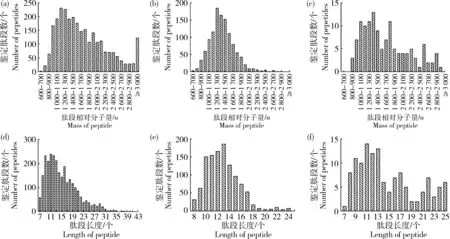
(a)(d)胰蛋白酶;(b)(e)胃蛋白酶;(c)(f)木瓜蛋白酶(a)(d) Trypsin; (b)(e) Pepsin; (c) (f)Papain图4 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物鉴定肽段的相对分子质量((a)~(c))和肽段长度((d)~(f))Fig.4 Mass of peptide and length of peptide of identified peptides in trypsin, pepsin and papain hydrolysates
胰蛋白酶酶解产物共有16种七肽,57种八肽,82种九肽和101种十肽具有潜在抗氧化活性,共256种,占十肽及以下肽段(654种)的39.14%(图5)。其共同特征为:具有谷氨酸-亮氨酸(Glutamic-Leucine,EL)、亮氨酸-酪氨酸(Leucine-Tyrosine,LY)、甲硫氨酸-甲硫氨酸(Methionine-Methionine,MM)、亮氨酸-赖氨酸(Leucine-Lysine,LK)、异亮氨酸-精氨酸(Isoleucine-Arginine,IR)、甲硫氨酸-酪氨酸(Methionine-Tyrosine,MY)或缬氨酸-酪氨酸(Valine-Tyrosine,VY)残基等结构。胃蛋白酶酶解产物共有8种八肽,15种九肽和58种十肽具有潜在抗氧化活性,共81种,占十肽及以下肽段(247种)的32.80%(图5)。其共同特征为:具有组氨酸-亮氨酸(Histidine-Leucine,HL)、LK、苏氨酸-酪氨酸(Threonine-Tyrosine,TY)、组氨酸-组氨酸(Histidine- Histidine,HH)或EL残基等结构。木瓜蛋白酶酶解产物共有6种八肽,4种九肽和6种十肽具有潜在抗氧化活性,共16种,占十肽及以下肽段(30种)的53.33%(图5)。其共同特征为:具有LK、IR或EL等结构。

“十肽”表示肽段长度为10个氨基酸且具有抗氧化活性的多肽,纵坐标表示“十肽”及以下肽段比例,以此类推。“Decapeptide” refers to a peptide with length of 10 amino acids and antioxidant activity. Y axis indicates the proportion of “ten decapeptide” and below, and so on.图5 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物十肽及以下肽段抗氧化活性预测Fig.5 Antioxidant activity prediction of decapeptides and below in trypsin, pepsin and papain hydrolysates
3 讨 论
3.1 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物中蛋白和肽段差异分析
获得多肽水平上的信息在蛋白组学中需追溯到原始蛋白质,单一蛋白质时比较容易,但在蛋白组成复杂时会变得困难。有研究指出,因分析中肽段太短或太长而丢失,不同蛋白质共有肽段的出现阻碍了蛋白质推断,导致一组蛋白质的鉴定,而不是单一蛋白质的鉴定[23],因而会阻碍蛋白的鉴定和定量。而工作酶(即消化蛋白所用水解酶)不同是造成肽段信息不同的主要原因之一,也是影响蛋白组学结果重要因素。胰蛋白酶是目前蛋白组学研究中最常用工作酶之一,具有高度特异性,酶解位点为碱性氨基酸精氨酸和赖氨酸-COOH端[24],但缺乏精氨酸和赖氨酸残基的蛋白不能被胰蛋白酶水解,此外其最适pH接近中性,部分蛋白在此pH下溶解度小,也不能被水解。因此,胰蛋白酶存在一定局限性。胃蛋白酶特异性水解位点可以是芳香族氨基酸,也可是其他疏水性氨基酸NH2端和COOH端[25],特异性不高,但其在酸性环境中活性最强,而部分蛋白在酸性环境的溶解度较大,利于胃蛋白酶消化。木瓜蛋白酶具有广泛特异性,广泛应用于活性多肽制备[26],酶解位点为赖氨酸、精氨酸和甘氨酸NH2端和COOH端。上述3种蛋白酶不同特点造成酶解产物间差异。Zhang等[27]使用胰蛋白酶酶解对虾获得575种蛋白和2 677个肽段;Wen等[28]对比单独使用胃蛋白酶或胃蛋白酶后分析发现,使用胰蛋白酶对猪肉、牛肉、鸡肉和鱼肉匀浆酶解产物差异,发现经胃蛋白酶酶解后从猪肉、牛肉、鸡肉和鱼肉分别鉴定出101、140、175和32种多肽,经胃蛋白酶和胰蛋白酶酶解后分别鉴定出72、59、92和28种多肽,表明经胰蛋白酶进一步消化后各物种酶解产物蛋白数量差异不显著,胃蛋白酶对肉类的酶解能力较强。Ha等[29]使用木瓜蛋白酶从脱脂奶粉中提取分离出308个多肽,其中56个具有潜在抗氧化活性,结果表明木瓜蛋白酶可应用于抗氧化活性多肽研究。Jung等[30]认为胰蛋白酶和胃蛋白酶对猪胎盘具有良好水解效率,而牛胎盘酶解产物研究相关信息较少。
本研究使用胰蛋白酶、胃蛋白酶和木瓜蛋白酶研究奶牛胎盘酶解产物差异,获取相关信息,鉴定蛋白中独特多肽数量胰蛋白酶最多,胃蛋白酶次之,木瓜蛋白酶最少,结果表明胰蛋白酶是鉴定蛋白最可靠的蛋白酶。且胰蛋白酶酶解产物鉴定肽段中81.52% 相对分子量在1 000~3 000 u,83.84%长度在20个氨基酸以内,大部分肽段能与蛋白准确对应,胃蛋白酶和木瓜蛋白酶鉴定肽段均在3 000 u以内,分别有97.35%和80.47%长度在20个氨基酸内,均符合蛋白组学鉴定要求。蛋白质检测的可靠性随蛋白质组中独特多肽数量增加而提高[31],然而,鉴定蛋白覆盖率越广则检测准确率越高[31],本研究中胰蛋白酶和木瓜蛋白酶鉴定蛋白覆盖率要明显优于木瓜蛋白酶,且木瓜蛋白酶鉴定蛋白质量分布较差,在140~200 ku间存在缺失,说明木瓜蛋白酶用于蛋白质组学准确率较差。可能原因是木瓜蛋白酶特异性低,酶切位点广泛,酶解胎盘所获肽段长度小于5个氨基酸,而5个氨基酸以下组成的多肽分子量高和电荷高,LC-MS/MS质谱技术检出率极低[32],但肽段长度较短的多肽往往活性较高,因此木瓜蛋白酶可用于研究小分子活性多肽。
3.2 胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物抗氧化活性差异分析
肽的抗氧化活性与序列中氨基酸组成、排列顺序、分子量大小、肽键及肽的空间结构有关[33]。通常认为具有供氢或供电子能力的氨基酸残基(如Tyr、Trp、Cys、Met和His等)具有清除自由基的能力[27,34],疏水性氨基酸残基可增强肽抑制脂质过氧化能力[35],而酸性和碱性氨基酸残基具有螯合金属离子的能力[36]。此外,Gly和Pro等氨基酸也对肽的抗氧化活性具有一定作用。而天然抗氧化活性多肽生物学作用较多且来源广泛,但从奶牛胎盘中提取抗氧化活性多肽鲜见报道。本研究通过BIO-PEP数据库匹配和测算,分析了不同蛋白酶酶解奶牛胎盘产物的抗氧化活性:胰蛋白酶组中GVVGPQGAR强度最高,由牛和小鼠胶原蛋白α-2(I)链的P02465蛋白水解产生,与猪胶原蛋白酶解物具有较高相似性,其QGAR残基使其产生抗氧化活性[18];NDEELNK强度次高,由构成组蛋白H2A的F2Z4 J1蛋白水解产生,其中EL残基为其抗氧化活性来源[19];强度第三位的GPSGPQGIR同样来源于P02465蛋白,其IR使其可能具有抗氧化活性[20]。胃蛋白酶酶解产物中YYAPFDGILG强度最高,来源于组成牛胃蛋白酶A的A0A3Q1LZC9蛋白,其YYA残基为抗氧化活性来源[21];EKIWHHSF强度次高,来源于组成肌动蛋白的G8 JKX4蛋白,其WHH残基为抗氧化活性来源;强度第三位的PARHQTHGSL由组成硫酸乙酰肝素蛋白聚糖2的F1MER7蛋白水解产生,其RHQ残基使其具有抗氧化活性[19]。木瓜蛋白酶酶解产物中REEYLLLK强度最高,由包含GTPase活化蛋白2的IQ模体(IQGAP2)的F1MTR1蛋白水解产生,其活性来源为YLL残基[22]和LK残基[20];KGNYLILK次高,来源于血小板内皮细胞粘附分子的A0A3Q1MHJ9蛋白,其活性来源为LK残基[19];RNDEELNK强度第三,为组成组蛋白H2AFJ的Q3ZBX9蛋白水解产物,其活性来源为EL残基。
胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解奶牛胎盘组织有潜在抗氧化活性多肽共同特征分别是含有EL、LY、MM、LK、IR、MY、VY等残基,HL、LK、TY、HH、EL等残基和LK、IR、EL等残基,上述残基中含有Y、M、H和K等具有自由基清除能力的氨基酸,L、I和V等疏水性氨基酸,酸性氨基酸E和碱性氨基酸K、R、H。上述氨基酸残基与资料研究报道一致[34-36],可能是奶牛胎盘酶解产物抗氧化活性的来源。另外,本研究表明,胰蛋白酶、胃蛋白酶和木瓜蛋白酶酶解产物十肽及以下具有潜在抗氧化能力的肽段分别占十肽及以下肽段总量39.14%、32.80%和53.33%,木瓜蛋白酶酶解产物的潜在抗氧化能力最强,结果进一步说明了木瓜蛋白酶具有广泛特异性[26],更适用于奶牛胎盘活性多肽制备。
4 结 论
通过利用LC-MS/M技术对酶解产物定性和定量分析,胰蛋白酶在蛋白质组学中可靠性和准确率均高于胃蛋白酶,而木瓜蛋白酶最差;木瓜蛋白酶对奶牛胎盘酶解更彻底,其酶解产物十肽以下具有潜在抗氧化能力肽段占比最高,潜在抗氧化活性最强;奶牛胎盘酶解产物抗氧化活性多来源于EL、LY、MM、LK、IR、MY、VY、HL、TY、HH等氨基酸残基。研究结果为奶牛胎盘蛋白组学选择蛋白酶和提取奶牛胎盘抗氧化活性多肽提供理论基础,促进奶牛胎盘开发利用。