四川省食品动物源大肠杆菌mcr-1与ESBLs基因共转移分析
仇剑宇 舒 刚 杨承霖 甘 婷 林居纯
(四川农业大学 动物医学院,成都 611130)
多黏菌素类是医学临床上治疗多重耐药阴性菌感染的关键抗生素,被认为是临床用药最后一道防线[1]。上世纪80年代初,多黏菌素在我国被批准用于养殖业,作为药物饲料添加剂以防治动物肠道感染和促进生长[2]。在较长一段时间,临床检测发现细菌对多黏菌素的耐药性维持在较低水平,且耐药性由染色体介导,只能垂直传播[3]。近年来,耐药性监测发现食品动物源细菌对多黏菌素耐药率明显上升。2015年Liu等[4]首次从猪源大肠杆菌携带的质粒中检出mcr-1基因,且发现该基因编码的MCR-1蛋白能导致细胞质膜上脂质A被磷酸乙醇胺共价修饰,使细菌细胞外膜与多黏菌素亲和力下降,导致对多黏菌素类耐药。此后,在全球各地,包括患者、环境、食品、家养和野生动物源分离菌中均检出mcr-1[5]。回顾性监测发现,早在上世纪80年代,我国鸡源大肠杆菌中就存在mcr-1。随时间推移,该基因检出率呈爆发式上升,尤其在食品动物源菌株中检出率非常高[3,5],如2018年我国猪源大肠杆菌中mcr-1检出率高达76.2%[6]。通过动物源和人源mcr-1阳性菌株分子特性比较发现,通过食物链、水等自然环境或与动物直接接触,该基因存在从动物扩散到人的可能,这给公共安全造成了威胁[5]。
研究表明,携带mcr-1的质粒类型具有多样性,最常见有IncI2,IncHI2和IncX4型质粒。这些质粒可以在肠杆菌科细菌间发生接合转移,其中IncI2和IncHI2可同时携带ESBLs、PMQR和其他耐药基因,导致多耐药基因共转移[7-8]。多耐药基因共转移会造成在使用其他抗生素时,也会对mcr-1产生选择作用,使得mcr-1的扩散和耐药问题更加严重。四川省是中国畜牧业大省,养殖规模逐年扩大,多重耐药菌株的出现严重威胁着畜牧生产的健康发展。大肠杆菌作为食品动物体内最常见的致病菌和共栖菌,是耐药性传播的重要细菌,也是目前报道最易携带mcr-1的菌种,约占mcr-1阳性菌株91%[5],可将多耐药基因传递给其他致病菌,甚至通过环境、食品等再传播给其他动物和人类。因此,调查大肠杆菌中耐药基因的流行情况,对四川省的耐药性检测是非常重要的。本次研究以四川省各地收集的不同动物源大肠杆菌为对象,检测mcr-1以及超广谱β-内酰胺酶ESBLs基因流行情况,通过质粒接合转移试验揭示耐药基因发生共转移的耐药机制。
1 材料与方法
1.1 菌株
190株大肠杆菌于2017—2018年从四川省不同养殖场患病猪、鸡、兔体内分离鉴定获得,其中156株鸡源大肠杆菌,25株猪源大肠杆菌,9株兔源大肠杆菌;质控菌ATCC25922和耐叠氮钠大肠杆菌J53 AZr由中国农业大学基础兽医学系兽医药理学教研室惠赠。
1.2 主要试剂
氨曲南等购自四川制药制剂有限公司;小量质粒提取试剂盒购自OMEGA公司;2×Taq PCR MasterMix等购自成都擎科梓熙生物技术有限公司。
1.3 药物敏感性试验
采用微量肉汤稀释法检测190株大肠杆菌对氨苄西林(AMP)、头孢噻肟(CTX)、氨曲南(ATM)、庆大霉素(GEN)、阿米卡星(AMK)、环丙沙星(CIP)和多黏菌素E(COL)最小抑菌浓度(MIC),以大肠杆菌ATCC25922株作为质控菌株。药敏折点参考CLSI-M100-S29[9]和EUCAST9.0标准判读[10]。
1.4 菌株mcr-1及ESBLs基因检测
采用E.Z.N.A.®Plasmid DNA Mini Kit I提取190株大肠杆菌的质粒DNA。mcr-1阳性菌株的ESBLs基因(blaTEM、blaCTX-M-1 group、blaCTX-M-2 group、blaCTX-M-9 group、blaCTX-M-8/25 group、blaSHV和blaOXA)采用PCR检测,靶基因、引物序列等见表1。PCR扩增产物经1.5%的琼脂糖凝胶电泳检测后送至成都擎科梓熙生物测序,将获得的耐药基因序列和GenBank核酸序列进行BLAST比对。
1.5 质粒接合转移试验
将mcr-1阳性大肠杆菌(供体菌)与大肠杆菌J53 AZr(受体菌)进行肉汤接合试验。接合子用含药(2 μg/mL多黏菌素E和200 μg/mL叠氮钠)胰蛋白胨大豆琼脂平板进行筛选[14]。采用微量肉汤稀释法检测接合子药物敏感性,提取接合子质粒DNA扩增相关耐药基因。
1.6 数据统计及分析
使用SAS9.0软件FREQ程序进行耐药率组间差异性分析,P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 菌株mcr-1基因检测及耐药分析
190株大肠杆菌的mcr-1检出率为36.84%(70/190)(图1),其中,鸡源和猪源菌株mcr-1检出率分别为41.67%(65/156)和20.00%(5/25),尚未在兔源菌中检出该基因。
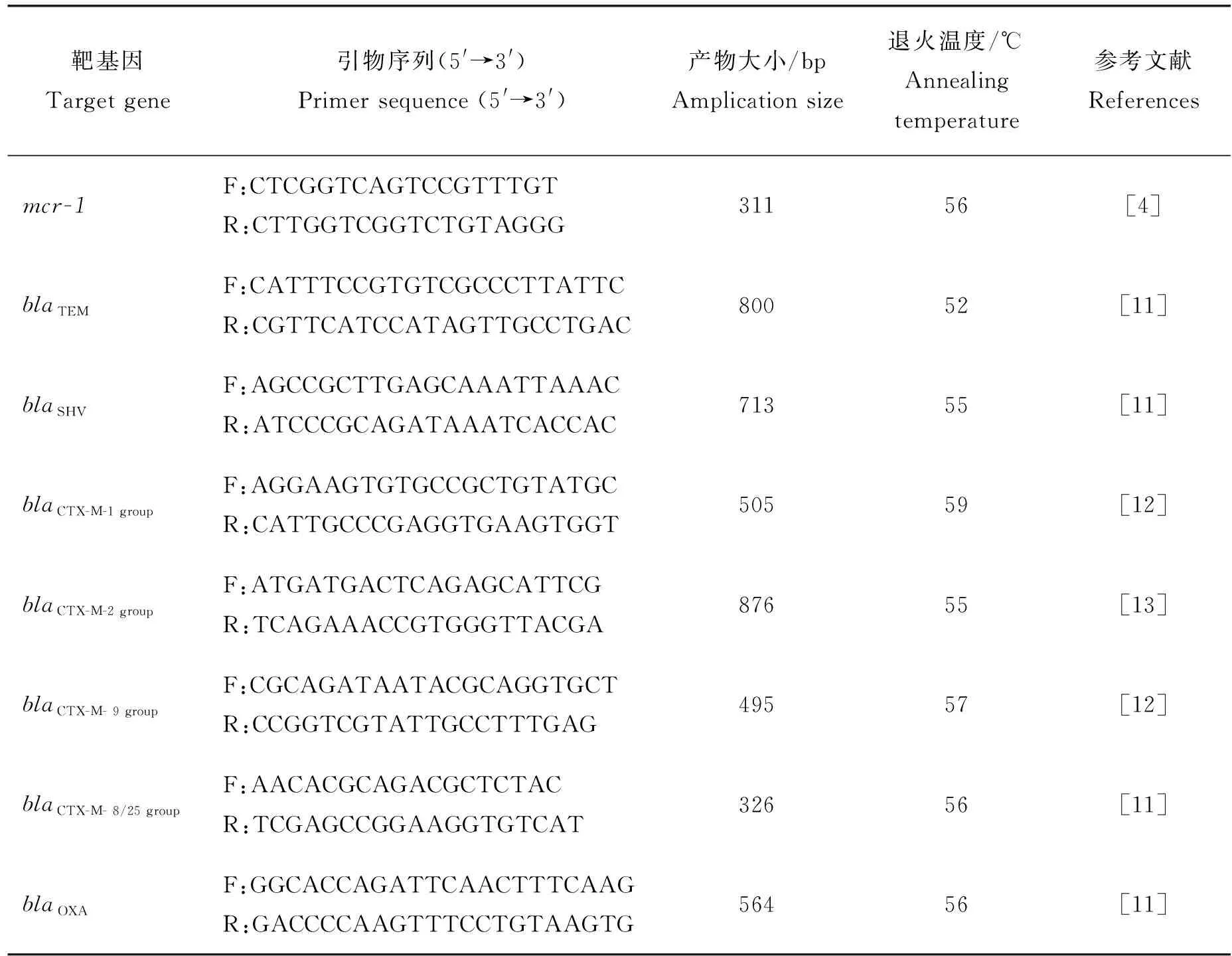
表1 mcr-1及ESBLs基因扩增引物信息Table 1 Information of specific primers for mcr-1 and ESBLs genes

M,DNA标记DL 2 000;1~2,mcr-1阴性菌株; 3~6,mcr-1阳性菌株 M, DNA Marker DL 2 000; 1-2, mcr-1 negative strain; 3-6, mcr-1 positive strain 图1 部分鸡源大肠杆菌mcr-1基因PCR扩增Fig.1 PCR amplifications of mcr-1 of E.coli in chickens
药敏试验显示,190株菌除对庆大霉素(GEN)耐药率为27.37%,对其余药物的耐药率均超过30%,其中对氨苄西林(AMP)高达95.79%,其次是氨曲南(ATM)65.26%、多黏菌素E(COL)47.89%、头孢噻肟(CTX)35.26%、阿米卡星(AMK)32.63%和环丙沙星(CIP)32.11%。比较mcr-1阳性和阴性菌株的耐药性可见,mcr-1阳性菌株对氨曲南(ATM)、头孢噻肟(CTX)和多黏菌素E(COL)耐药率极显著高于mcr-1阴性菌(P<0.01),对其他药物的耐药率差异均不显著(P>0.05)(图2),其中mcr-1阳性大肠杆菌对多黏菌素E(COL)耐药率高达92.9%。
2.2 mcr-1阳性菌的ESBLs基因检测
70株mcr-1阳性菌携带质粒大小约为2 kb>15 kb,75.71%菌株检出了ESBLs基因。测序结果显示,blaTEM-1、blaCTX-M-55和blaCTX-M-14的检出率分别为71.43%、22.86%和17.14%,未检出其他ESBLs基因(图3)。
2.3 mcr-1阳性菌株的质粒接合转移分析
mcr-1阳性菌株质粒接合转移率为47.14%(33/70)。33株mcr-1阳性接合子及其供体菌的MICs、耐药率比较可见,接合子及其供体菌对多黏菌素E的MIC在2~8 μg/mL,说明菌株对多黏菌素E(COL)呈低水平耐药。接合子对头孢噻肟(CTX)、氨曲南(ATM)、庆大霉素(GEN)、阿米卡星(AKM)、环丙沙星(CIP)和多黏菌素E(COL)的MIC50值低于供体菌,但两者的MIC90值和耐药率无显著性差异(表2)。
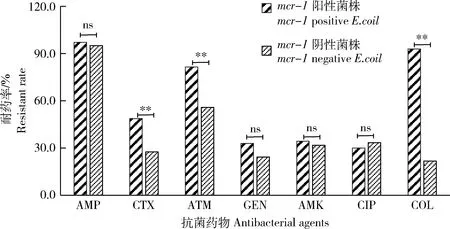
**表示差异极显著(P<0.01),ns表示差异不显著(P>0.05)。 ** indicates extremely significant difference (P<0.01). ns indicates no significant difference (P>0.05). AMP:氨苄西林;CTX:头孢噻肟;ATM:氨曲南;GEN:庆大霉素;AMK:阿米卡星;CIP:环丙沙星;COL:多黏菌素E AMP: ampicillin; CTX: cefotaxime; ATM: aztreonam; GEN: gentamicin; AMK: amikacin; CIP: Ciprofloxacin; COL:Colistin 图2 mcr-1阳性和阴性菌株耐药率比较Fig.2 Comparison of resistant rates between mcr-1 positive and negative strains
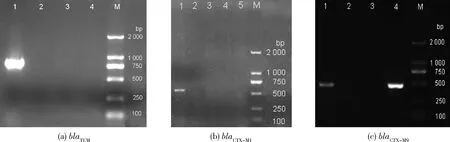
M,DNA标记DL2 000;(a)-1、(b)-1、(c)-1、(d)-4为阳性菌株;其余为阴性菌株。 M, DNA Marker DL2 000; (a) -1, (b) -1, (c) -1 and (d) -4 were positive strains; The rest were negative strains.图3 β-内酰胺类基因(ESBLs)PCR 扩增Fig.3 PCR amplifications of β-lactamase genes (ESBLs)
对33株接合子基因检测显示,19株接合子只检出mcr-1基因,14株同时检出mcr-1和ESBLs基因,其中同时检出blaTEM-1(13株)、blaCTX-M-55(9株)和blaCTX-M-14(2株);与供体菌相比,尽管14株共转移接合子对庆大霉素(GEN)、阿米卡星(AKM)、环丙沙星(CIP)等药物的MIC值仅为供体菌的1/2或1/32,但却是受体菌J53 AZr的几十甚至几百倍,而且保留了对多黏菌素、β-内酰胺类药物较高的耐药率(表3);分析接合子质粒可见,大小分别约为5、8和>15 kb质粒,其中~5 kb质粒仅携带mcr-1,~8和~>15 kb质粒同时携带mcr-1和ESBLs基因(表3)。
3 讨论与结论
随着抗生素的长期使用或滥用,耐药性问题已成为全球公共安全最严重的威胁之一。“One health”理念中,动物在“人类—动物—环境”整体健康中占重要地位。目前对食品动物源细菌耐药性监测,更注重那些在医学临床使用的关键药物,如第三代头孢、氟喹诺酮类和多黏菌素等[15]。本研究耐药性检测结果显示,四川省食品动物源大肠杆菌除对氨苄西林、庆大霉素、环丙沙星等兽医临床常用药物耐药外,对头孢噻肟、氨曲南、阿米卡星等兽医临床未批准使用的药物也呈严重耐药性(耐药率范围32.63%~65.26%)。这说明耐药性的产生不仅与抗菌药物使用强度有关,可能还与不同抗菌药物间存在交叉或共耐药相关[16]。
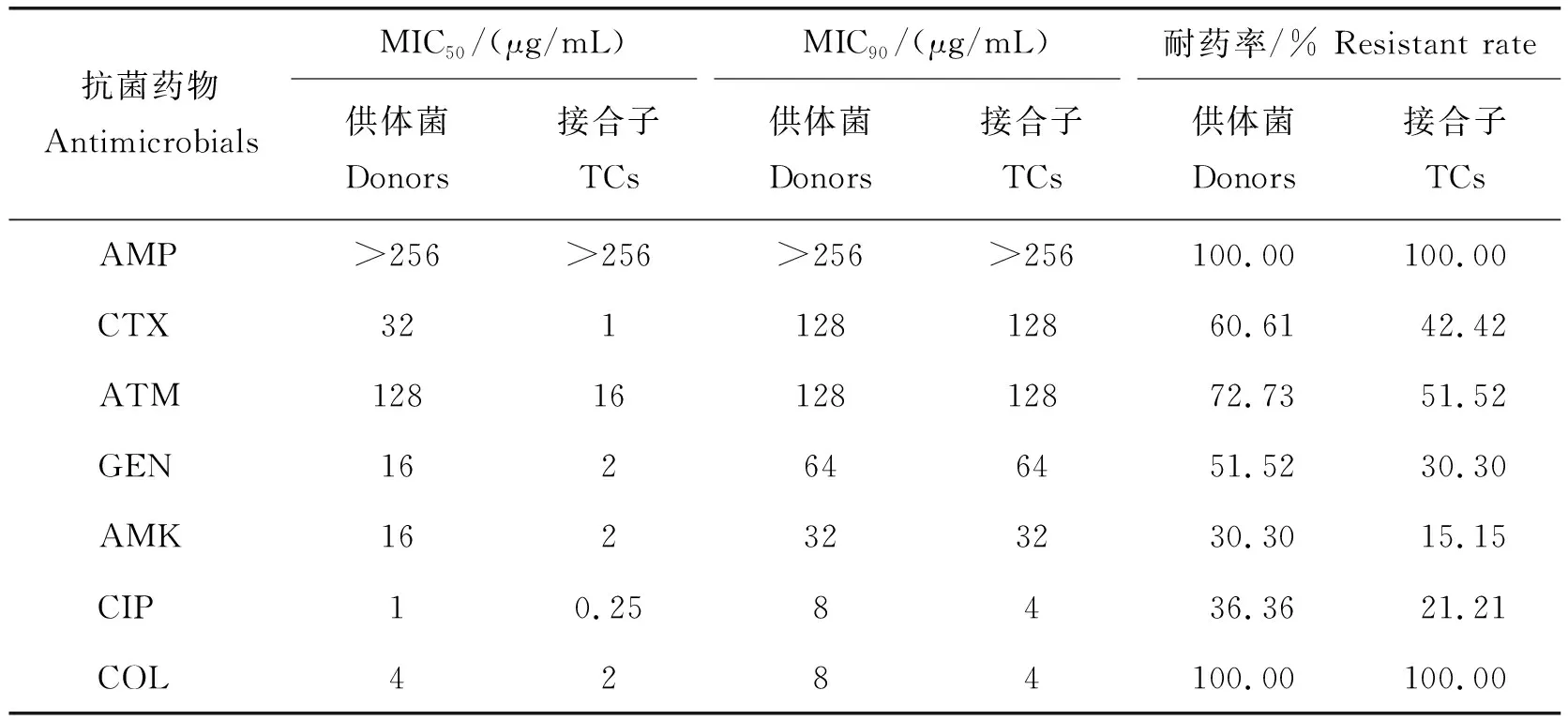
表2 33株接合子(TCs)及其供体菌的MIC50,MIC90及耐药率Table 2 MIC50, MIC90 and resistant rate of 33 transconjugants and their donors

表3 14株供体菌和接合子(TCS)的MICs、携带质粒大小及ESBLs基因Table 3 The MICs, plasmid size and ESBLs gene of 14 donors and their transconjugants (TCs)
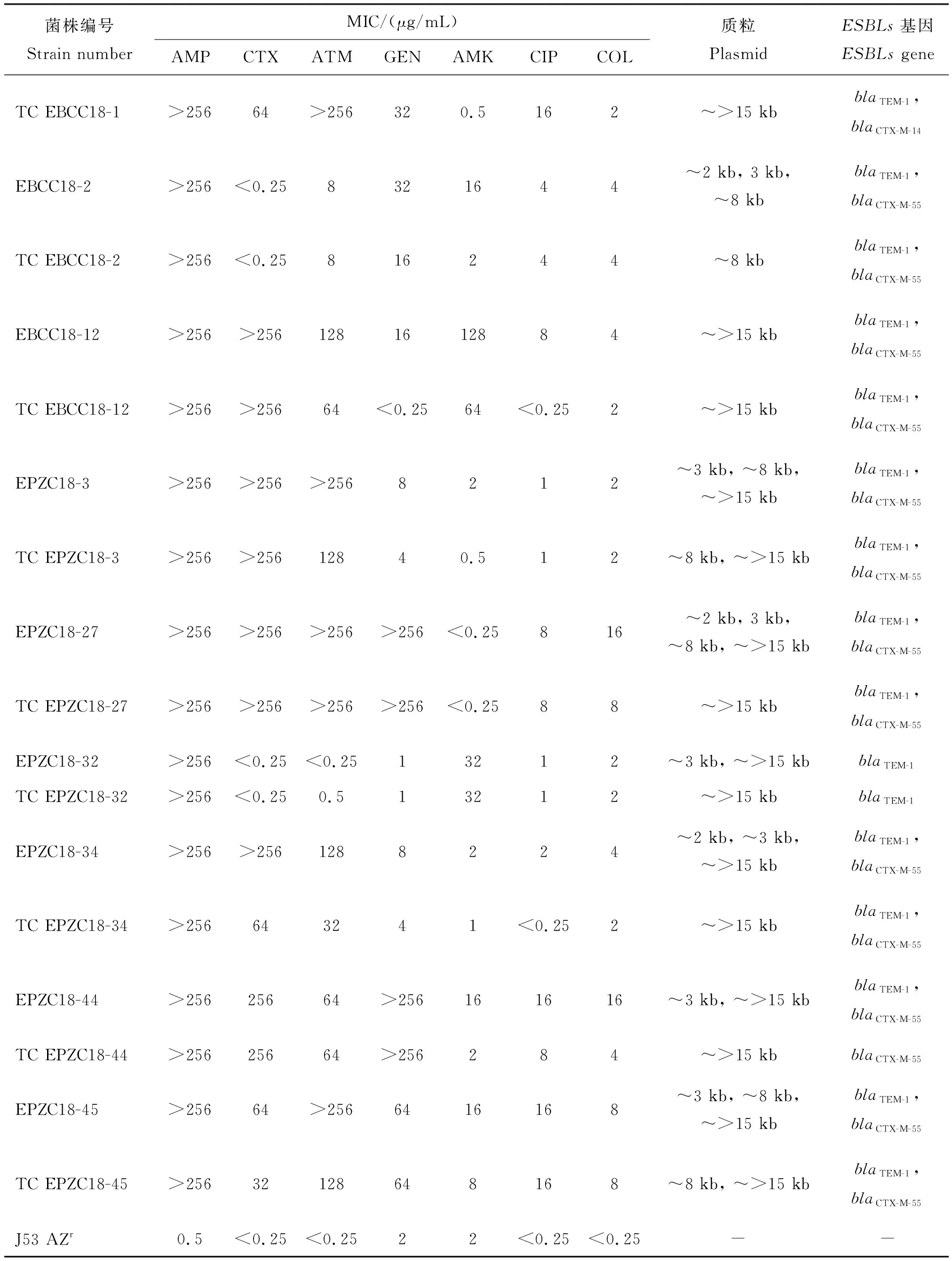
表3(续)
本研究中190株食品动物源大肠杆菌中mcr-1检出率达36.84%,其中鸡源和猪源菌株中mcr-1检出率分别为41.67%和20.00%,高于华东地区鸡源菌株检出率36.66%[17],与广东等5省2011—2014年猪源菌株检出率21%接近[4],低于我国其他省份猪、鸡源菌株该基因的检出率(43.86%~76.20%)[6,18],说明在我国食品动物源大肠杆菌中mcr-1广泛存在,但该基因流行存在地区差异。
研究表明,mcr-1可以与其他耐药基因共存在[19]。本研究从70株mcr-1阳性菌中检出75.71%菌株携带ESBLs基因,这与其他报道认为mcr-1常与ESBLs共存在和共转移一致[19-21]。这也诠释了mcr-1阳性菌株比阴性菌株对第三代头孢类具有更强的耐药性的原因。目前,在我国食品动物源大肠杆菌中blaCTX-M是ESBLs最主要的基因型,其中以blaCTX-M-55和blaCTX-M-14为主[17,22]。本研究在mcr-1阳性菌株中blaCTX-M-55和blaCTX-M-14的检出率分别达22.86%和17.14%,与本研究发现的2010—2016年菌株blaCTX-M基因流行以blaCTX-M-55和blaCTX-M-14为优势基因型相符,所编码的CTX-M酶介导对青霉素类和第3代头孢菌素耐药[23]。此外,mcr-1阳性大肠杆菌中blaTEM-1检出率高达71.43%,说明blaTEM-1在四川省食品动物源大肠杆菌中已经获得了稳固存在和传播的能力。尽管blaTEM-1介导窄谱β-内酰胺酶,但由于该基因容易发生突变导致新的TEM酶出现,扩大水解底物谱,导致多重耐药菌株流行[24]。
R质粒作为介导耐药基因转移的可移动元件,在耐药性水平传播中发挥重要作用。本研究中70株mcr-1阳性菌经质粒接合转移获33株接合子(转移率47.14%),其中14株发生了mcr-1与ESBLs基因共转移,且参与菌株耐药性的表达,使受体菌对多黏菌素和β-内酰胺类药物产生耐药性。关于37株mcr-1阳性菌株未结合转移成功,可能是菌株携带的质粒属于非结合型质粒,需要通过转化或转导方式在不同菌株间传播。
综上所述,本研究表明在四川省食品动物源大肠杆菌耐药性较严重,且对医学临床使用的关键药物也呈耐药性。耐药菌株中mcr-1流行率较高,与ESBLs基因共存在较普遍,耐药基因借助质粒易发生水平传播,导致多重耐药菌株的产生和流行。这给动物、人类或环境造成巨大威胁,动物养殖业应加强mcr基因与其他耐药基因的监测,针对耐药性问题采取严格防控措施,谨慎和合理有效地使用抗生素,缓解耐药性的产生和传播,保障动物养殖健康发展和畜禽产品质量安全。

