HIV-1 感染者免疫活化对宿主限制因子SAMHD1表达和HIV-1 DNA 水平的影响
饶和平 姚水洪 王炜 靳昌忠
1衢州职业技术学院医学院“衢州市病毒致瘤研究科技创新团队”(浙江衢州 324000);2衢州市疾病预防控制中心艾滋病实验室(浙江衢州 324000);3浙江大学医学院附属第一医院传染病诊治国家重点实验室(杭州 310003)
不育-α-基序结构域和组氨酸/天冬氨酸残基双联体结构域包涵蛋白1(sterile alpha motif domain and HD domain 1,SAMHD1)是一种HIV-1 宿主限制因子,它通过水解dNTP 降低细胞内dNTP水平,使病毒逆转录过程由于缺乏足够的dNTP而受阻[1-4]。SAMHD1 的表达受干扰素调控[5-6],HIV-1 感染者外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中的SAMHD1表达与血浆IFNα浓度呈正相关[7]。HIV-1 DNA水平是HIV-1储藏库的指标,SAMHD1 可以限制HIV-1 RNA 逆转录成DNA,进而影响HIV-1 储藏库的形成[8-10]。体外研究发现SAMHD1 可以影响靶细胞内的HIV-1 DNA 水平[11-12],但HIV-1 感染者体内SAMHD1 是否对CD4+T 细胞HIV-1 DNA 水平有影响目前还不清楚。本文研究了SAMHD1 表达与免疫活化和HIV-1 DNA 水平的关系,初步探索SAMHD1 与HIV-1 储藏库的关系。
1 对象与方法
1.1 研究对象HIV-1 感染者来自2019 年8-11 月期间浙江大学附属第一医院就诊患者。纳入标准:年满18 周岁且不超过(含)75 周岁,经初筛和确认试验HIV-1 抗体阳性;排除标准为:近期有机会性感染,或并发肿瘤或风湿免疫性疾病,或合并HBV/HCV 感染。共选取57 例未接受抗病毒治疗的HIV-1 感染者作为未治疗组,62 例接受抗病毒治疗1 年以上且病毒载量低于检测限的HIV-1 感染者作为治疗组,48 例健康体检者作为健康对照组。本研究得到浙江大学附属第一医院伦理委员会批准,所有研究方案均告知患者本人,并签订了知情同意书。
1.2 方法
1.2.1 HIV-1 RNA 及DNA 检测HIV-1 RNA 检测采用HIV-1 Monitor 1.5(Roche 公司,瑞士)试剂盒,在COBAS Amplisemsor-PCR 仪上,对血浆样品的HIV-RNA 作定量分析,操作按照试剂盒说明进行,结果以每毫升血浆含病毒拷贝数表示,最低检测限50 拷贝/mL。细胞内的HIV-1 DNA 检测先使用QIAamp DNA Blood Mini kit(凯杰公司,德国)提取外周血总DNA,按说明书操作进行。采用HIV-1 DNA Detection Kit(PCR-Fluorescent Probing)(广州海力特公司)试剂盒检测HIV-1 感染者外周血HIV-1总DNA。取5 μL DNA 模板,加入45 μL PCR 预混液中。反应条件为:(1)37 ℃5 min,95 ℃10 min;95 ℃15 s,65 ℃15 s,72 ℃20 s,反应5 循环;(2)95 ℃15 s,62 ℃15 s,72 ℃20 s,反应40 循环;(3)95 ℃15 s,52 ℃15 s,72 ℃32 s,反应10 循环。细胞中HIV DNA 含量结果计算:同步扩增标准品,绘制标准曲线,分别定量每份样本中HIV DNA(单位:拷贝/mL),除以PBMC 定量结果(单位:个/mL),再乘以106得出标本中每106个细胞中HIV DNA 含量(单位:拷贝/兆细胞)。
1.2.2 CD4+T细胞定量和免疫活化检测以CD4+T细胞表面CD38 分子的表达作为CD4+T 细胞免疫活化的标志[13-14],使用美国Coulter 公司流式细胞仪和三色标记CD3/CD4/CD38 单抗绝对定量试剂盒进行检测,取全血50 μL,用20 μL 单克隆抗体混合物孵育1 h,用红细胞裂解液裂解红细胞之后上机检测。用systemU 软件进行分析。
1.2.3 血浆IFNα 水平检测采用人IFNαELISA检测试剂盒(R&D 公司)检测血浆IFNα 水平,操作按照说明书所述步骤进行。
1.2.4 SAMHD1表达定量检测每人抽取EDTA抗凝血5 mL,用密度梯度离心法分离PBMC,并进一步用CD4+T 细胞分选磁珠(美天旎公司,德国)分选CD4+T 细胞。用TRIzol 溶液(Invitrogen,美国)提取PBMC 和CD4+T 细胞总体RNA 后,采用PrimeSciptTM逆转试剂盒和SYBR 定量检测试剂(大连宝生物有限公司)进行逆转录和实时荧光定量PCR 反应。反应条件为:先在95 ℃反应30 s,再在95 ℃5 s 和60 ℃30 s 反应40 循环。SAMHD1 mRNA 检测上游引物为:5′-AAAACCAGGTTTCACAACTTCTGC-3′,下游引物为:5′-TGCGGCATACAAACTCTTTCTGT-3′,以GAPDH 为内参(上游引物:5′-TGCACCACCAACTGCTTAGC-3′下游引物:5′-GGCATGGACTGTGGTCATGAG-3′)。利用2-ΔΔCt相对定量法来计算SAMHD1 的相对表达量。
1.3 统计学方法使用SPSS 20.0 软件进行统计分析,HIV-1 病毒载量、HIV-1 DNA 和SAMHD1 mRNA 水平以M(P25,P75)表示,其余数据以均值±标准差表示,非正态分布数据及方差不齐的正态分布数据采用非参数检验,正态分布且方差齐的数据两两比较采用student-t检验,三组比较采用单因素方差分析,采用Pearson 检验分析数据的相关性,P<0.05 表示差异有统计学意义。
2 结果
2.1 HIV-1 感染者基本情况57 例未接受抗病毒治疗者CD4+T 细胞数(276.1±104.8)个/μL,病毒载量63 055(5 149,525 371)拷贝/mL;62 例接受抗病毒治疗者平均抗病毒治疗(3.6±2.1)年,平均CD4+T 细胞数(405.3±131.2)个/μL,病毒载量均低于检测限,见表1。
表1 研究对象临床信息及免疫学和病毒学指标Tab.1 Clinical information,immunological and virological indexes of subjects
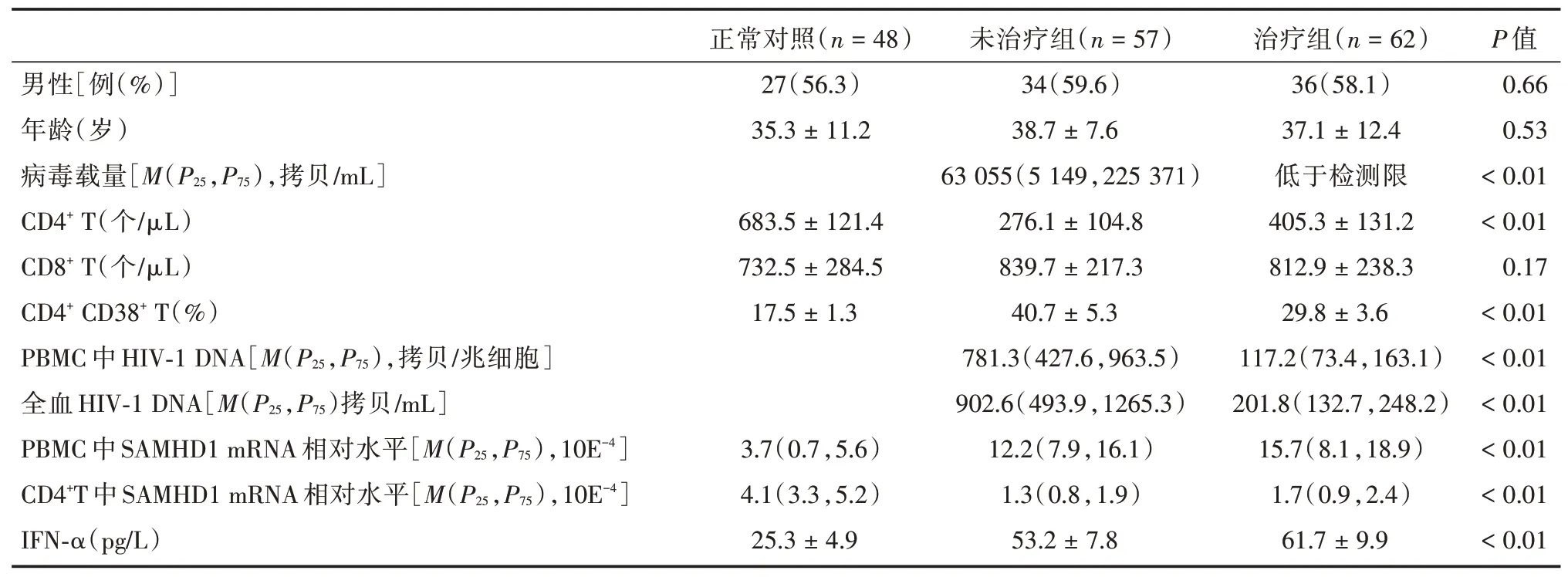
表1 研究对象临床信息及免疫学和病毒学指标Tab.1 Clinical information,immunological and virological indexes of subjects
2.2 HIV-1 感染者CD4+T 细胞免疫活化和干扰素IFN-α 水平HIV-1 感染者未治疗组平均CD4+CD38+T 细胞百分比为(40.7 ± 5.3)%,高于治疗组(29.8 ± 3.6)%(P<0.01),两组均显著高于健康对照组(17.5 ± 1.3)%(P<0.01)。HIV-1 感染者血浆IFN-α 浓度显著高于正常对照组(P<0.01),升高约2~3 倍;未治疗组和HAART 治疗组之间差异无统计学意义(P>0.05),见表1。
2.3 HIV-1 感染者外周血HIV-1 DNA 水平未治疗组HIV-1 DNA水平为781.3(427.6,963.5)拷贝/兆PBMC,或902.6(493.9,1 265.3)拷贝/mL 全血,高于治疗组117.2(73.4,163.1)拷贝/兆PBMC,或201.8(132.7,248.2)拷贝/mL 全血(P<0.01)。见表1。
2.4 HIV-1 感染者PBMC 和CD4+T 细胞中SAMHD1 表达水平未治疗组HIV-1 感染者PBMC 中SAMHD1 mRNA 相对表达水平为12.2(7.9,16.1)×10E-4,治疗组HIV-1感染者PBMC中SAMHD1 mRNA相对表达水平为15.7(8.1,18.9)×10E-4,均高于健康对照组[3.7(0.7,5.6)×10E-4](P<0.01)。未治疗组HIV-1 感染者CD4+T 细胞中SAMHD1 mRNA 相对表达水平为1.3(0.8,1.9)×10E-4,治疗组HIV-1感染者CD4+T 细胞中SAMHD1mRNA 相对表达水平为1.7(0.9,2.4)×10E-4,均低于健康对照组[4.1(3.3,5.2)×10E-4](P<0.01)。治疗组和未治疗组之间差异均无统计学意义。见表1。
2.5 HIV-1感染者SAMHD1 mRNA表达与HIV-1 DNA 和细胞免疫活化相关性两组感染者CD4+T细胞SAMHD1 mRNA 的表达与免疫活化均呈负相关,未治疗组R值为-0.81(P<0.01),治疗组R值为-0.78(P=0.015);未治疗组PBMC 中SAMHD1 mRNA 的表达与CD4+T 细胞免疫活化呈负相关,R值为-0.31(P=0.03),治疗组R值为-0.42(P=0.15)。两组感染者PBMC和CD4+T细胞中SAMHD1 mRNA的表达水平与外周血HIV-1 DNA 水平均无显著相关性,见表2。

表2 SAMHD1 表达与免疫活化和HIV-1 DNA 水平的相关性Tab.2 Correlation between SAMHD1 expression and immune activation and HIV-1 DNA level
3 讨论
SAMHD1 是髓系细胞(如树突状细胞和巨噬细胞)中HIV-1 感染的主要限制因子[15],静息CD4+T 细胞高表达SAMHD1 并可以减少HIV-1 的感染[16-17]。本研究发现HIV-1 感染者PBMC 中SAMHD1 表达升高,这与先前的研究一致[6],但是CD4+T 细胞中SAMHD1 表达有所下降。对于PBMC 和CD4+T 细胞中SAMHD1 表达趋势相反的现象,可能与以下原因有关:HIV-1 感染者CD4+T 细胞数量下降,导致PBMC 的组成比例发生改变,髓系细胞比例相对升高;HIV-1 感染者高表达SAMHD1 的静息CD4+T 比例明显降低,活化细胞比例上升[6],从而导致平均SAMHD1 表达水平下降。
干扰素α 可以诱导SAMHD1 的表达[7],HIV-1感染者PBMC 中SAMHD1 表达升高可能与干扰素水平升高有关。CD4+T 细胞中SAMHD1 表达受免疫活化影响更大。笔者发现HIV-1 感染者CD4+T细胞中SAMHD1 mRNA 表达均较健康对照显著下降,与CD4+T 细胞免疫活化呈显著的负相关性,这可能与HIV-1 感染者CD4+T 细胞广泛活化,静息细胞比例减少有关。及早抗病毒治疗不仅可以抑制HIV-1 的复制,还可以降低CD4+T 细胞免疫活化[13]。
SAMHD1 对逆转录过程的抑制会导致HIV-1总DNA 的产生减少[18-19]研究发现,与未治疗组比,抗病毒治疗患者外周血中HIV-1 总DNA 水平显著降低。CD4+T 细胞SAMHD1 表达与HIV-1 总DNA水平之间没有显著相关性。HIV-1 总DNA 水平受很多因素影响,除SAMHD1 以外还包括HIV-1 RNA 水平、活化CD4+T 细胞数量、外泌体2LTR等[19-20]。
总之,本研究发现,HIV-1 感染者CD4+T 细胞中SAMHD1 的表达与CD4+T 细胞免疫活化负相关,与总HIV-1 DNA 水平无明显相关性。本研究显示了及早抗病毒治疗以抑制CD4+T 细胞免疫活化的重要性,较低的CD4+T 细胞免疫活化水平不仅可以减少HIV-1 的靶细胞,还可以提高SAMHD1的表达水平,抑制HIV-1 的整合,从而降低HIV-1的感染及储藏库的形成。

